白皮松种子萌发过程中呼吸代谢和内源激素对温度变化的响应
2021-03-23郭聪聪沈永宝史锋厚
郭聪聪,沈永宝,史锋厚
(1.江苏农林职业技术学院 风景园林学院,江苏 句容 212400;2.南京林业大学 a.风景园林学院;b.南方现代林业协同创新中心;c.林学院;d.国家林业和草原局南方林木种子检验中心,江苏 南京 210037)
白皮松Pinus bungeana为松科Pinaceae 松属Pinus的常绿针叶树种,是东亚地区唯一的三针松,是我国特有树种。其耐旱、耐寒、抗污染,并且观赏价值高,在城市绿化和北方地区的荒山造林中广泛应用[1-2]。此外,它的球果和花粉是珍贵的中药材,松脂为重要的化工原料,种子可食用。
种子萌发是一个复杂的生理过程,受自身内部因子和外部环境因子的影响。每种因子都对发芽过程有特定的影响,通过单独作用或者相互之间协同作用来调控种子的萌发[3]。温度是影响种子萌发的重要环境因子,并且大多数物种需要适当的温度范围或交替变温的模式以实现最大的萌发率。在一些植物中,种子的发芽习性还与种子的产生时间和散落时间有关,这是由种子成熟过程中母本植物所经历的环境条件以及散落后种子所经历的环境条件所引起的[4]。温度可以直接作用于吸水和生理代谢反应来调控种子萌发过程,从而影响种子的发芽率和萌发速率[5]。发芽率通常随温度升高到最佳温度而线性增加,此后发芽率急剧下降[6-8]。温度升高不仅影响种子发芽后的幼苗生长,而且直接影响发芽过程。为了防止发芽后幼苗受损,种子中可能会发生某些生理反应以应对外界的高温环境,产生热抑制,发芽停止,当遇到合适的温度后立即发芽[9]。这种生态需求可以被视为植物的一种适应性机制,以确保幼苗存活和生长发育的有利条件[10]。此外,温度还可以通过去除初生休眠或诱导次生休眠来调节种子萌发。如成熟脱落的青钱柳(Cyclocarya paliurus)种子在经过冬季的自然低温作用后,初生休眠已部分或完全解除,但在此过程中若遭遇不良环境条件(如中断冷层积提高温度),种子则再次进入休眠状态(二次休眠)[11]。
白皮松主要通过种子繁殖,以往文献的相关研究多集中在种子休眠上[12-15],如种胚的发育状况、种皮透性问题和萌发抑制物等方面,培养条件的设置通常为25℃,而种子萌发所需的环境条件并未引起足够的重视。所以本文主要研究了白皮松种子萌发的适宜温度条件,并探索了萌发过程中呼吸代谢途径以及激素含量对外界温度变化(适温20℃和高温25℃)所做出的响应,这对白皮松种子繁育具有重要意义,并为种子萌发热抑制的探索提供一定理论参考。
1 材料与方法
1.1 试验材料
新鲜的白皮松种子于2018年10月采于甘肃省天水市小陇山(34°05′~34°40′N,105°30~106°30′E,700~2 500 m)的天然白皮松林。球果晾干至种鳞开裂时,经人工脱粒、水选以及弃去破损粒、虫蛀粒和杂质后,进行不同温度的萌发试验。种子含水量9.92%,生活力96%。
1.2 研究方法
1.2.1 种子萌发试验
试验设置5 个温度分别为10、15、20、25 和30℃,每个处理3×100 粒种子,在蒸馏水中浸泡96 h 后摆放在湿润脱脂棉上,置于不同温度的光照培养箱进行萌发试验。在30 d 的培养过程中,每天观察并记录发芽种子数,胚根长度≥2 mm 则视为种子萌发,试验结束时计算发芽率、平均发芽时间(Mean germination time,MGT)以及发芽速率(Speed of germination,SG)。

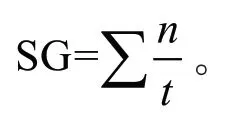
式中:n为第t天萌发种子数。
1.2.2 种子萌发过程中呼吸代谢关键酶活性和激素含量测定
从上述不同温度的萌发试验得出白皮松种子可以萌发的温度范围(15~20℃),超过该范围则种子萌发受阻。而高温与种子萌发呼吸方式和激素含量变化密切相关,温度过高通常会降低吸胀种子中的溶氧量,影响种子呼吸作用。同时,低氧会影响ABA8'-羟化酶活性,干扰ABA 氧化分解代谢,进而通过激素之间的互作效应,参与种子萌发的调控[16-18]。所以试验设置了抑制萌发的高温25℃(这也是以往研究通常采用的温度)和适宜萌发的温度20℃作为培养条件研究了种子萌发过程中呼吸途径及激素变化,也在一定程度上揭示种子在高温下萌发失败的原因。
种子吸胀96 h 后置于湿润脱脂棉上进行萌发试验。试验过程中每2 天取样一次,14 d 时结束取样。每次取样后,随机抽取3×40 粒种子,用小钳子夹裂后去掉内、外种皮,剥出种胚、胚乳切片混匀,分别称取胚和胚乳各0.3 g,放入-80℃冰箱贮存待测各项生理指标。磷酸己糖异构酶(PGI)、G-6-PDH 和6-PGDH 联合酶的活性测定参照Wary 和Brown 的方法[19],苹果酸脱氢酶(MDH)活性测定参照朱广廉法[20]。内源激素玉米素核苷(ZR)、生长素(IAA)、赤霉素(GA3)和脱落酸(ABA)含量测定采用酶联免疫法[20]。
1.3 数据处理
用Excel 2010 软件处理数据和绘制图表,SPSS 19.0 软件进行单因素方差分析、Duncan 多种对比和Pearson 相关性分析。
2 结果与分析
2.1 不同温度条件下种子的萌发
温度对白皮松种子萌发具有显著影响(P<0.05),且不同温度下种子的开始萌发时间也不同(图1)。20℃下种子开始萌发时间最早,置床7 d 后种子开始萌发。15℃下种子从10 d 后开始萌发,而25℃和30℃下,少数种子从14 d 左右开始萌发。20℃下种子30 d 后最终发芽率为92.67%,显著高于15℃下种子发芽率87.33%。20℃下种子的平均发芽时间和发芽速率分别为13.45 d、5.62%.d-1,均显著优于15℃中的平均发芽时间17.61 d 和发芽速率5.23%.d-1(图2)。随着温度继续升高,种子发芽率急剧降低,25℃和30℃下种子发芽率分别为5%和1%,且两者平均发芽时间均大于20 d,发芽速率均小于1%.d-1。而10℃下则没有种子萌发。

图1 不同温度下种子的萌发进程Fig.1 Germination process of seeds at different temperatures
2.2 种子萌发过程中呼吸代谢关键酶活性变化
2.2.1 磷酸己糖异构酶(PGI)活性变化
PGI 是糖酵解途径(EMP)中六碳糖向丙酮酸转化过程中的关键酶,其活性变化可以在一定程度上反映EMP 的活化程度。20℃下,白皮松种子中PGI 活性变化表现为初期有所降低而后维持稳定状态(图3)。胚中PGI 活性0 d 时为171.06 U·g-1,2 天时降低至139.59 U·g-1,之后未有显著变化(P>0.05),至14 天时PGI 活性为138.85 U·g-1。胚乳中PGI 活性2 天时为100.69 U·g-1,较0 天降低了25.12 U·g-1,2~14 d 胚乳中PGI 活性无明显变化,波动范围97.44~112.81 U·g-1;25℃下,种子内PGI 活性始终保持在刚置床时的高活力水平,且始终高于20℃下种子PGI 活性。胚中PGI 活性波动范围162.29~171.06 U·g-1,胚乳中PGI 活性变化范围102.03~128.83 U·g-1。表明该温度下EMP途径活化程度较高,种子可能主要经由该途径进行呼吸作用。
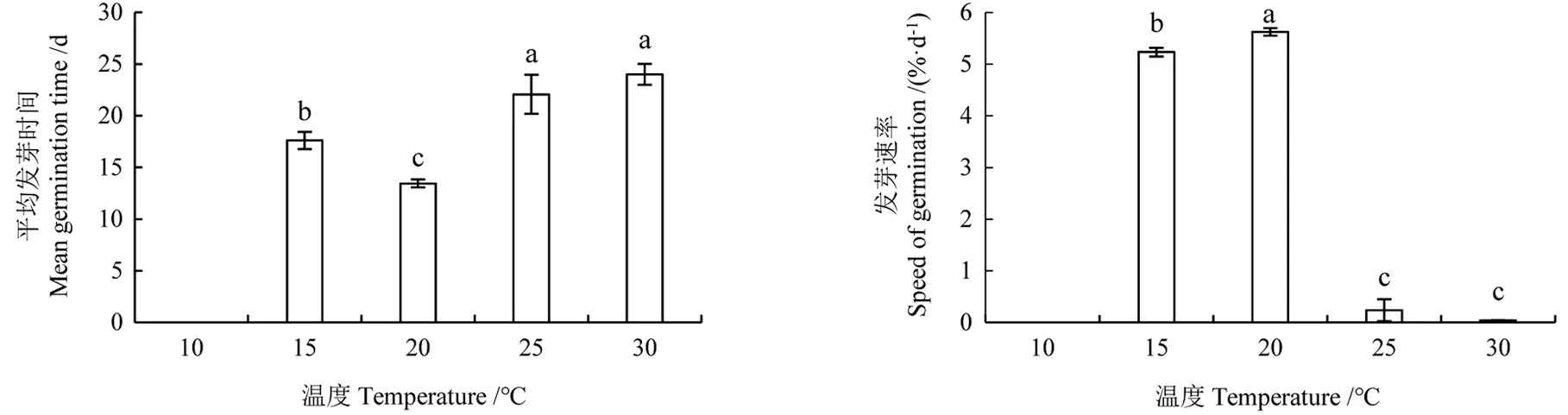
图2 不同温度下种子的平均发芽时间与发芽速率Fig.2 MGT and SG at different temperatures
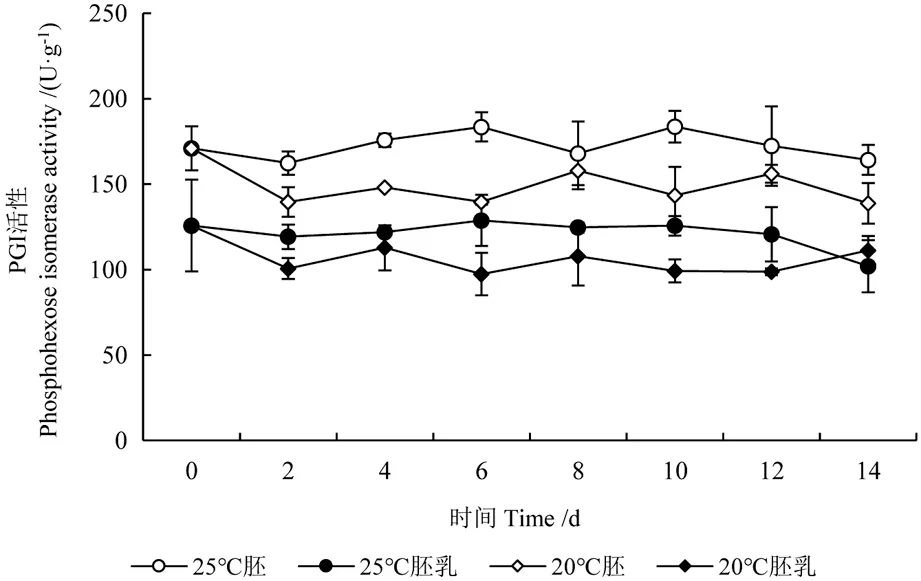
图3 种子萌发过程PGI 活性变化Fig.3 Variations in PGI activity of seeds during germination process
2.2.2 苹果酸脱氢酶(MDH)活性变化
MDH 是三羧酸循环(TCA)中催化苹果酸脱氢生成草酰乙酸和NADH 的关键酶,它可以反映TCA 循环活化状态,继而反映种子内部呼吸作用特征。20℃下,白皮松种子置床后,EMP 途径产生的丙酮酸在氧气充足条件下进入线粒体转入TCA 循环,6 天时胚与胚乳MDH 活性分别上升至12.20 U·g-1min-1和10.80 U·g-1min-1,约 是0 天酶活性的6 倍(图4)。但该温度下EMP 途径产生的丙酮酸较少,TCA 循环反应底物不足引起8 天时MDH 活性短暂下降。之后随着丙酮酸不断积累,14 天时胚与胚乳MDH 活性分别回升至18.98 U·g-1min-1和11.62 U·g-1min-1;25 ℃下,种子内MDH 活性变化趋势与20℃一致,但由于温度过高造成种子中溶氧量减少,EMP 途径产生的丙酮酸只有部分进入TCA 循环,种子继续维持以EMP 途径为主的呼吸代谢方式,所以其MDH活性始终低于20℃下酶活性,14 天时胚与胚乳MDH 活性分别为6.29 U·g-1min-1和8.87 U·g-1min-1。
2.2.3 G-6-PDH 和6-PGDH 联合酶活性变化
G-6-PDH 和6-PGDH 联合酶是戊糖磷酸(PPP)途径中葡萄糖在细胞质中氧化分解的限速酶,其活性大小反映PPP 途径的活化状态。20℃下,PPP 途径在白皮松种子置床后活化,G-6-PDH 和6-PGDH 联合酶活性呈升高趋势,6 天时胚中酶活性上升为68.93 U·g-1min-1(图5)。随着种子即将萌发,胚生长需要大量NADPH 为细胞合成反应提供还原力以及原料合成核苷酸和辅酶等物质,PPP途径随之增强,14 天时胚中酶活性快速升高至143.47 U·g-1min-1,是0 d 酶活性的4.76 倍。与此同时,胚乳中PPP 途径开始启动,14 天时酶活性提高至58.47 U·g-1min-1;25℃下,种子中G-6-PDH 和6-PGDH 联合酶活性始终处于初始水平,胚和胚乳中酶活性变化范围分别为22.07~33.00 U·g-1min-1和12.87~22.93 U·g-1min-1,可见该温度下种子主要通过PPP途径外的其他代谢途径进行呼吸作用。

图5 种子萌发过程G-6-PDH 和6-PGDH 联合酶活性变化Fig.5 Variations in G-6-PDH and 6-PGDH activities of seeds during germination process
2.3 种子萌发过程中内源激素含量变化
2.3.1 玉米素核苷(ZR)含量变化
ZR 在白皮松种子胚与胚乳中初始含量较为接近,分别为2.63 ng/g 和2.97 ng/g(图6)。20℃下,种子中ZR 含量随萌发的进行不断升高,胚中ZR 含量在8 天时上升到4.23 ng/g。之后由于胚的生长和细胞不断分裂,ZR 含量继续升高,12 天时ZR 含量达峰值5.24 ng/g,显著高于0~8 d 的ZR含量(P<0.05)。胚乳中ZR 含量6 天时上升至4.39 ng/g,显著高于0 d 含量,14 天时ZR 含量达最大值5.36 ng/g;25℃下,种子中ZR 含量较0 d时略有上升,胚中ZR 含量在2~14 d 的变化范围3.28~4.19 ng/g,各时间ZR 含量差异不显著(P>0.05)。2~14 d 胚乳ZR 含量波动范围3.73~4.86 ng/g,除第8 天外,其余各时间ZR 含量无明显差异。

图6 种子萌发过程ZR 含量变化Fig.6 Variations in ZR content of seeds during germination process
2.3.2 生长素(IAA)含量变化
白皮松种子胚乳中IAA 含量均远高于胚中含量,是胚IAA 含量的3~4 倍(图7)。20℃下,种子中IAA 含量随时间延长逐渐升高。刚置床时胚中IAA含量为9.64 ng/g,8 d时升高至12.15 ng/g。随着萌发的推进,14 天时IAA 含量升高至17.66 ng/g。胚乳中IAA 的变化趋势与胚中相同,0~6 d 胚乳中IAA 含量缓慢上升为41.07 ng/g,之后IAA 含量继续升高,14 天时上升为47.99 ng/g;25℃下,种子中IAA 含量始终低于20℃下IAA 含量。胚中IAA 含量除8 天时有所升高之外,其余时间IAA 含量相差不大,波动范围9.63~11.80 ng/g。胚乳中IAA 含量在整个培养过程中无显著变化(P>0.05)。

图7 种子萌发过程IAA 含量变化Fig.7 Variations in IAA content of seeds during germination process
2.3.3 赤霉素(GA3)含量变化
GA3在白皮松种子胚和胚乳中含量分布相差不大(图8)。20℃下,胚中GA3含量在0~8 d呈波动上升趋势,且在6 天含量最高为4.22 ng/g。10~14 d GA3含量稳步升高,14 天时达4.94 ng/g,显著高于6 天时GA3含量(P<0.05);25℃下,在培养过程中胚中GA3含量略有所升高,最大值3.77 ng/g 在6 天时取得,仅比0 天提高了0.76 ng/g,且该温度下胚中GA3含量始终低于20℃下胚中GA3含量。两温度下胚乳中GA3含量相差不大,均未有明显升高趋势,变化范围为3.74~4.54 ng/g。
2.3.4 脱落酸(ABA)含量变化
白皮松种子胚乳中ABA 含量始终高于胚中含量,这表明ABA 在干燥种子中积累的主要位点是胚乳。在同一温度下,胚与胚乳中ABA 含量变化趋势基本一致(图9)。20℃下,胚中ABA 含量在2 天后(47.21 ng/g)开始降低,8 天时显著降低至39.94 ng/g(P<0.05)。此后ABA 含量下降趋于缓慢,最小值32.14 ng/g 在12 天时取得。胚乳中ABA 含量整体上也呈下降趋势,波动范围60.90~74.64 ng/g;25℃下,种子中ABA 含量随时间延长而升高。0~4 d,胚中ABA 含量缓慢上升,6 d 后ABA 含量显著升高,14 天时含量上升至66.17 ng/g,是0 天时ABA 含量的1.57 倍。胚乳中ABA 含量也表现为升高趋势,变化范围65.76~80.70 ng/g。

图8 种子萌发过程GA3 含量变化Fig.8 Variations in GA3 content of seeds during germination process

图9 种子萌发过程ABA 含量变化Fig.9 Variations in ABA content of seeds during germination process
2.3.5 ZR/ABA、IAA/ABA 和GA3/ABA 比值变化
20℃下,白皮松种子中ZR、IAA 和GA3与ABA 的比值均随萌发时间的延长而升高(图10)。胚中ZR/ABA、GA3/ABA 在12 d 时达峰值,IAA/ABA 在14 天时达最大值,分别显著高于0~8 d的ZR、GA3、IAA 与ABA 的比值(P<0.05)。胚乳中的ZR、IAA、GA3与ABA 的比值变化规律与胚中类似,整体上呈现上升趋势;25℃下,胚中IAA/ABA、GA3/ABA 表现为下降趋势,ZR/ABA 无明显规律性变化。胚乳中IAA、GA3、ZR与ABA 的比值变化不明显。
2.4 发芽率与各生理指标之间的相关性分析
对白皮松种子萌发过程中的发芽率与各生理指标进行相关性分析,结果表明不同温度下种子的呼吸代谢关键酶活性以及激素含量在培养过程中均发生了相应的改变,且以胚中代谢活动较为强烈(表1~4)。20℃下,发芽率与胚中MDH、G-6-PDH 和6-PGDH 联合酶活性之间表现为极显著正相关关系(P<0.01),且与后者的相关性更大(R2=0.860**)。表明这两种酶在种子萌发呼吸途径中具有重要作用,且以G-6-PDH 和6-PGDH 联合酶所反映的PPP 途径所占据的比例更大。另外,该温度下种子中IAA、ZR 和GA3含量与发芽率之间呈现出极显著的正相关关系(P<0.01),而ABA 含量与则发芽率之间极显著负相关(R2=-0.679**)。可见IAA、ZR 和GA3在白皮松种子萌发中发挥着正向调节,而ABA 的作用则相反。25℃下,种子14 d 内的发芽率不足1%,种子呼吸作用活动微弱,发芽率与胚中PGI、MDH 和G-6-PDH 和6-PGDH联合酶活性相关关系不明显(P>0.05)。
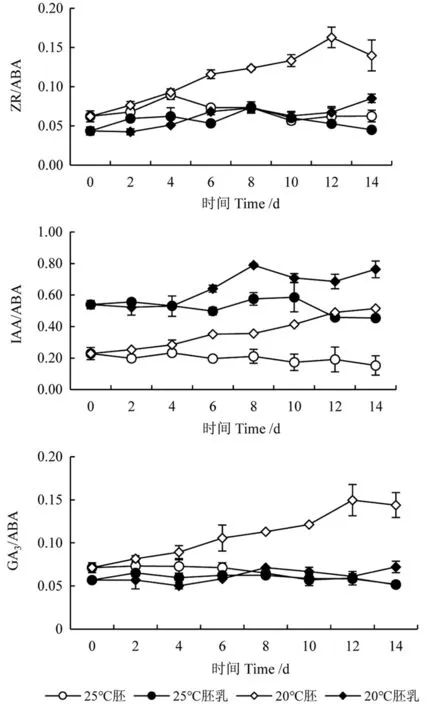
图10 种子萌发过程ZR/ABA、IAA/ABA 和GA3/ABA比值变化Fig.10 Variations in ZR/ABA、IAA/ABA and GA3/ABA of seeds during germination process

表1 20℃下发芽率与胚生理指标相关性分析†Table 1 Correlation analysis between germination and physiological indexes in embryos at 20℃
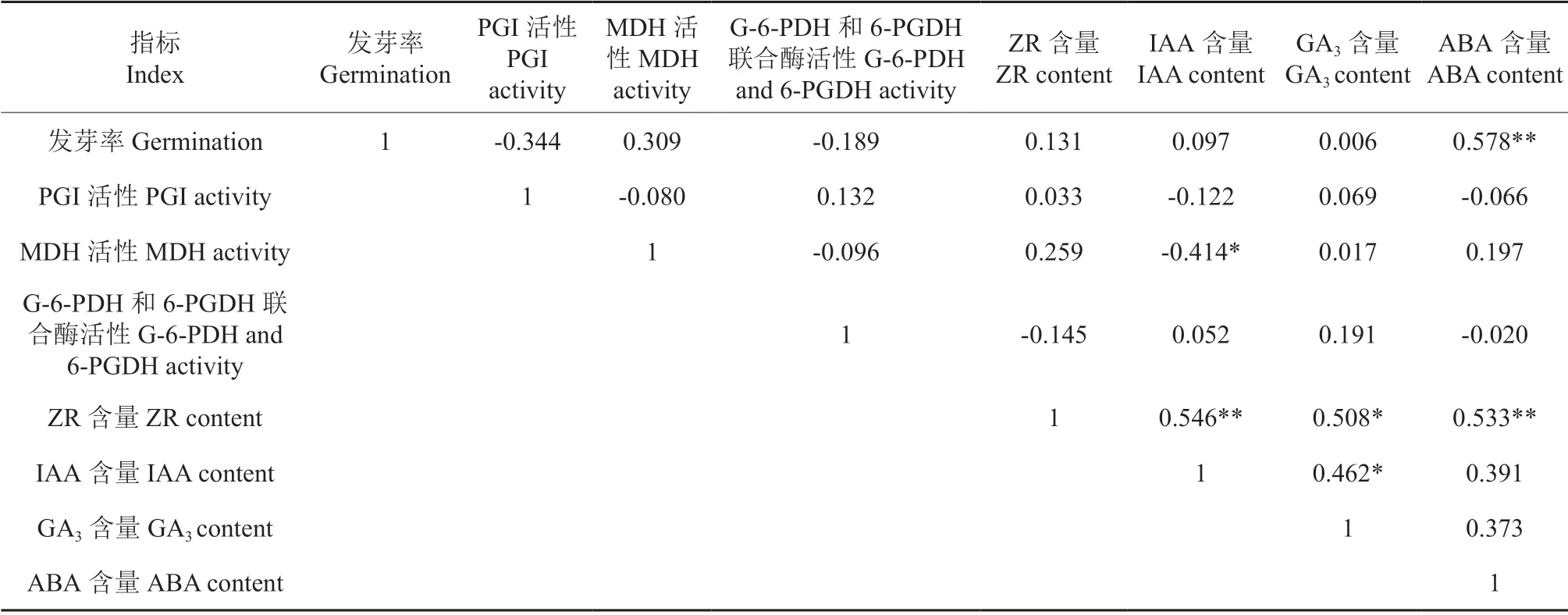
表3 25℃下发芽率与胚生理指标相关性分析†Table 3 Correlation analysis between germination and physiological indexes in embryos at 25℃

表4 25℃下发芽率与胚乳生理指标相关性分析†Table 4 Correlation analysis between germination and physiological indexes in endosperm at 25℃
3 讨论与结论
3.1 种子萌发的适宜温度
大多数亚热带和温带种子萌发对20~30℃之间的温度变化敏感。如20~25℃为樟子松Pinus sylvestrisvar.mongolica和沙地云杉Picea Mongolica[22]种子萌发的最适温度。凤尾杉Wollemia nobilis)[23]和银杏Ginkgo biloba[24]种子在25~30℃温度范围内萌发最快。相对中等的温度25℃适合很多植物种子萌发,如油松Pinus tabuliformis[25]、黄枝油杉Keteleeria davidianavar.calcarea[26]和江南油杉Keteleeria fortuneivar.cyclolepis[27]等。而白皮松种子则在更低的温度范围(15~20℃)内萌发效果较好,并且对高温敏感。在供试温度中,白皮松种子15 和20℃下发芽率均较高,分别为87.33%和92.67%,且20℃下种子发芽速度更快。当温度升高到25 和30℃时,种子萌发被抑制,发芽率急剧降低至5%以下。类似的发芽习性在其他针叶树种中也有发现,如阿勒颇松Pinus halepensis和土耳其松Pinus brutia种子的最佳发芽温度范围为15~20℃,更高的温度则抑制发芽[28]。草本植物菠菜Spinacia oleracea[29]和豆科植物鸟爪豆Ornithopus pinnatus[30]种子萌发对温度也极为敏感,被高温所抑制。此外,在后续研究中发现,当白皮松种子从高温条件转移到较低温度中时有生活力(>80%)的种子无需任何处理即可快速萌发。当萌发环境恢复到低温时,高温对Myrsine parvifolia种子萌发的抑制作用同样也是可逆的[31]。高温下种子萌发被抑制的这种温度效应称为热抑制或高温抑制,特征是当温度略高于最佳条件时发芽率急剧降低,但区别于白蜡属植物种子的二次休眠[32-33]。
3.2 不同萌发温度下种子的呼吸代谢途径
呼吸代谢的启动是种子吸胀后的早期事件,它促进了相关代谢途径的恢复和贮藏物质的动员,进而推动种子萌发。吸胀种子中有3 条比较活跃的代谢途径,分别为糖酵解途径(EMP)、三羧酸循环(TCA)以及戊糖磷酸途径(PPP),不同的代谢途径为种子萌发提供不同的原料、能荷和还原力。
EMP 在有氧和无氧条件下均可发生,糖类在细胞质中经此途径分解代谢是呼吸作用产生能量的第一步。白皮松种子置床后,EMP 途径首先被激活。25℃下,种子中PGI 活力水平较高,EMP维持高活化状态。TCA 循环需要在有氧条件下才能将EMP 途径产物丙酮酸进一步氧化磷酸化[34],而25℃下种子中溶解氧浓度下降,细胞内O2含量不足,仅部分丙酮酸进入TCA 循环,MDH 活性有所升高。在不利于萌发的高温条件下,白皮松种子呼吸代谢缓慢,线粒体中ATP 的产生受到低氧条件限制,EMP 途径占优势,TCA 循环虽然启动但比例不大,产生的少许能量用于维持种子“静止”状态。浦心春等指出休眠结缕草Zoysia japonica种子不能萌发是因为TCA 循环强度在萌发后期下降,种子中无足够ATP 合成,细胞代谢反应所需能量更多来源于无氧呼吸(EMP途径)[35]。水稻Oryza sativa种子在缺氧或CO2浓度较高的环境中萌发时,幼胚生长同样会被抑制[36]。此外,白皮松种子EMP 途径产生的丙酮酸可能在高温低氧环境中部分进入了发酵途径,并伴随酒精等有害物质产生,种子腐烂率升高。
PPP 途径是种子萌发中的另一个需氧过程,可将糖类不经过EMP 途径而直接氧化,为细胞生物分子构建和核酸合成提供原料并产生大量NADPH[34]。20℃下,白皮松种子中碳水化合物经过EMP 途径初始降解后,在细胞内氧气充足条件下,呼吸途径进入大量产能的TCA 循环,MDH活性不断升高。之后随着营养物质的不断消耗以及PPP 途径的出现,二者共同的反应底物丙糖磷酸(丙酮酸的前体物质)产量不足以继续维持TCA 循环的高活力运转,MDH 活有所降低。与此同时,线粒体变得活跃,胚中G-6-PDH 和6-PGDH联合酶活性大幅提高,贮藏物质降解转化为胚根突破种皮的能量,为细胞分裂提供所需的还原力和生物合成原料物质,高效产能的PPP 途径逐渐占据主导地位。可见,PPP 途径的启动在白皮松种子萌发中发挥重要作用。水稻种子萌发时胚根和胚芽的正常生长也与PPP 途径增强相关[36]。随着G-6-PDH 活性增强和PPP 途径在糖代谢中比例越来越大,西洋参Panax quinquefolius[37]和圆齿野鸦椿Euscaphis konishii[38]种子从休眠转向萌发。
种子萌发受呼吸代谢途径的调控,而细胞内呼吸代谢类型与速率又因外界环境条件的变化而发生改变。不同温度下白皮松种子萌发时的呼吸代谢规律可以大致归纳为:20℃下,种子呼吸途径以高效产能的PPP 途径为主,同时EMP-TCA循环占据一定比例,且胚中呼吸代谢较为活跃;25℃下,氧在热抑制温度下溶解度降低,未萌发的种子在低氧条件下主要通过EMP 进行呼吸代谢,TCA 循环虽然启动但比例不大。
3.3 温度对种子萌发过程中内源激素含量的影响
种子萌发过程受激素信号传递途径的调节,植物激素为种子提供了将外界复杂信息传递给胚所需的强度和灵活性,其整合内源信号和环境线索后,通过各激素之间相互作用来确定不同环境中种子萌发的发展状态。
ABA 在种子休眠和萌发中起着重要作用,ABA 营养缺陷型通常表现出增强的萌发潜力并伴随胎萌种子产生,而过量累积ABA 的突变体和转基因株系则显示休眠加深[39]。干燥白皮松种子中储存的ABA 结合物在吸胀后水解,充当游离ABA 的潜在来源,初期含量增加。ABA 分解需要充足的氧气,适宜温度20℃下,种子中溶氧量较高,胚中ABA 分解代谢强烈含量降低。25℃下,ABA 分解活动在低氧环境中受到抑制,且当种子感知到温度太高不利于萌发时,胚中ABA 通过某种途径进行了新的生物合成,积累并维持在高水平以抑制胚根生长,迫使种子处于“静止”状态。可见,白皮松种子具有响应高温调节ABA 含量的特定机制,并使用特定的ABA 信号转导途径进行萌发抑制。拟南芥Arabidopsis thalianaABA 缺陷和ABA 不敏感突变体(aba1和abi3)种子在超高温度下可以萌发,同样也证实ABA 在高温下对种子萌发的抑制至关重要[40]。此外,白皮松种子在25℃下对ABA 反应可能更为敏感和强烈。研究表明,大麦胚胎萌发对ABA 抑制的敏感性在高温下增强[16],谷类种子在休眠强烈表达的温度(30℃)下也比在容易萌发的温度(10℃)下对ABA 更敏感[41]。
高温抑制往往不是由单独增强的ABA 生物合成引起的,保持ABA 含量低于抑制阈值可以达到耐热性,但种子萌发仍然需要GA3参与且在ABA介导的萌发抑制被克服后起作用[42-43]。由于ABA和GA3在生物合成中共享甲羟戊酸途径的早期部分[44],25℃下白皮松种子胚中ABA 合成代谢旺盛,抑制了中间体向GA3生物合成的转变使其不能发挥其作用,从而抑制种子萌发使胚根无法突破种皮。同样,拟南芥种子在高温下促进参与ABA 合成基因的表达,ABA 下调GA3生物合成途径中基因并抑制其表达[45]。而当白皮松种子在20℃下萌发时,ABA 合成被抑制,胚中GA3合成代谢活跃并以足够的水平存在从而促进萌发。所以,GA3在白皮松种子萌发中通过其对ABA 代谢的干扰来发挥作用并影响其对温度的反应。类似的,外源施用GA3则可以通过促进ABA 分解从而减轻莴苣Lactuca sativa种子热抑制并增加其萌发温度上限[46]。
IAA 通常不被认为是种子萌发的关键调节因子,其在种子休眠和萌发中的作用存在争议。如ABA 通过增强IAA 信号传导抑制了拟南芥种子萌发期间胚轴伸长[47]。但在萌发的豌豆Pisum sativum种子中,IAA 却可以通过调节乙二醛酶活性而加快细胞生长和发育速率[48]。20℃下,白皮松种子中IAA 含量在萌发过程中不断升高。一方面可能源于成熟种子胚乳中大量积累的IAA 缀合物,另一方面是IAA 在胚中从头进行了生物合成。而在抑制萌发的25℃下,则可能是由于IAA 从胚乳的转移和胚自身的合成作用受到了抑制,IAA无法正常发挥其对细胞壁建成和细胞伸长的促进作用。紫椴Tilia amurensis[49]和水曲柳Fraxinus mandshurica[33]种子在适温下萌发时种子中IAA 含量同样高于高温下IAA 含量。可见,IAA 在适温下种子萌发中起促进作用。ZR 是细胞分裂素中活性强且易测定的激素储存形式,是植物生长和发育生理过程的活跃参与者[50]。白皮松种子在干燥成熟过程中积累了一定量ZR,种子吸胀后被激活。20℃下种子中ZR 在胚根即将突破种皮时含量快速升高,促进了细胞分裂和胚根的起始生长,在种子萌发中发挥积极作用。
种子萌发过程受到外界环境信号的刺激后,引起内部激素含量和比例的改变,进而产生相应的生理响应来调控萌发进程。不同萌发温度下白皮松种子中激素含量变化显示:20℃下,种子中GA3、IAA 和ZR 含量随萌发进行而升高,ABA分解代谢旺盛含量下降,GA3/ABA、IAA/ABA 和ZR/ABA 呈上升趋势,向着种子萌发方向发展;25℃下,种子中GA3、IAA 和ZR 含量变化不大,ABA 分解活动受到抑制且在高温低氧诱导下重新进行了生物合成,积累并维持在较高水平,GA3、IAA、ZR 与ABA 比值逐渐降低,种子中抑制型激素含量占优势,萌发过程相关代谢活动受阻。
本文仅研究了不同温度下种子萌发过程中的呼吸代谢特点和内源激素含量变化,没有对营养物质的代谢启动情况进行探究。今后可从萌发过程中的代谢组学、蛋白组学及基因表达等方面进一步研究,深入考察种子萌发的热抑制机理。
