锂离子电池富锂锰正极材料的最新进展
2021-03-22张盼盼何亚鹏李宵波郭忠诚
张盼盼,黄 惠,3,何亚鹏,李宵波,郭忠诚,3
(1 昆明理工大学 冶金与能源工程学院,昆明 650093;2 云南省冶金电极材料工程技术研究中心,昆明 650106;3 昆明理工恒达科技股份有限公司,昆明 650106)
锂离子电池(Li-ion batteries, LIBs)因具有能量密度高、放电平稳和无记忆效应等优势,近年来取得了迅速发展,并广泛用于新能源汽车、电子产品及电动工具等领域。LiCoO2作为第一种用于商业LIBs正极材料,其工作电压高且易于制备[1],但高成本和毒性限制了其大规模应用;可替换的Li1.2Ni0.2Mn0.6O2,LiMn2O4,LiFePO4,LiNi1/3Co1/3Mn1/3O2和LiNi0.8Co0.15Mn0.05O2等正极材料研究虽取得一定的突破[2-5],都具有120~160 mAh·g-1的容量,但以上材料的能量密度通常不足200 Wh·kg-1,难以满足当下LIBs的市场需求。此外,科技部“十三五”规划提出单体电池能量密度需达到300 Wh·kg-1的技术指标,发展高比能量和高电压的正极材料以实现高能量密度LIBs成为今后的研究重点。

然而,由于LMCM自身结构的不稳定性和氧脱出等因素,导致该正极材料存在首次不可逆容量损失大、倍率性能差、能量衰减和电压衰减等问题,使其商业化应用面临巨大的挑战。为了提高LMCM的性能,研究者们进行了体掺杂、表面包覆和结构优化设计等改性研究,已取得了一些成绩,但基本局限于实验室条件下。目前,仅有江西江特锂电池材料有限公司等少数公司实现了产业化应用开发。鉴于此,本文主要围绕LMCM存在的问题及改性研究工作展开论述。
1 LMCM存在的问题
1.1 首次不可逆容量损失
LMCM首次不可逆容量损失大(约60~100 mAh·g-1),且库仑效率通常低于80%。首次充放电过程中会出现一个4.5 V的电压平台,在随后的充放电曲线中平台消失[12],如图1所示。因此,LMCM首次充电过程可划分为两个阶段:(1)当充电电压低于4.5 V时,如式(1)所示,Li+从LiMO2的锂层中脱出,而Li2MnO3在此电压范围内不具备电化学活性,仅起到稳定结构的作用;(2)当充电电压高于4.5 V时,如式(2)所示,对应的电压平台是Li2MnO3脱锂形成MnO2的过程;该过程的机理研究仍存在争议,目前普遍认可的是氧脱出理论,即Li+和O2-相伴从晶格中脱出,O2-被氧化为O2。Mantia等[13]通过微分电化学质谱法检测到LMCM在电压达到4.5 V时有O2产生,Yabuuchi等[14]通过同步辐射X光衍射证实了富锂锰材料Li1.2Mn0.54Ni0.13Co0.13O2充放电过程中存在氧和Li+同时消除现象,并且在充电末期约有7.5%的氧消除,间接证明了氧脱出理论的准确性。首次放电过程中,高于4.5 V的电压平台阶段是不可逆的,导致脱出的Li+不能全部嵌入到正极材料的晶格中,最终造成大的首次不可逆容量和较低的首次库仑效率[15]。
xLi2MnO3·(1-x)LiMO2→xLi2MnO3·(1-x)MO2+ (1-x)Li++ (1-x)e-
(1)
xLi2MnO3·(1-x)MO2→xMnO2·
(1-x)MO2+ 2xLi++O2-
(2)

图1 xLi2MnO3·(1-x)LiMO2的首次充放电曲线
1.2 能量衰减和倍率性能差
LMCM循环过程中能量快速衰减,主要来源于晶体结构由层状向尖晶石相不可逆的相变过程[16],引起电压衰减和滞后现象。Boulineau等[17]采用扫描透射电子显微镜中高角度环形暗场成像和透射电子显微镜中电子衍射等研究首次充放电期间发生的化学演变,结果表明,形成的位于颗粒边缘的尖晶石相在第一次放电后依然存在;同时,反应过程中正极表面物质与电解质反应形成厚的固体/电解质界面(SEI膜),不利于Li+扩散,造成容量衰减[18]。此外,副反应产生的HF会腐蚀正极材料,使得过渡金属(TM)离子发生溶解,导致能量衰减[19]。
不理想的倍率性能也是由多方面原因造成的。首先,Li2MnO3中Mn4+的绝缘性质,使其具有低的电子电导率和Li+扩散系数[20]。Yu等[21]利用X射线吸收光谱(XAS)技术揭示的脱锂动力学特征表明,与Ni和Co的更快的反应动力学相比,Mn相关过程(主要是Li2MnO3组分)的脱锂动力学更差。此外,循环过程中迁移至Li层的TM离子会堵塞Li+扩散通道,致使Li+传输受阻[22]。正极材料与电解质反应形成SEI膜,造成界面阻抗增大[18],这都是导致LMCM倍率性能差的原因。
1.3 电压衰减
电压衰减是LMCM面临的另一个重要问题,可导致能量密度减少,充电状态难以测定,该现象在循环初期比较明显,并且测试温度和充电电压的升高都会使电压衰减更加严重。LMCM中脱出的氧和电解液发生副反应生成SEI膜,引起电极极化并增大电池阻抗,导致电压衰减[23];也有研究者认为正极材料在循环过程中结构的转变会造成电压衰减,目前的研究主要存在两种观点:
(1)正极材料结构由表面至内部的改变。在长期循环过程中,过渡金属层中TM离子迁移到锂层中锂位,正极材料表面由层状结构逐渐转变为类尖晶石结构[24-26],然后逐渐向内部生长[27]。
(2)部分研究者认为表面结构变化不是导致电压衰减的主要因素,而是材料自身结构的变化[28]。Mohanty等[29]利用密度泛函理论(density functional theory,DFT)和中子粉末衍射技术研究电压衰减机理,认为电压衰减是由于TM离子从过渡金属层的八面体位通过四面体位到达空的锂层八面体位,从而形成锂哑铃状结构,两个Li+进入四面体位,改变了材料的本体结构,如图2所示,导致材料的结构发生层状到尖晶石相的不可逆转变。

图2 LMCM电压衰减机理[29]
此外,文献[30]报道了TM阳离子价态降低理论,他们认为循环过程中正极材料的氧释放伴随的还原过程导致TM阳离子平均价态持续降低,除了包括Ni2+/Ni3+,Ni3+/Ni4+和O2-/O-的初始氧化还原对外,这种还原还激活了较低电压的Mn3+/Mn4+和Co2+/Co3+氧化还原对,最终导致电压衰减。

2 LMCM改性研究
2.1 掺杂改性
2.1.1 阳离子掺杂
目前,LMCM已报道M位掺杂元素有Al,Mg,Cr,Ru,Ti等。Li等[31]利用Cr掺杂提高了富锂锰正极材料Li1.2[Mn0.54Ni0.13Co0.13]1-xCrxO2(x=0,0.003,0.005和0.007)的倍率性能,并减缓了电压衰减,当x=0.005时正极材料显示出最大的倍率性能(10 C@119.3 mAh·g-1)和最小电压降(0.6167 V@200次循环@1.0 C);此外,4.5 V下的电压平台明显缩短,表明Cr掺杂抑制了晶格氧的逸出。稀土元素具有良好的热稳定性、高温下对氧化和还原的高耐受性,以及强抵抗水分或化学反应侵蚀性,特别适合用于改善LMCM。有文献报道[32],Y掺杂有效降低了氧空位和锂空位的占有率,首次放电容量明显提高,不可逆容量损失也大大降低。此外,Y3+还可以增加电子传导性,促进Li嵌入-脱嵌期间的电荷转移[33]。
M位掺杂可增强材料的热稳定性和结构稳定性,一定程度上改善初始库仑效率和循环稳定性,而选用Na+,K+替代Li位,能够稳定层状结构,抑制相变,扩大Li层层间距,加速晶格中Li+扩散,提高材料的倍率性能。He等[34]报道了Na+掺杂的Li1.17Na0.03Mn0.54Ni0.13Co0.13O2材料,首次可逆容量为307 mAh·g-1,100次循环后容量仍保持89%,8 C倍率下放电比容量高达139 mAh·g-1。综上分析,阳离子掺杂可有效改善LMCM的电化学性能。然而,不同氧化态的金属共同存于TM层,导致阳离子掺杂位点难以控制[35]。
2.1.2 阴离子掺杂
目前报道的阴离子掺杂主要有F-和S-,它们代替氧位后能够有效抑制氧损失。一定量F元素掺杂的LMCM,能够有效缓解尖晶石相的产生,稳定层状结构,改善材料的循环性能。Zheng等[36]采用溶胶-凝胶法制备了Li[Li0.2Mn0.54Ni0.13Co0.13]O1.95F0.05材料,F成功取代氧并形成更强的Li—F键,增加晶体的结晶度和表面阻抗稳定性,抑制氧析出和结构转变,还能避免与电解液发生副反应,提升材料的循环性能;0.2 C倍率下循环50次后,相比未掺杂的材料容量保持率提高15.7%。然而,随着Li—F强键的氟含量增加,可能导致放电容量降低[37]。经S掺杂的LMCM,Li+嵌入/脱出所需的能量相差无几,表明S掺杂后的LMCM材料Li+可以自由可逆地往返穿梭,从而使其保持较高的库仑效率。An等[38]采用S2-取代部分O2-制备富锂材料Li1.2Mn0.6Ni0.2O1.97S0.03,该材料具有高达96.06%的首次库仑效率,0.1 C倍率下显示出293.3 mAh·g-1的比容量和979.5 mWh·g-1的能量密度, 67次循环后保持213.4 mAh·g-1的比容量和667.9 mWh·g-1能量密度。他们进一步通过理论计算得出未掺杂的富锂锰材料脱出/嵌入的Li+所需能量相差259.21 eV,而S掺杂材料仅相差9.36 eV,Li+嵌入/脱出所需的能量明显降低,这进一步解释了该材料具有高库仑效率的原因。
2.1.3 聚阴离子掺杂


图3 DFT模拟LMCM正极的结构[41]
2.1.4 阴阳离子共掺杂
以上研究表明,体掺杂可以改变晶格参数,进一步影响Li+的扩散系数,改善LMCM的倍率性能,还可以维持层状结构的完整性,减轻由于相变引起的容量衰减和电压衰减。然而,由于不同的研究组使用不同的掺杂方法,客体掺杂离子和主体离子之间的相互作用及改性机理相当复杂。另外,某些新离子的引入可能以降低容量为代价,如何在保持LMCM优势的同时,选取掺杂离子种类及掺杂量成为今后研究的重点。
2.2 包覆改性
2.2.1 碳材料包覆
导电碳材料具有较强的离子和电子电导,强的还原性能还能够将材料表面部分Mn4+还原至Mn3+,形成三维(3D)大通道尖晶石相,有助于Li+传输,提升材料的倍率性能,同时避免电解质与正极材料发生副反应。Song等[43]采用氧化石墨烯(GO)包裹Li1.20Mn0.54Ni0.13Co0.13O2材料,退火过程中材料表面原始层状结构会转变为尖晶石相,为Li+扩散提供了3D通道;同时,GO降低了电荷转移阻力,使该材料在2500 mA·g-1高电流密度下具有120 mAh·g-1的放电比容量。近期文献报道[44],采用非金属离子掺杂的碳与被涂覆的正极材料之间会产生强的电子耦合,极大地增强了正极材料的结构稳定性和电子传导性,相比未处理和单纯碳包覆材料,具有更高的可逆容量、出色的倍率性能和优异的循环性能。
2.2.2 导电聚合物包覆
导电聚合物具有较高的电导率、良好的电化学可逆性和独特的酸掺杂/脱掺杂机制,能够很好地与LMCM结合,获得具有优良性能的聚合物复合电极材料。Zhang等[45]采用聚酰亚胺(PI)纳米涂层包覆Li1.2Mn0.54Ni0.13Co0.13O2,其界面结构和包覆机理如图4插图所示,PI涂层包覆可有效避免正极材料与电解液发生副反应,稳定高电压(≥4.5 V)下的固液界面。电化学性能分析表明,450 ℃时得到的改性材料在0.5 C倍率下循环50次后容量保留率为90.6%,性能均高于未包覆的层状材料,结果如图4所示。Wang等[46]采用聚苯胺包覆球形LMCM,0.5 C下循环200次后容量保持率仍为92.4%,0.1 C和10 C下放电容量高达302.9 mAh·g-1和146.2 mAh·g-1,表明聚苯胺涂层可以显著提高库仑效率和循环稳定性。因此,聚合物涂层改性LMCM将是一种有前景的技术途径。

图4 LMCM材料的循环性能(插图为PI涂层工艺示意图和PI-LMNCO-450界面结构)[45]
2.2.3 氧化物包覆
氧化物结构稳定,是一种典型的包覆材料,能够阻止活性材料与电解液发生副反应,抑制氧流失,还可以与HF反应,减少电解液中HF的含量,缓解过渡金属的溶解,从而提高正极材料层状结构稳定性。目前已报道LMCM包覆改性的金属氧化物有Al2O3,ZnO,MnO2等。Zheng等[47]采用纳米级掺杂钆的氧化铈(GDC)改性层状氧化物Li1.2Mn0.54Ni0.13Co0.13O2,GDC涂层可以保护Li1.2Mn0.54Ni0.13Co0.13O2免受电解液的腐蚀,为电子和Li+传输提供足够的活性位点;同时,GDC中的氧空位可以有效抑制首次充电过程中的氧损失,改善初始库仑效率。3%(质量分数,下同)GDC涂层的正极材料具有较高的初始库仑效率,优异的倍率性能(0.1 C@267.5 mAh·g-1, 0.5 C@252.4 mAh·g-1, 1 C@223 mAh·g-1, 5 C@158 mAh·g-1)和循环性能(1 C@100次循环@91.4%)。另外,均匀掺入颗粒表面的GDC层可有效保持结构稳定性并减轻循环过程中的电压衰减,而原始样品容量的快速衰减和差的倍率性能归因于有机电解质与电极反应形成的非活性表面层(包含Li2CO3);同时,如图5和式(3)及式(4)所示,LiPF6基电解液中含有的少量水在持续循环过程中会分解电解质生成HF和LiF,而HF会继续与正极材料反应,产生更多的LiF,导致Li+的消耗和高界面电池阻抗。
LiPF6+H2O→LiF↓+LixPOF+2HF
(3)
Li1.2Mn0.54Ni0.13Co0.13O2+2xHF→2xLiF↓+
Li1.2-2xMn0.54Ni0.13Co0.13O2+H2O
(4)
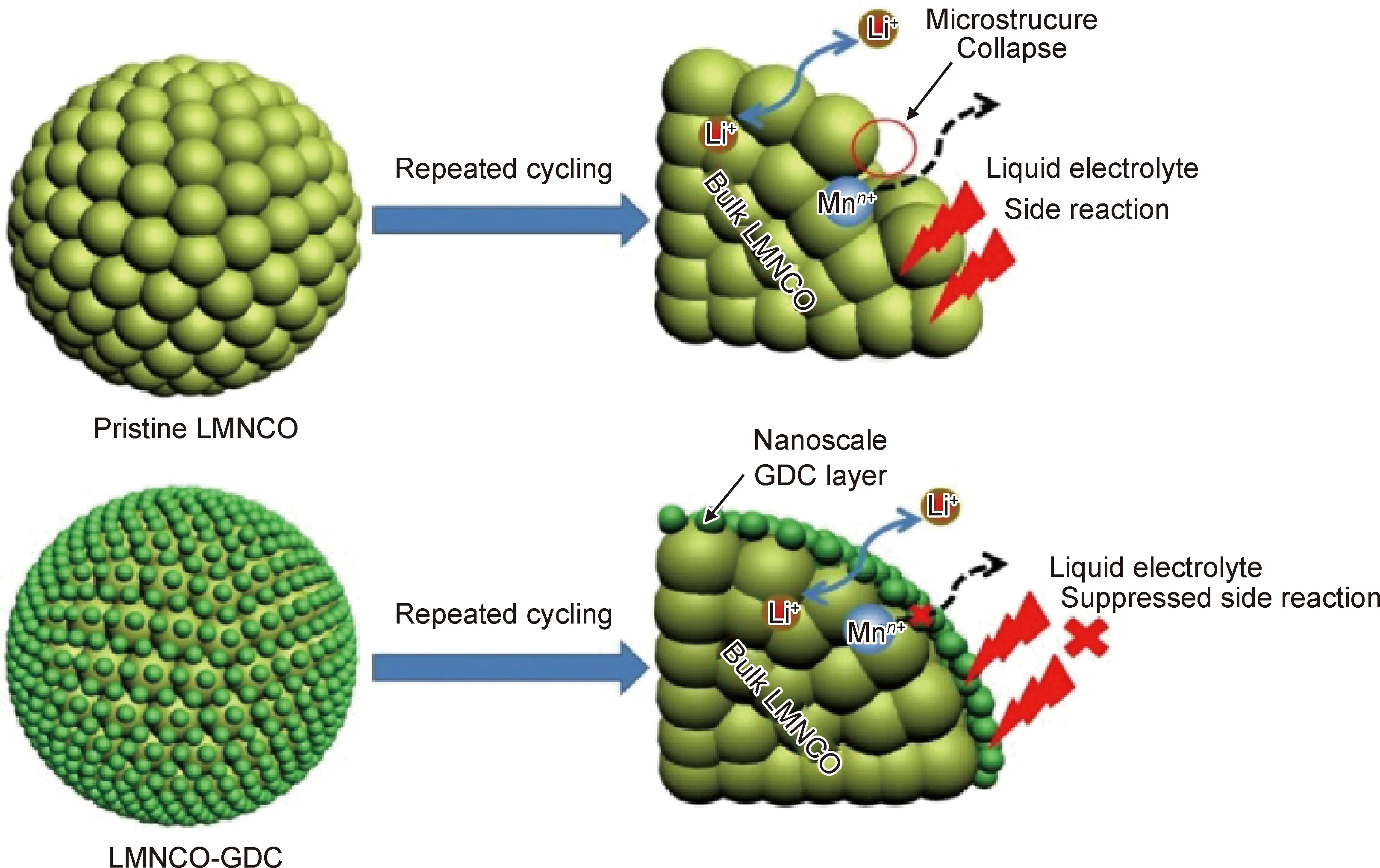
图5 原始LMNCO和LMNCO-GDC与液体电解质的界面副反应的示意图[47]
2.2.4 氟化物包覆
金属氧化物包覆层在循环过程中会被HF腐蚀转变为金属氟化物[48],继续对正极材料起到保护作用。因此,可以采用氟化物(AlF3,MgF2,CeF3等)直接进行包覆改性。一方面,LIB常用的电解液为LiPF6,F-可以有效地抑制界面副反应的发生[49];另一方面,F-的加入可以降低电荷转移电阻,提高导电性,进而改善正极材料的倍率性能和循环性能[50]。Zhang等[51]研究了ZrF4包覆对Li[Li0.2Ni0.17Co0.07Mn0.56]O2正极材料性能的影响。结果表明,1% ZrF4修饰电极在0.1 C下100次循环后表现出193 mAh·g-1的可逆容量和89%的容量保持率,这归因于ZrF4涂层有效抑制SEI膜的快速生长,降低循环过程中电荷转移阻力,有利于Li+扩散;另外,ZrF4还可以抑制氧损失,保持正极材料结构的稳定。针对单一包覆改性对材料性能提升有限的问题,研究者还在La掺杂基础上进行CaF2包覆改性,目标材料的性能均优于未改性和单一改性材料[52]。
2.2.5 磷酸盐包覆
但金属磷酸盐表面包覆热处理过程中,存在LMCM中Li+向包覆层扩散现象,造成一定量的锂损失,而含锂的磷酸盐(Li-Mn-PO4,Li3PO4)能够避免Li+扩散。有文献报道[55],LiFePO4改性的LMCM结合了体掺杂和表面涂层的优点,既稳定了晶体结构也保护正极材料免受有机电解质的腐蚀,还促进了材料表面离子扩散和电荷转移。
2.2.6 锂离子导体类材料
锂离子导体类材料(Li2SiO3,LiV3O8等)不仅具有快速的离子扩散路径和高的电子电导率,还可保护电极免受F-的侵蚀,避免电极界面发生不必要的副反应,稳定层状结构,进而优化正极材料的倍率性能、循环性能和热稳定性。Zhang等[56]报道了Li2ZrO3包覆改性Li1.2Mn0.6Ni0.2O2(LMNO)的新型syn-Li2ZrO3@LMNO材料,其合成过程如图6(a)所示,图6(b)为syn-Li2ZrO3@LMNO的低放大倍率HRTEM图,球形材料边缘为Li2ZrO3均匀涂层,厚度约5 nm。该材料集成了Li2ZrO3涂层和Zr4+掺杂的优点,具有比先掺杂后涂覆的Li2ZrO3@LMNO材料更高的倍率性能和循环稳定性,电压衰减也得到了一定的缓解。这是由于Li2ZrO3涂层减轻了表面副反应,抑制TM离子溶解;Zr4+掺杂扩展了晶面间距,减少了Li/Ni混排,有利于Li+扩散;同时,Li2ZrO3涂层和Zr4+掺杂的协同效应进一步增强了层状结构稳定性,并减轻了锂化/脱锂循环期间的电压衰减。

图6 Li2ZrO3表面改性的富锂阴极[56]
表面包覆涂层可以抑制活性材料与电解质之间的副反应,对材料的循环性能和热稳定性也有一定的改善,已被证明是控制LMCM容量损失的有效方法。但表面涂层对于稳定晶体结构和缓解电压衰减是无效的,并且大多数的包覆材料是差的离子或电子导体,这将在一定程度上降低材料的倍率性能,理想的表面改性材料应是高Li+和电子导电材料。此外,表面包覆层通常是薄膜,不能提供持续的保护以防止连续的酸性物质侵蚀,导致在持续循环期间出现缓慢的容量损失。因此,选择耐腐蚀、高Li+和电子导电材料,并严格控制材料的包覆量和涂层均匀性对LMCM性能改善具有重要意义。
2.3 结构形貌优化设计
2.3.1 微纳多孔结构
纳米结构LMCM缩短了电子和Li+从晶体的内部迁移到粒子表面的传输扩散路径,较大的比表面积可实现较高的倍率性能和初始放电比容量。Dai等[57]制备出一种薄的纳米板状Li[Li0.2Mn0.54Co0.13Ni0.13]O2富锂锰材料(厚约13 nm),初始容量和库仑效率分别为308 mAh·g-1和85%,而常规的仅为245 mAh·g-1和77%,其性能的提升源于扩大的晶体单元,促进了八面体和四面体位置Li+脱锂/锂化。但纳米材料通常具有低的热力学稳定性和堆积密度,并且电极与电解液之间存在大量的副反应[58]。微纳结构设计是改善LMCM电化学性能的有效方式,它利用纳米结构单元提供良好的结构稳定性,为降低副反应提供更大的可能性。微纳多孔结构LMCM的中空腔中的许多额外活性位点有利于Li+储存,增加了正极材料的比容量,还有助于改善Li+的扩散动力学,更有利于Li+扩散;最重要的是,多孔结构可以减轻充电/放电时的局部体积变化,使其具有突出的结构稳定性[59]。Qiu等[60]合成的三维纳米多孔富锂锰正极材料具有如图7(a)所示的结构,该材料是由100~200 nm的纳米小颗粒组成的二次颗粒,具有超过2.20 g·cm-3的高振实密度,不仅提高了材料的初始放电比容量和循环性能,还具有出色的倍率性能(1250 mA·g-1@197.6 mAh·g-1),如图7(b)所示。优异的电化学性能归因于独特的纳米多孔微纳结构促进了Li+扩散并增强了层状材料的结构稳定性。该研究使得高体积能量密度和功率密度的3D纳米多孔LMCM的制备成为可能。
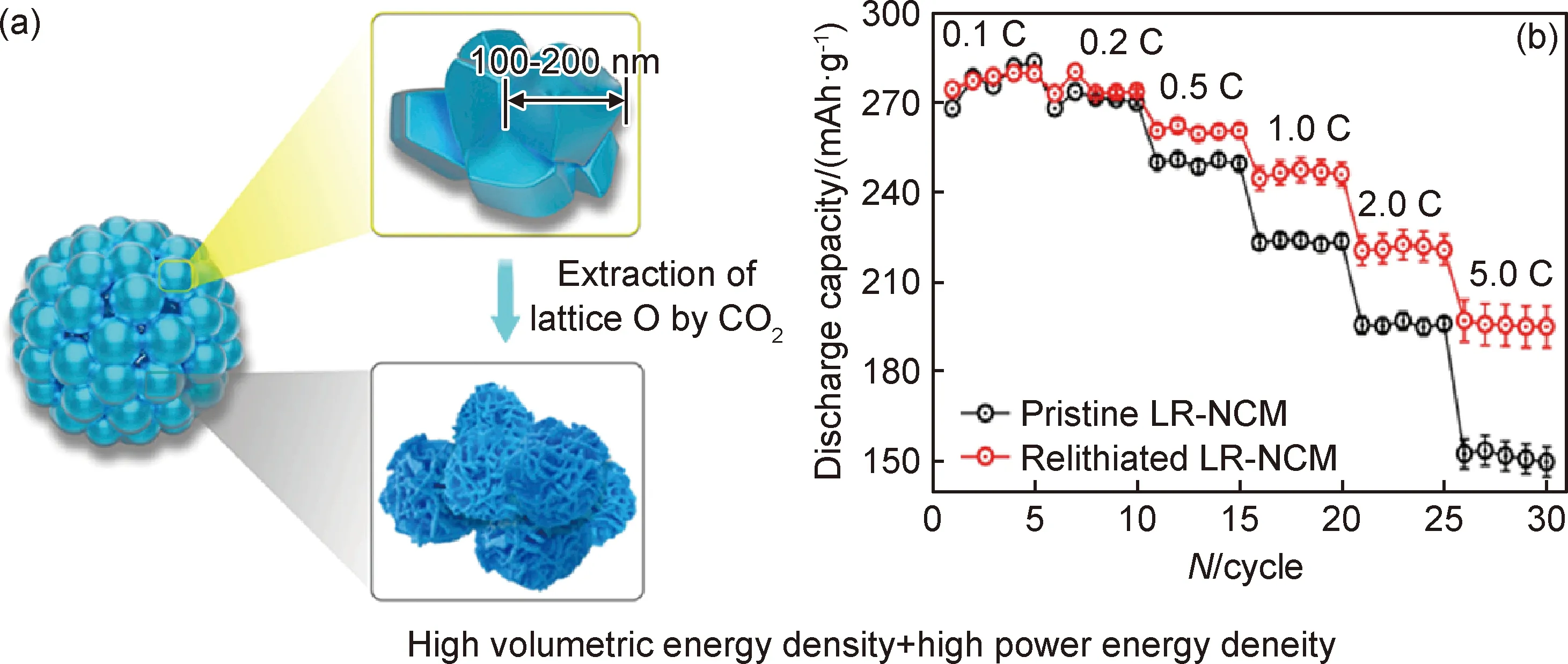
图7 3D纳米多孔结构示意图(a)和原始和重新定相的LR-NCM电极的倍率能力(b)[60]

图8 核-壳结构正极的DFT模拟[62]
2.3.2 核-壳结构
目前报道的核-壳结构材料[61]由富镍的内核和富锰的外壳构成,显示出高的放电容量和循环性能,比常规共沉淀法制备的正极材料具有更高的热稳定性。Longo等[62]在简单界面模型中使用DFT研究核-壳蛋黄结构xLi2MnO3·(1-x)LiNiCoMnO2纳米复合材料(图8(a))的结构稳定性和电压特性。结果表明,在适当的电压操作窗口内,Li2MnO3可以保持壳区电化学惰性,没有Li+脱出,从而避免相变,图8(b)为核-壳复合材料的电压分布,阴影区域为核-壳界面Li+脱出区域;他们还研究了Li+从核-壳界面处的Td位置迁移回到Li2MnO3壳的Li-Mn层中的Oh位置的过程,如图8(c)所示,图中显示了初始、中间和最终的结构变化过程。此外,循环过程中没有氧释放或进一步氧化的热力学驱动力,使得在脱锂期间电荷补偿到TM离子,尤其是Ni2+离子。这突出了确定核-壳结构材料工作电压窗口的重要性,以防止Li2MnO3壳结构的解离,并保持纳米复合材料整体结构稳定性。
2.3.3 层状-尖晶石异质结构
近年来,层状-尖晶石异质结构LMCM成为研究热点,尖晶石相3D结构可以增强Li+嵌入/脱嵌过程并稳定结构,有效地提高了倍率性能;同时,尖晶石相3D通道有利于离子和电子的传输,层状和尖晶石两相界面形成对齐的Li+扩散通道,允许快速Li+扩散,并且层状结构增强了高Li+存储容量,显著改善了材料的电化学性性能。研究表明[63],尖晶石相具有抑制材料结构坍塌与电压衰减的作用。Yu等[64]报道了一种分层尖晶石纳米管组装的3D富Li层结构,独特的3D空心分层结构大大缩短了电子和离子转移途径,保持了可靠的结构稳定性;同时,层状尖晶石对齐的Li+扩散通道,使Li+扩散系数达1.55×10-10cm2·s-1,有利于库仑效率提高。在0.1 C时放电比容量约293 mAh·g-1,1 C下200次循环后容量保持率为89.5%,即使在5 C的倍率下仍具有202 mAh·g-1的高容量。目前,关于层状尖晶石富锂复合材料的化学成分、晶体参数和锂离子扩散动力学的信息不多。因此,可控制地合成由多功能组分组成的层状富锂材料,并研究它们的结构、组成与性质的关系具有重要意义。
LMCM存在的种种问题都是由材料晶体结构的不稳定性导致的,表面包覆和体掺杂属于后期对材料性能的改善,而结构优化设计则是在材料的合成过程中优化材料的结构以获得性能的改善。以上3种改性手段均可在一定程度上改善材料的性能,但各自性能改善侧重点不尽相同,如掺杂可改善材料的倍率性能和缓解电压衰减,包覆有利于提高材料的比容量和循环性能,这就使得有效的集成改性成为今后研究发展的一个新方向。
3 LMCM产业化进展
当前,加速富锂锰基产业化进程的背景,一方面,随着政策补贴逐年滑坡,加之中长期电池能量密度目标要求,电池企业降本提质压力剧增,迫使企业加快探索及改进新材料的研究进程。如江西江特锂电池材料有限公司在2010年4月以共沉淀法+高温固相法合成的技术路线实现了富锂锰产业化应用,属国际首创,并于同年将产品应用于电动自行车、电动商务车和高尔夫球场场地车电池等领域,目前该公司富锂锰基产能是2000吨,可根据市场需求在极短时间内提高至4000吨。宁波富锂电池材料科技公司于2017年建成年产百吨级的中试生产线,并拟融资建设全球首条年产千吨级富锂锰正极材料生产线,力争2020年达到万吨级生产规模。
近期,在工信部发布的第8批推荐目录中,两款搭载遨优动力富锂锰基电池的车型成功入围,遨优动力还获得了开瑞新能源1万套以上富锂锰基电池的订单意向。江苏陆地方舟新能源车辆股份、新日(无锡)发展有限公司也开始应用或意向性地应用富锂锰基电池。除了遨优动力外,当升科技、国轩高科、中航锂电、上盾新能源、江特电机等电池/材料企业都有布局及储备富锂锰基技术路线。但由于材料自身结构缺陷、工艺复杂的改性技术很难完全推广至实际生产中,并且富锂锰配套材料发展缓慢,大规模应用还有很多需要研究和解决的问题,如倍率性能、循环过程中容量和电压的急剧衰减、高电压电解液的配套开发等问题需要解决。
4 结束语
LMCM存在问题的根本原因有待进一步解决,尤其是充放电过程中结构演化规律及其对电化学性能的影响。现有的改性技术可在一定程度上改善正极材料的性能,但单纯的体掺杂、表面包覆等对LMCM的改善具有很大的局限性;同时,对LMCM的改性机制还有待进一步深入研究。因此,对于今后的理论研究,应致力于:(1)使用先进的分析表征手段,并借鉴传统三元材料的研究经验,深入研究LMCM循环过程中结构演化规律及对电化学性能的影响,更好指导材料的合成及改性;(2)进一步剖析改性技术规律,借助前沿的表征手段以及界面分析技术,深入研究掺杂、包覆、微观形貌以及晶体结构影响富锂材料性能的改性机理,为集成改性奠定理论基础,开发出具有高性能LIBS正极材料的改性工艺技术;(3)探讨材料结构与电化学性能之间影响规律,揭示Li2MnO3组分的作用机理;(4)开发与LMCM相匹配的高容量负极(如硅碳复合负极材料)和高电压电解液。而对于产业化应用,应寻求易操作、低成本的制备及改性技术,并将基础研究与产业化发展有机结合。
