不同干燥方式对苜蓿种子代谢物的影响
2021-03-22张迪任立飞刘广彬罗伏青张文浩王天佐
张迪 ,任立飞 ,刘广彬 ,罗伏青 ,张文浩 ,王天佐 *
(1. 中国科学院植物研究所,北京100093;2. 中国科学院大学生命科学学院,北京100049;3. 青岛科技大学机电工程学院,山东青岛266061;4. 袁隆平农业高科技股份有限公司,湖南长沙410001)
随着我国居民生活水平的提高,肉蛋奶等动物性食品消费不断增加,畜牧业迎来了快速发展。然而,我国现有的饲草产量远远不能满足需求,大力发展优质牧草人工草地是推动草牧业发展的当务之急,亟需优质牧草种子作为基础[1]。苜蓿属(Medicagosp.)牧草营养丰富、产量较高,在世界范围内广泛种植,被称为“牧草之王”[2]。一般而言,田间收获的苜蓿种子湿度较大,含水量约在20%~40%[3]。根据国家牧草种子标准,苜蓿属牧草种子入库前含水量不应超过13%[4],否则将影响种子活力。因此,苜蓿种子收获后的干燥处理十分关键。目前,我国苜蓿种子干燥主要采用自然晾晒的方式,效率低,容易受天气影响。近年来发展起来的机械设备干燥支持连续烘干,干燥效率高,受天气影响小,可以极大程度地降低种子新陈代谢速度,从而能较长时间地保持种子品质和活力,同时在烘干过程中还能促使种子后熟[5-6]。然而,设备干燥也存在烘干温度控制复杂,容易影响种子发芽率的缺点[7-9]。
随着现代分析技术及生物信息学的发展,组学技术已经成为分析生物学问题的有效手段[10]。代谢组学通过利用先进的分析检测仪器,结合模式特征识别等分析方法对代谢产物进行定性和定量分析,来监测代谢物随时间变化的规律[11]。代谢物反映了植物系统末端的生化活动,揭示了已经发生的生物学事件。相对其他组学技术而言,代谢组学更能反映植物体的生理和生化状态。因此,代谢组学被广泛应用于植物生物学及其相关领域的研究中[12]。许庆方等[13]利用代谢组学分析测定了苜蓿青贮过程中的有机酸,证实了高效液相色谱法测定的实用性与快捷性。Zhang 等[14]利用高效液相色谱串联质谱对苜蓿中的阿特拉津进行了分析,表明其可以通过不同的途径降解。范文强等[15]利用类似方法分析了不同生育时期苜蓿叶片中代谢物的变化,发现了27 个差异代谢物,得出中花期收获的苜蓿更宜青贮,而现蕾期收获的苜蓿更宜调制干草的结论。然而,运用该方法分析苜蓿种子干燥过程中代谢物变化的相关研究还未见报道。本研究采用非靶向代谢组学方法,利用高效液相色谱串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS)技术,研究了不同干燥方式处理下苜蓿种子中代谢物的变化,以揭示高温造成种子发芽率降低的原因,以期为优质苜蓿种子生产提供科学的理论依据。
1 材料与方法
1.1 试验材料及干燥方式
本研究使用的苜蓿材料为中国科学院植物研究所培育的中科1 号黄花苜蓿(Medicago falcata)新品系。
本研究涉及数种苜蓿种子材料,分别为新鲜种子、自然干燥种子、不同温度干燥的种子。新鲜种子为新采集的苜蓿种子,含水量为25%;自然干燥采用传统的自然晾晒的方式进行露天干燥;不同温度干燥采用设备进行热风干燥,风速0.5 m·s-1,相对湿度20%;不同的干燥方式均将新鲜种子干燥至10%含水量。
1.2 种子萌发试验
将种子置于滤纸上测定萌发率。培养条件为20 ℃恒温,每天16 h 光照,光照强度150 μmol·m-2·s-1,胚根突破种皮与种子直径长相等时判定为萌发。每天记录发芽种子数,培养12 d 后,结束发芽试验。试验设置4 个重复,每个重复50 粒种子。种子萌发率=发芽种子数/种子总数×100%。
1.3 代谢组材料处理及代谢物提取
将新鲜种子、自然干燥种子、39 ℃干燥种子和65 ℃干燥种子4 组样品用液氮研磨,使用50%甲醇缓冲液在室温下提取10 min,将提取混合物在-20 ℃下储存过夜,以5000 r·min-1离心20 min 后,将上清液转移至新的96 孔板中。取等量制备好的试验样本混合物10 μL 来制成质控样品[16]。进行HPLC-MS 分析之前,将样品存储在-80 ℃。该试验于2019 年完成,设置6 个重复。
1.4 液相色谱-质谱分析
使用高效液相色谱系统的ACQUITY UPLC T3 色谱柱(100 mm×2.1 mm,1.8 μm,Waters,UK)进行反相分离。柱箱保持在35 ℃,流速为 0.4 mL·min-1,流动相由溶剂A(水,0.1%甲酸)和溶剂B(乙腈,0.1%甲酸)组成。梯度洗脱条件设定为:0~0.5 min,5%溶剂B;0.5~7 min,5%至100%溶剂B;7~8 min,100%溶剂B;8~8.1 min,100%至5%溶剂B;8.1~10 min,5%溶剂B;流动相剩余部分为溶剂A。每个样品的进样量为4 μL。样品经HPLC 分离后,利用高分辨率串联质谱仪(TripleTOF 5600 plus,美国AB Sciex 公司)检测从色谱柱洗脱的代谢物。
1.5 数据处理
利用 ProteoWizard 软件将原始数据转换成mzML 格式后,采用XCMS 程序进行峰对齐、保留时间校正和峰面积提取,利用开源软件metaX 对检测到的代谢物的一级质荷比进行KEGG(kyoto encyclope⁃dia of genes and genomes,京都基因与基因组百科全书)数据库匹配,得到一级鉴定结果;再利用代谢物二级质谱图谱库,与样品的代谢物二级质谱数据进行匹配,得到二级质谱代谢物鉴定结果。
使用检测到的代谢物含量和试验所用的样品重量计算样品中的各种代谢物浓度,进行聚类分析和主成分分析。取偏最小二乘回归分析法得到的变量权重值VIP>1,并结合T检验(P<0.05)来筛选差异表达代谢物。试验的比较组设置如表1 所示。

表1 比较组设置Table 1 Comparison groups
2 结果与分析
2.1 不同干燥方式对苜蓿种子萌发率的影响
不同干燥方式处理下苜蓿种子萌发率如图1 所示,与自然干燥相比,39 ℃干燥并没有影响种子萌发率,但随着干燥温度的升高苜蓿种子发芽率呈显著下降趋势,65 ℃干燥可使苜蓿种子萌发率下降到50%左右。
2.2 代谢物鉴定
一级质谱数据库里存在很多同分异构体,即一级鉴定结果存在多个相同质荷比对应多个代谢物的情况。因此,本分析利用代谢物二级质谱图谱库,与样品的代谢物二级质谱数据进行匹配,同时对所检测到的特征代谢物进行归类,统计结果如表2。结果表明,检测到最多的代谢物为脂类及类脂分子,其他依次为有机酸及其衍生物、苯丙酸和聚酮、有机杂环化合物、有机氧化合物、苯环型化合物、核苷、核苷酸及类似物、有机氮化合物、生物碱及其衍生物和磺胺嘧啶,另有59 种代谢物未能分类。
2.3 代谢物定量
使用不同处理下代谢物浓度差异进行样品间相似性聚类,结果发现39 ℃干燥和自然干燥造成的变化最相近,其次是新鲜种子,65 ℃干燥造成的代谢变化与其他3 组差异最大(图2a)。通过对代谢物的主成分分析可知,本试验的4 组材料的6 个重复分布相对集中,说明本试验重复性好,试验数据准确,此外主成分分析也得出了类似的结果,即39 ℃干燥和自然干燥相似性最高,与65 ℃干燥差异最大(图2b)。
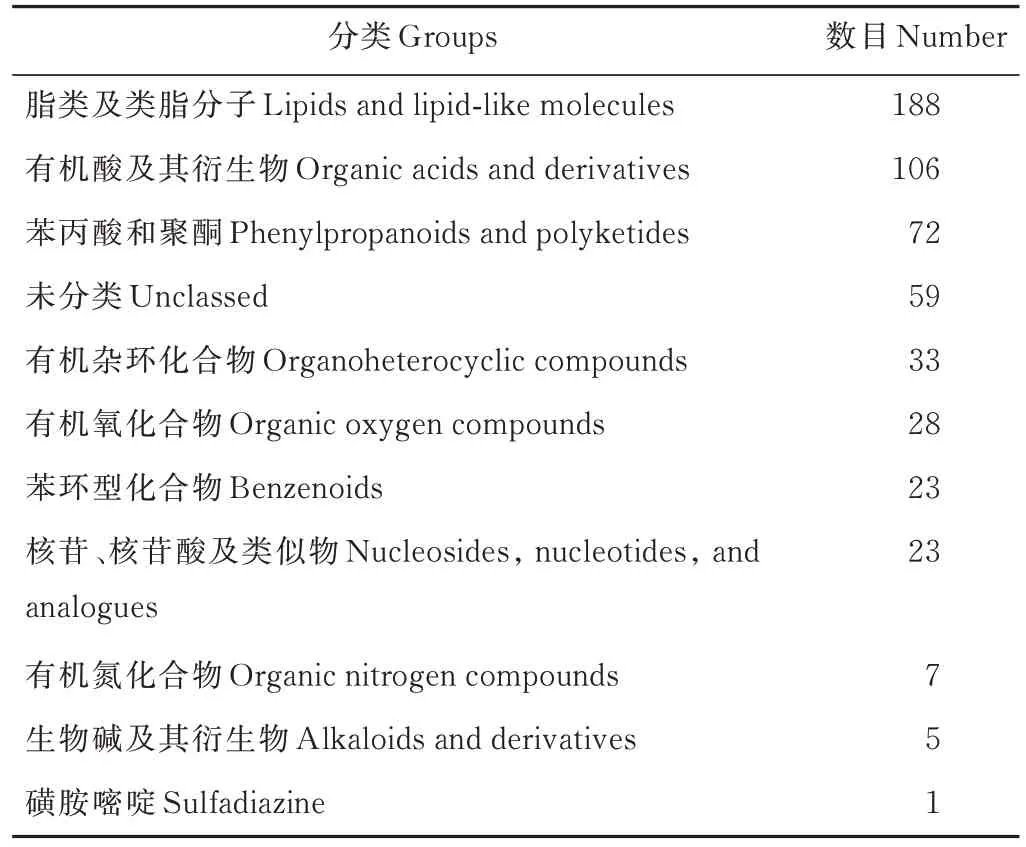
表2 识别到的代谢物分类Table 2 Classification of identified metabolites

图2 4 组苜蓿种子代谢物差异强度(a)及主成分分析(b)Fig.2 Heatmap of differential metabolites(a)and principal component analysis(b)
2.4 差异代谢物识别
该试验采用单变量分析差异倍数和T检验进行BH 校正得到q 值,结合多变量统计分析偏最小二乘回归分析法得到的VIP 值,来筛选差异表达的代谢物。差异代谢物需同时满足ratio≥2 或者 ratio≤1/2;q≤0.05;VIP≥1。最终鉴定到的差异代谢物数目如图3所示,65 ℃干燥相对新鲜种子差异代谢物最多,为30种。此外,65 ℃干燥处理相对自然干燥和39 ℃干燥分别产生了22 和21 种差异代谢物。其他比较组识别的差异代谢物较少。
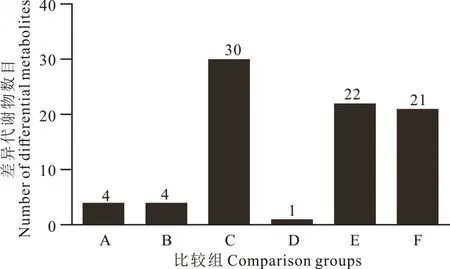
图3 差异代谢物数目Fig.3 Number of differential metabolites
进一步分析各比较组中差异代谢物的种类,并进行特异和共有差异代谢物的分析(表3)。在自然晾晒过程中(A 比较组),种子代谢物中的有机杂环物质、脂类和类脂分子、苯基丙烷和聚酮化合物发生了变化。39 ℃干燥使种子代谢物产生的变化与自然干燥较为类似,除上述物质发生变化外,又产生了有机酸及衍生物的变化。然而,65 ℃干燥产生的差异代谢物较多,除上述种类的差异代谢物均被识别外,还发现了核苷、核苷酸及类似物的差异。从另一方面,相对自然干燥,39 ℃干燥仅产生了有机酸及衍生物的变化。而65 ℃干燥产生了有机杂环物质、有机氧化物质、有机酸及衍生物、脂类和类脂分子以及核苷、核苷酸及类似物的变化。
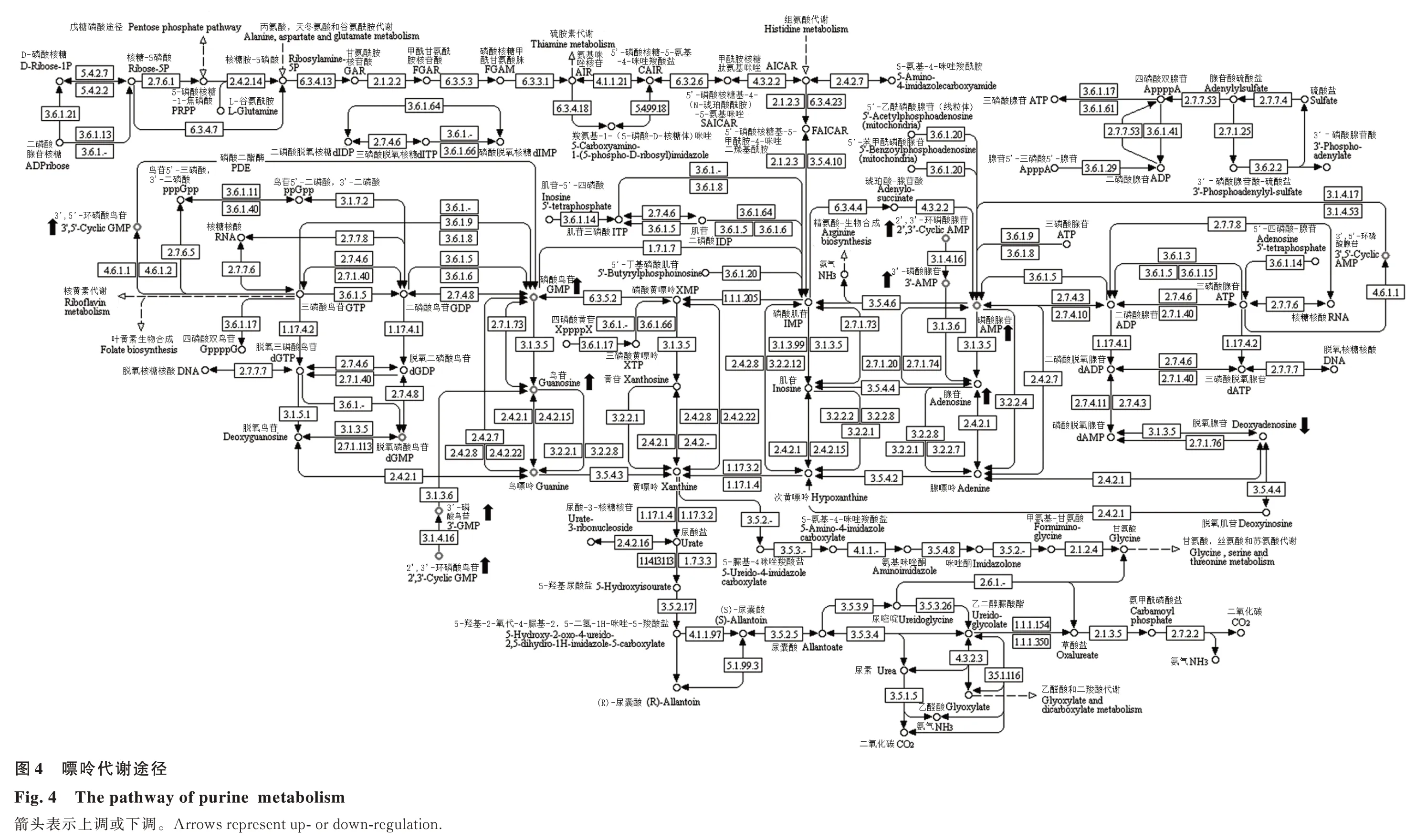
KEGG 通路富集分析是探究所研究的生物学过程中相关代谢通路的有效方法。分析发现,65 ℃干燥相对自然干燥对种子嘌呤代谢途径影响最大,造成了10 个代谢物的含量变化,分别为腺苷、磷酸腺苷、3′-磷酸腺苷、2′,3′-环磷酸腺苷、脱氧腺苷、鸟苷、磷酸鸟苷、3′-磷酸鸟苷、2′,3′-环磷酸鸟苷、3′,5′-环磷酸鸟苷,其中除脱氧腺苷含量下降外,其他9 种代谢物含量均上调(图4)。
3 讨论
3.1 不同干燥温度对种子发芽率的影响
合理的干燥温度对种子烘干的质量影响极大[17]。张银[18]指出,在种子干燥过程中粮堆温度大于34 ℃时,种子发芽率下降,并且干燥时间越长,发芽率越低。郭艳丽[19]在研究棉花(Gossypiumspp.)种子的烘干过程中发现,当种子温度高于60 ℃后,温度越高发芽率下降越多,烂种率也越高。王立超等[20]研究发现,青冈栎(Cyclobala⁃nopsis glauca)种子在不同烘干温度处理下发芽率差异显著,随着烘干温度从30 ℃增加至150 ℃,青冈栎种子发芽率从69.2% 降低到7.5%。使用过高的温度干燥可使种子蛋白质变性,造成种子的内在伤害,种子活力下降[21-22]。本试验研究结果与上述研究类似,当苜蓿种子的烘干温度超过39 ℃时,种子发芽率明显下降,而65 ℃烘干种子的发芽率只有50%左右。由此可见,高温对于种子活力存在较大的负面影响,确定合理的烘干温度对种子生产十分必要。

表3 不同比较组共有和特异的差异代谢物Table 3 The common and specific differential metabolites among comparison groups
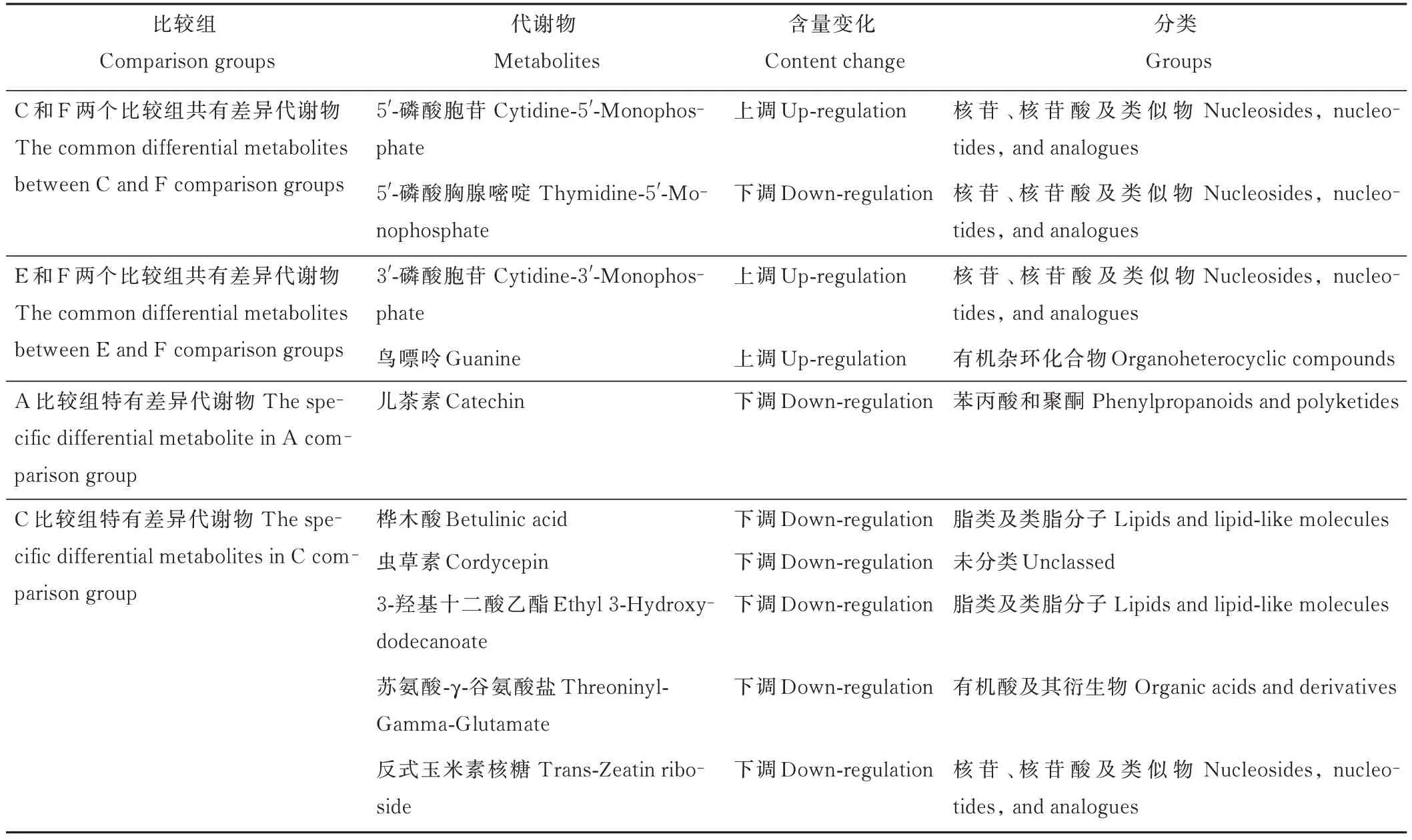
续表3 Continued Table 3
3.2 差异代谢物的功能和变化的原因
正常情况下,植物体内的各项代谢及生理生化过程处于稳态,而当植物遭遇逆境胁迫时,植物体内会发生一系列代谢活动的变化[23]。对于牧草种子生产而言,过高的温度会对种子发芽率造成负面影响[24-25],其原因可能为高温影响了种子的新陈代谢[19]。
核苷酸是DNA 和RNA 合成的原料,核苷酸代谢在生命活动中发挥着重要作用[26]。Mittler 等[27]研究发现高温胁迫下拟南芥(Arabidopsis thaliana)细胞中的核酸会发生不同程度降解。朱传应等[28]研究高温胁迫对荒漠植物花花柴(Karelinia caspica)大分子结构的影响,发现45 ℃处理花花柴8 h 后RNA 开始降解,12 h 时花花柴DNA明显降解。以上结果说明,高温会造成植物细胞中核酸的降解。本研究发现核苷、核苷酸及类似物是高温干燥造成的种子差异代谢物中最大的一类,KEGG 通路分析也显示65 ℃高温干燥对种子嘌呤代谢途径影响最大。本研究推测高温使苜蓿种子核酸降解,引起了核苷酸代谢的变化,进而影响了苜蓿种子活力。
高温胁迫会打破植物体内自由基的产生与消除的平衡,导致膜脂过氧化作用,进而引起膜脂的解体,对细胞造成伤害[29]。本试验发现,相对新鲜种子,高温干燥会使苜蓿种子的脂类及类脂分子发生变化,由此推测高温干燥会对苜蓿种子细胞膜造成伤害进而影响种子活力。
脯氨酸是植物体内的一种保护物质,通常逆境胁迫下,植物体内可通过脯氨酸的积累来抵抗外部的刺激[30]。 郑婷[31]对植物药薤白(Allium macrostemon)进行研究发现,相对于新鲜样本,3 种干燥方式(晒干、冻干、阴干)干燥的材料中脯氨酸含量均有不同程度的增加。周中亮等[32]研究也发现,高温胁迫处理下高羊茅(Festucaarundinacea)的游离脯氨酸含量明显升高。以上结果表明,高温胁迫下植物可以通过脯氨酸的积累响应逆境胁迫。本试验研究结果与此类似,在本研究的3 个比较组C、E、F 中,含有脯氨酸的二肽(异亮氨酸-脯氨酸、苯丙氨酸-脯氨酸、缬氨酸-脯氨酸)增加,推测这些产生变化的物质为苜蓿种子响应高温所产生的保护物质。
4 结论
本研究利用高效液相色谱串联高分辨率质谱仪,对不同干燥方式下的苜蓿种子进行了代谢组的检测,探究了不同干燥方式处理对种子发芽率造成影响的原因。结果表明,较低的温度干燥产生的苜蓿种子代谢物变化与自然干燥类似,过高的温度干燥造成苜蓿种子代谢物发生较大变化,主要为核苷、核苷酸及类似物,脂类及类脂分子等,这可能是高温造成种子萌发率降低的原因。本研究从代谢的角度解析了高温造成种子活力降低的原因,为苜蓿种子干燥设备的设计提供了理论基础。
