柠条CkCAD 基因的克隆转化及其抗旱功能分析
2021-03-22畅志鹏孙莹莹李佳阳龚春梅
畅志鹏 ,孙莹莹 ,李佳阳 ,龚春梅
(1. 西北农林科技大学生命科学学院,陕西杨凌712100;2. 西北农林科技大学园艺学院,陕西杨凌712100)
柠条(Caragana korshinskii)又称毛条、白柠条,是豆科锦鸡儿属植物[1],灌木,羽状复叶小而密集,叶脉亦呈羽状,广泛分布于我国内蒙古、宁夏、甘肃等干旱和半干旱地区,生长于半固定和固定沙地,是西北地区营造防风固沙林及水土保持林的优良物种[2]。优越的旱生性能使其成为研究植物抗逆生理机制的理想材料而被广泛研究,先前主要集中在干旱胁迫下柠条的形态适应性和生理生态机制的研究较多,近年来分子机制也有了一定研究。研究发现在中度和重度干旱胁迫下,柠条叶片气孔关闭,叶片水势显著降低,植物保水能力增强[3],同时叶片光合速率降低、叶绿素降解,叶片中脯氨酸、可溶性糖含量显著增加[4],从而提高了植物的干旱适应性。本实验室也发现柠条随自然降水减少呈现叶脉密度增加,维管束的面积、个数以及叶肉细胞中叶绿体数量明显增多的趋势[5];干旱胁迫下柠条CkCOV1表达降低,负调控维管发育以增强叶脉发达程度,从而有利水分输导[1]。干旱条件下,柠条CkDREB表达量升高,将其转入拟南芥(Arabidopsis thaliana)可显著提高拟南芥的抗旱性[6]。可见柠条的抗旱基因和抗旱途径多样,需要更多的试验和证据阐述和完善其抗旱机制。
苯丙烷生物合成途径是植物体内一条重要的次生代谢途径,其下游主要包括木质素合成、类黄酮合成和花青素合成途径,产生参与植物发育和防御的重要次生代谢产物[7]。木质素除了在植物对病原体的防御机制中起作用外,主要在植物次生壁中合成并沉积,为细胞壁提供刚性和抗压性,使植物能承受水分运输的负压[8],还可以与细胞壁蛋白连接,以增加细胞壁致密程度,使其难以渗透[9],此外木质素还能防止细胞分化过程中细胞壁和多糖的降解。在干旱胁迫下,甘蔗(Saccharum officinarum)木质素合成途径相关酶和基因表达量均提高,且木质素沉积更多[10]。柠条中苯丙烷代谢途径的第一个关键酶基因CkPAL在干旱胁迫下表达量升高[11],当PAL基因表达被沉默时,木质素含量下降[12]。黄酮类化合物包括黄酮、黄酮醇、异黄酮、花色苷、原花色素等,也可以保护植物免受各种生物和非生物胁迫,作为植物抗毒素、解毒剂和抗菌化合物的作用[7]。
综上所述,苯丙烷代谢途径在植物的环境适应和防御中发挥着重要作用。本研究以柠条苯丙烷代谢中木质素合成途径CkCAD基因为研究对象,通过克隆该基因、构建过表达载体并转化野生型拟南芥,在干旱胁迫下对转基因拟南芥进行相关表型分析,确定抗旱功能,为深入理解植物的抗旱生理和分子机制提供试验支持。
1 材料与方法
1.1 试验材料
本试验所用柠条样品为从西北农林科技大学试验田收获的种子后在室内种植所获。用于转化的野生型拟南芥(wild typeArabidopsis thaliana)为哥伦比亚生态型(Columbia 0,Col-0)。挑选健康饱满的柠条种子用清水冲洗干净,包裹于湿润纱布中,置黑暗条件下萌发3 d 左右,待种子萌发后再移栽入土和蛭石(2∶1)混匀的基质中。Col-0 野生型拟南芥种子用清水冲洗干净后,用75%酒精处理30 s,10%次氯酸钠消毒15 min,无菌蒸馏水冲洗5~10 次后,用 0.5% 琼脂将种子悬浮,均匀的点在 1/2 MS 固体培养基(2.2 g·L-1Murashige Skoog,10 g·L-1蔗糖,8 g·L-1琼脂)上,于 4 ℃冰箱春化 72 h 后,放置于光照培养箱(16 h 光照/8 h 黑暗,22 ℃/20 ℃,光强为 7000 XL)中生长,3 d 左右便可发芽,7 d 后将拟南芥幼苗移栽入土和蛭石(2∶1)混匀的基质中。
1.2 柠条总RNA 的提取及反转录
取30 d 龄的柠条叶片,置于液氮速冻并研磨,采用 Trizol 法提取柠条 RNA[13]、cDNA 反转录试剂盒(TaKaRa,中国北京)反转录成cDNA。
1.3 柠条CkCAD 基因的克隆及过表达载体的构建
根据转录组数据中柠条CkCAD基因的序列,用Premier Primer 5.0 设计一对引物(表1)。将反转录获得的cDNA 稀释5 倍后作为模板,进行PCR 反应以获得目的基因,PCR 反应体系包括:5×PrimeSTAR Buffer(Mg2+plus)10 μL,dNTP Mixture(2.5 mmol·L-1each)4 μL,上下游引物各 1 μL,cDNA 模板 1 μL,PrimeSTAR HS DNA Ploymerase 0.5 μL。反应程序为:98 ℃ 20 s,98 ℃ 10 s,58 ℃ 15 s,72 ℃ 65 s,72 ℃ 5 min,进行35 个循环,PCR 产物进行胶回收后与经过双酶切后的线性过表达载体pCAMBIA1302 直接连接上,转化大肠杆菌,涂布在含有卡那霉素的Luria-Bertani(LB)培养基(胰蛋白胨10 g·L-1,酵母提取物5 g·L-1,氯化钠0.1 g·L-1)上,置于37 ℃培养箱中生长14 h,菌落PCR 后,挑取阳性菌落送至公司测序。测序结果正确后,提取质粒冷冻保存备用。

表1 柠条CkCAD 转化和定量所用引物Table 1 Primers for C. korshinskii CkCAD conversion and quantification in this study
1.4 生物信息学分析
将测序正确的DNA 序列转为氨基酸序列,通过Geneious R 9.0.2 软件与大豆(Glycine max)、非洲相思豆(Abrus precatorius)、鹰嘴豆(Cicer arietinum)、花生(Arachis hypogaea)、紫花苜蓿(Medicago sativa)等物种的同源基因氨基酸序列进行比对,并构建系统发育进化树。通过ProtParam P(https://web.expasy.org/protparam/)分析CkCAD 的蛋白分子质量及酸碱性,并通过ProtScale(https://web.expasy.org/protscale/)分析其亲疏水性;利用TMHMM 网站(http://www. cbs. dtu. dk/services/TMHMM/)对其跨膜结构域进行分析;通过NCBI(https://www. ncbi. nlm. nih. gov/Structure/cdd/wrpsb. cgi)分析其蛋白保守结构域。在 Npsa-Prabi(https://npsa-prabi. ibcp. fr/)和 SWISS-MODEL(https://swissmodel. expasy. org/)对 CkCAD 蛋白的二、三级结构进行分析;通过PredictProtein(https://www.predictprotein.org/)网站预测该蛋白质的亚细胞定位。
1.5 拟南芥遗传转化及转基因植株的鉴定
将测序正确的载体转化进GV3101 农杆菌,置于28 ℃培养箱培养48 h,挑取菌落进行菌落PCR 验证后,将阳性菌落接种于 Luria-Bertani(LB)液体培养基中,28 ℃下180 r·min-1培养过夜至菌液 OD600为 0.8~1.0,以 6000 r·min-1在室温下离心收集菌液,采取蘸花法[14],将拟南芥置于含5%蔗糖,0.05%表面活性剂Silwet-L77 的诱导培养基中浸染50 s,重复两次,放于密闭纸盒过夜,第二天放回光照培养箱中正常生长。待拟南芥果荚成熟开裂后,收取成熟种子(T0代)于37 ℃烘箱进行48 h 休眠处理后,便可室温储存。取T0代种子,采取1.1 中拟南芥种子春化方法,在进行消毒处理后,将种子均匀点在含有50 μg·mL-1潮霉素的1/2 MS 固体培养基上,4 ℃低温纯化后,放置于正常光照条件下生长,阳性植株能够正常生长出嫩叶和较长的根系,假阳性植株表现出短根,叶片发黄并逐渐枯死。7 d 后,将阳性植株移栽入土和蛭石(2∶1)混匀的基质中,提取基因组作为模板,通过PCR 再次鉴定阳性植株。扩繁并筛选阳性转基因植株至T3代后用于后续试验。
1.6 转基因植株的荧光定量PCR(qRT-PCR)和Weatern blot 鉴定
利用Premier Primer 5.0 设计拟南芥AtCAD和柠条CkCAD特异性定量引物,并选取拟南芥β-actin 作为内参(表 1)。实时 PCR 反应使用 SYBR Green(TaKaRa,Shiga,Japan)PCR 测定法[15]的 Bio-Rad CFX96 实时检测系统(Bio-Rad,Hercules,CA,美国)进行。每个反应混合物(20 μL)均包含稀释的第一链 cDNA,引物,10 μL TransStart Tip Green qPCR SuperMix(TransGen Biotech,中国北京)和双蒸馏水。实时PCR 条件如下:95 ℃持续30 s,然后在95 ℃持续5 s,39 ℃持续30 s,进行39 个循环,然后进行熔解曲线,使用CT 值确定参考基因的表达水平,并使用2-ΔΔCt方法进行计算[16]。每个样品设置3 个生物学重复和3 个技术重复。
采用蛋白质粗提法[13]提取总蛋白,分别采集 0.1 g 野生型和 T3代过表达CkCAD拟南芥#1,#3 和#4 株系叶片样品于预冷的研钵中,加入1.5 mL 蛋白质提取液(Tris 6.8 100 mmol·L-1;SDS 2%;甘油10%;巯基乙醇0.5%;PMSF 0.1 mmol·L-1)和液氮进行充分研磨,置于冰上静置 15 min,12000 r·min-1,4 ℃离心 10 min,去除底部沉淀获得总蛋白溶液,使用BCA 蛋白质定量试剂盒(PA115,TIANGEN,中国北京)测定浓度,-20 ℃保存。将等量的蛋白质样品通过电泳仪(Bio-Rad,Hercules,CA,美国)进行 SDS-PAGE 凝胶电泳,再转移至 0.45 μm 的聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,用 5%(wt·vol-1)的脱脂奶粉封闭 2~4 h,与 GFP 特异性一抗(1∶5000 稀释)4 ℃孵育过夜,与相应二抗(1∶8000 稀释)室温孵育 2 h,使用 ECL 发光液(A 液∶B 液=1∶1 混合均匀),利用 GeneGnome XRQ 化学发光检测器(Syngene,Cambridge,英国)捕获图像,并用 GeneSys(Vilber Lourmat,Paris,法国)软件分析蛋白表达量。
1.7 野生型与过表达拟南芥的干旱处理
选择光照培养箱内生长状态良好且生长周期一致的野生型和T3代过表达拟南芥幼苗停止浇水20 d,同时观察野生型拟南芥和过表达株系的表型变化,为进一步观察拟南芥对干旱的响应,干旱处理20 d 后进行复水处理2 d 并观察植株恢复情况[17]。野生型和过表达CkCAD拟南芥株系#1、#3 和#4 均设置3 个生物学重复。
1.8 拟南芥叶脉的观察及木质素含量的测定
选取相同生长位置和发育阶段的野生型和T3代转基因拟南芥叶片,用75%乙醇在65 ℃水浴中处理至绿色脱尽(期间不断更换75%乙醇溶液),再用5%NaOH 溶液室温下去除叶肉组织,便可储存于75%乙醇溶液中以便观察[18]。使用体式显微镜(Olympus Corporation SZX2-ILLT,Tokyo,日本)在暗场下观察叶脉发育状况并拍摄照片,用Image J 2x 统计叶片的密度。叶脉观察时每个株系选择5 个样本进行重复性观察。
采用乙酰溴法[19]测定木质素含量,设置3 个生物学重复和3 次技术重复。准确称取0.1 g 植物叶片,105 ℃干燥2 h,并研磨至粉末于试管中,加入5 mL 30%乙酰溴的冰醋酸溶液和0.69 mol·L-1的高氯酸,70 ℃水浴60 min,将反应液移入装有5 mL 2 mol·L-1氢氧化钠和5 mL 冰醋酸溶液的容量瓶中终止反应,充分混匀,用冰醋酸稀释至50 mL,以冰醋酸为空白溶液,测定280 nm 处的紫外吸收值。
1.9 干旱胁迫下植物抗旱相关生理指标及植株生长速率的测定
丙二醛含量的测定:准确称取0.1 g 干旱处理后的野生型和过表达拟南芥叶片,剪碎并放于研钵中,加入0.5 mL 20%的三氯乙酸溶液研磨至匀浆,转移至5 mL 离心管中,4000 r·min-1离心10 min,吸取上清液加入0.5%硫代巴比妥酸(thiobarbituric acid,TBA)溶液,上下颠倒混匀后在水浴锅中煮沸,冷却至室温,4000 r·min-1离心10 min,吸取上清液作为试验组,使用 0.5% TBA 溶液作为对照组,分别测量 450、532、600 nm 下的吸光值[20]。
相对含水量的测定:分别采取一定量的野生型和转基因拟南芥叶片并立即记录叶片鲜重(fresh weight,FW),转移叶片至去离子水中在恒定光照下水化4 h,获得叶片的饱和鲜重(saturated fresh weight,SFW),将叶片在 80 ℃烘箱中干燥至恒重(dry weight,DW),相对含水量(relative water content,RWC)=[(FW-DW)/(SFW-DW)]×100%[21]。
相对电导率的测定:准确称取0.1 g 干旱处理后的野生型和过表达拟南芥叶片,将叶片在15 mL 去离子水中抽真空1 h,室温孵育3 h 后用电导仪测定初始电导率,将叶片在水浴锅中煮沸15 min,冷却后测定溶液的总电导率。相对电导率(%)=(初始电导率/总电导率)×100%[21]。
游离脯氨酸含量的测定:准确称取0.1 g 干旱处理后的野生型和过表达拟南芥叶片于15 mL 试管中并加入3 mL 磺基水杨酸溶液,在沸水浴中加热15 min,室温静置冷却,吸取2 mL 提取液至新的试管中,依次加入2 mL 冰醋酸和2 mL 酸性茚三酮,沸水浴中加热25 min,取出冷却至室温后,加入4 mL 甲苯并振荡混匀,吸取上清液在520 nm 处测定吸光度值,用甲苯溶液做空白对照[22]。
干旱过程中植株高度(株高)变化的测定:从野生型和T3代过表达拟南芥移栽至土中15 d 后进行干旱处理,每天用量尺测量并记录拟南芥幼苗的株高,待植株萎蔫导致茎干倒伏不再测定。每个株系选择3 株幼苗作为生物学重复进行测定。
干旱处理过程中叶面积变化速率的测定:在拟南芥干旱处理过程中,每天用相机对拟南芥右面进行俯拍,待干旱处理结束后,用Image J 软件对叶片面积进行统计并记录。
1.10 数据统计与分析
本研究所有试验均设置3 个生物学重复。使用Geneious R 9.0.2 软件进行氨基酸序列比对和系统发育进化树的构建;使用Image J 2x 软件统计叶脉密度;使用IBM SPSS Statistics 23.0 进行单因素ANOVA检验,使用GraphPad Prism 7.0 作图。
2 结果与分析
2.1 柠条CkCAD 基因的克隆及生信分析

图1 柠条CkCAD 序列扩增条带Fig.1 Amplified bands of C. korshinskii CkCAD sequence

图2 柠条CkCAD 与其他物种系统发育进化树及氨基酸序列比对结果Fig.2 Phylogenetic tree and amino acid sequence comparison of C. korshinskii CkCAD and other species
以柠条叶片cDNA 为模板,扩增得到大小为1000左右的DNA 片段(图1),切胶回收并送往生物公司测序,发现柠条CkCAD全长1074 bp,编码357 个氨基酸。进行氨基酸序列比对和构建系统发育进化树发现柠条CkCAD 与非洲相思豆、蒺藜苜蓿(Medicago truncata⁃la)、大豆和花生的亲缘关系较近(图2A),相似度均在80%以上,其中柠条CkCAD 与非洲相思豆ApCAD 最为相似(图2B)。ProtParam 在线工具分析显示CkCAD 蛋白分子质量为38.75 kDa,蛋白质偏酸性且为亲水性蛋白,富含甘氨酸(Gly,10.6%)、缬氨酸(Val,10.1%)、亮氨酸(Leu,9.5%)、赖氨酸(Lys,7.3%)、丝氨酸(Ser,7.0%);TMHMM 在线工具分析显示其不包含跨膜结构域;图3A 的CkCAD 蛋白保守结构域分析显示其属于PLN02514亚家族;Npsa-Prabi 网站分析显示CkCAD 蛋白的二级结构(图3B)和三级结构(图3C)主要是由43.1%的无规则卷曲和22.97%的α 螺旋组成,其中无规则卷曲主要集中在N 端,而α 螺旋主要集中在C 端。预测该蛋白质亚细胞定位在细胞质中(图3D)。

图3 柠条CkCAD 蛋白质结构及亚细胞定位预测Fig.3 CkCAD protein structure and subcellular localization prediction of C. korshinskii
2.2 植物表达载体的构建及转CkCAD 拟南芥植株的筛选
选择NcoI 和SpeI 作为双酶切位点,将已扩增的CkCAD目的序列与切开的pCAMBIA1302 载体进行连接,PCR 鉴定并测序正确后便获得过表达载体(图4)。农杆菌介导的过表达载体转化野生型拟南芥后,用50 μg·mL-1的潮霉素筛选获得T1代阳性过表达CkCAD植株(图5),并将过表达拟南芥阳性株系扩繁至T3代。
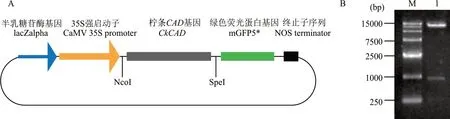
图4 pCAMBIA1302-35S::CkCAD 过表达载体的构建Fig.4 Construction of pCAMBIA1302-35S::CkCAD overexpression vector
2.3 T3代阳性植株qRT-PCR 测定及Western blot 验证
选取了生长阶段一致且发育健壮的野生型和T3代过表达拟南芥,对野生型和过表达株系中的AtCAD、CkCAD进行qRT-PCR 定量分析,发现转基因拟南芥#1、#3 和#4 中柠条CkCAD表达量较高,而野生型拟南芥和过表达株系中拟南芥AtCAD表达量相对稳定,没有显著变化(图6A)。通过对野生型和过表达株系拟南芥叶片提取总蛋白,进行Western blot 后分析发现,在过表达株系#1、#3 和#4 中柠条 CkCAD 蛋白能够稳定表达(图6B)。说明柠条CkCAD基因不仅稳定地整合进了拟南芥基因组中,而且能够稳定表达。

图5 转CkCAD 拟南芥阳性植株的筛选Fig. 5 Screening of CkCAD transgenic Arabidopsis positive plants
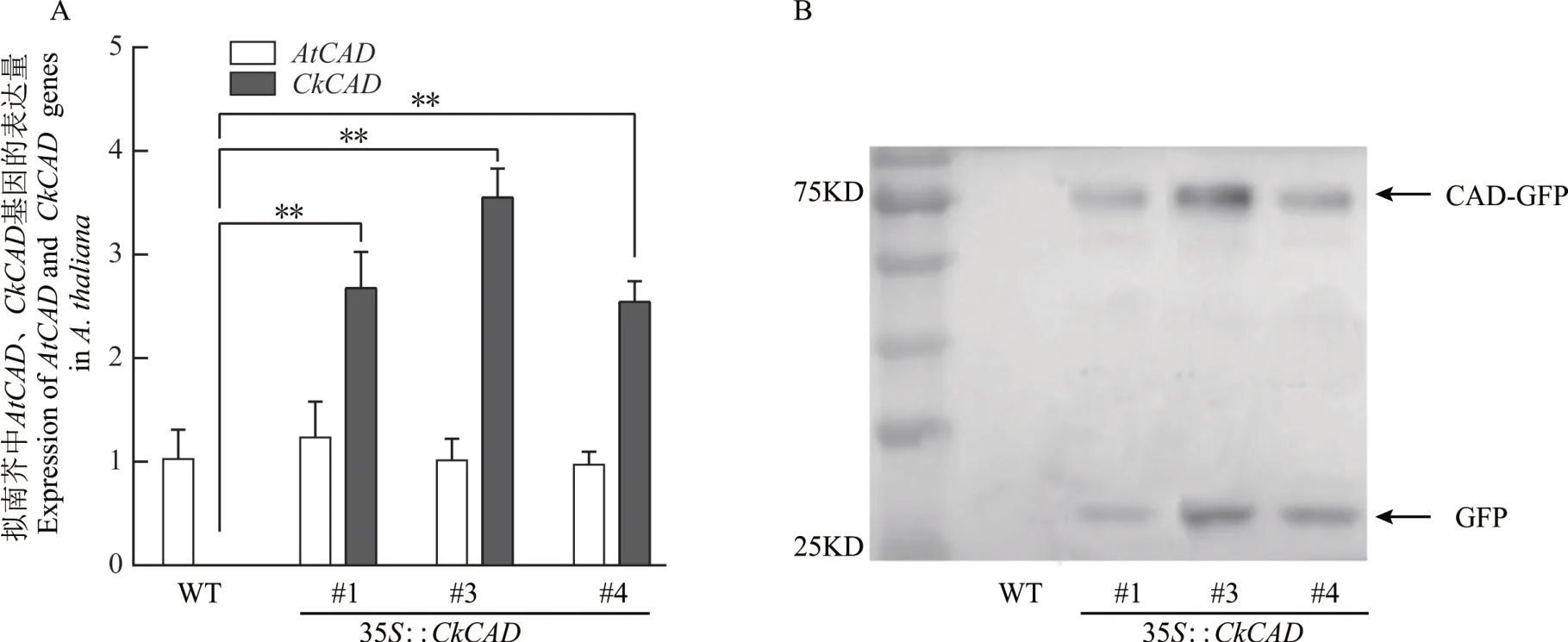
图6 柠条CkCAD 能够在转基因拟南芥中稳定表达Fig.6 C. korshinskii CkCAD can be stably expressed in transgenic Arabidopsis
2.4 过表达CkCAD 的拟南芥株系具有抗旱性
以生长10 d 且正常浇水的野生型拟南芥为对照,对野生型和移栽至苗基质中T3代过表达拟南芥进行为期20 d 的干旱处理(图7)。相较于野生型对照组拟南芥,干旱处理组野生型拟南芥逐渐枯死,且在复水处理2 d 后未能恢复,而过表达CkCAD拟南芥株系在干旱处理20 d 过程中虽然有一定的萎蔫,但是植株生长依然茁壮,且在复水处理2 d 后能够迅速恢复。对干旱处理过程中野生型和转CkCAD拟南芥植株株高和叶片面积变化进行了统计分析后发现,转CkCAD拟南芥株系#1、#3、#4 的株高和叶面积生长速率更高(图8),综合植株生长表型和生长速率说明相较于野生型,过表达CkCAD株系拟南芥具有较强的抗旱性。
2.5 过表达CkCAD 的拟南芥叶脉更加发达
采集野生型和过表达拟南芥株系的叶片,经过透明化并去除叶肉,在体视镜下观察叶脉发育情况,相较于野生型拟南芥,过表达株系叶脉更为发达致密,叶脉密度更大(图9)。

图7 干旱胁迫下转CkCAD 拟南芥植株的生长表型Fig. 7 Growth phenotypes of CkCAD transformed Arabidop⁃sis plants under drought stress

图8 干旱胁迫下野生型及转CkCAD 拟南芥植株株高和叶面积的变化趋势Fig.8 Variation trend of plant height and leaf area of wild-type and CkCAD transformed Arabidopsis plants under drought stress

图9 野生型和转CkCAD 拟南芥植株叶脉表型比较Fig.9 Comparison of leaf vein phenotype between wild-type and CkCAD transgenic Arabidopsis plants
利用Image J 软件进一步统计分析后发现,T3代转CkCAD拟南芥植株的平均脉岛长径比野生型低33%,平均脉岛短径比野生型低35%,平均脉岛密度比野生型高26%(图10)。对叶脉长度进行分析后发现,T3代转CkCAD拟南芥植株的平均叶脉长度比野生型长13%,平均叶脉密度比野生型大20%,T3代转CkCAD植株叶脉更为发达(图10)。
2.6 干旱胁迫下木质素含量和抗旱生理指标的测定
木质素含量测定发现,过表达CkCAD的拟南芥株系木质素含量是野生型拟南芥木质素含量的2.15 倍(图11)。
在干旱处理15 d 后,采集拟南芥叶片测定相关抗旱生理指标及木质素含量。发现过表达拟南芥株系丙二醛含量低于野生型约23%;相对电导率低于野生型约27%;而相对含水量高于野生型约32%(图11)。以上结果说明,过表达CkCAD拟南芥较野生型拟南芥膜脂过氧化程度更低,膜完整性较高,保水能力较高而具有较强的抗旱性。

图11 干旱胁迫下野生型和转CkCAD 拟南芥抗旱性比较分析Fig.11 Comparison of drought resistance between wild-type and CkCAD-transformed Arabidopsis under drought stress
3 讨论
苯丙烷代谢途径是植物体内一条重要的代谢途径,包括木质素合成途径、异黄酮合成途径和花青素合成途径等,能够产生木质素、异黄酮、黄酮醇、花青素等参与植物生长发育和相应非生物胁迫的重要次生代谢产物[7]。关于木质素的研究多集中于木质素生物合成途径的改善[23]及木质素资源开发和利用等方面[24],研究人员通过对苯丙烷生物合成途径的关键酶基因进行突变和RNA 干扰,使其下游代谢物产物更适合用于生物燃料[25-26]。木质素合成途径的主要酶大多都已被克隆,并通过正向和反向遗传学结合来研究它们的作用[27]。通过用苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)抑制剂 L-α-aminooxy-β-phenylpropanoic acid(AOPP)处理绿豆(Vigna ra⁃diata)苗时,明确了植物体内木质素含量降低会导致木质部维管塌陷且植株生长迟缓[28-29]。且近年来研究表明,植物苯丙烷合成途径关键酶基因及蛋白在干旱胁迫下表达量升高[10-11]且木质素沉积增多。植物在干旱胁迫下体内木质素合成相关基因及木质素合成途径积极响应干旱胁迫[30]。
本研究以柠条木质素合成途径下游关键酶基因CkCAD为研究对象,克隆得到1074 bp 的序列(图1),编码357 个氨基酸,蛋白分子质量为38.75 kDa,蛋白质偏酸性且为亲水性蛋白,氨基酸序列与其他物种相比高度保守(图2)。构建了35S::CkCAD过表达载体(图4),通过农杆菌介导转化法获得过表达株系并进行干旱胁迫处理验证CkCAD的抗旱功能。过表达CkCAD的拟南芥株系在干旱处理下生长状态较野生型更好,同时转CkCAD拟南芥株系#1、#3、#4 的株高和叶面积生长速率更高(图7 和图8),这表明CkCAD表达升高导致的木质素含量增加有助于拟南芥抵御干旱环境。作为苯丙烷代谢途径的主要分支之一,木质素合成途径能够生成3 种不同的木质素单体,在过氧化物酶和漆酶的作用下聚合成木质素[31],在植物中木质素主要沉积在次级细胞壁中,不仅能够增强植物体机械强度[32],还能为导管的次级细胞壁提供刚性和疏水性,使它们能够承受水分运输所产生的负压[8]。植物受到干旱胁迫时木质部导管中形成栓塞而导致水分运输中断[33],这已被认为是导致植物死亡的主要原因之一[34-35],植物的抗栓塞性强弱与木质化程度呈正相关[36-39],植物木质化程度越高,对栓塞的抵抗力越强[40]。在本研究中,采用乙酰溴法测定了野生型和过表达CkCAD拟南芥株系木质素含量后发现,过表达CkCAD株系木质素含量是野生型拟南芥木质素含量的2.15 倍(图10)。同时在经过干旱胁迫处理后过表达CkCAD拟南芥株系表现出对干旱胁迫较强的耐受性,说明植物体通过提高木质素合成,增加木质化程度,从而提高对栓塞的抗性以更好地适应干旱,这很可能是植物响应干旱的一种策略。同样在干旱胁迫下植物可通过促进叶脉发育,提高叶脉密度以增强对水分的吸收,提高水分运输效率[41-43]。在本试验中相较于野生型拟南芥,过表达CkCAD株系叶脉密度显著提高,T3代转CkCAD拟南芥植株的平均脉岛长径比野生型低33%,平均脉岛短径比野生型低35%,平均脉岛密度比野生型高26%,平均叶脉长度比野生型高13%,平均叶脉密度比野生型高20%(图8 和图9),这可能是植物受到干旱胁迫的另一种响应策略。
此外,结果表明过表达CkCAD株系具有更高的相对含水量和相对较低的丙二醛和相对电导率(图10)。相对含水量可用于评估干旱胁迫下植物的水分状况;膜的完整性和稳定性对于植物的存活和抗逆性至关重要,丙二醛作为细胞膜脂过氧化的产物,是反映植物细胞膜脂过氧化的指标;同时细胞膜遭到破坏,膜透性增大,导致细胞内电解质外渗,细胞提取液电导率增大,通过测定逆境胁迫下的相对电导率来评估细胞膜的完整性[21]。以上结果表明过表达CkCAD拟南芥具有更高的膜稳定能力和渗透调节能力,从而增加对干旱胁迫的抗性。
4 结论
本研究克隆获得柠条CkCAD基因全长1074 bp,编码357 个氨基酸,蛋白质大小为38.75 kDa,与非洲相思豆、蒺藜苜蓿、大豆和花生的亲缘关系较近,其中与非洲相思豆ApCAD 最为相似,蛋白质偏酸性且为亲水性蛋白,富含甘氨酸、缬氨酸、亮氨酸、赖氨酸、丝氨酸,不包含跨膜结构域,亚细胞定位于细胞质中,蛋白质二级和三级结构主要由无规则卷曲和α 螺旋组成。通过实时荧光定量PCR(qRT-PCR)和Western blot 发现CkCAD及其酶蛋白在拟南芥中呈现稳定表达。相较于Col-0 野生型拟南芥,过表达CkCAD拟南芥叶脉更为发达,脉岛长径、短径、脉岛密度更高,叶脉长度和叶脉密度更大、木质素含量更高。干旱处理发现过表达植株的叶片萎蔫程度、丙二醛含量、相对电导率均低于野生型植株,而相对含水量则高于野生型植株。通过干旱胁迫下转基因植株抗旱能力的提高,证实柠条木质素合成酶基因CkCAD过表达可以促进木质素合成进而提高叶脉发达程度并提高膜稳定性从而增强植物的抗旱性。
