肿瘤转移相关因子1 和血管内皮因子在口腔鳞癌组织中的表达及其与肿瘤侵袭、转移的相关性
2021-03-22陈旭斌张铁柱王敬雯海南省人民医院口腔颌面外科海南海口570广东医科大学附属医院口腔科广东湛江5400湖北省武汉市癌灶医院口腔科湖北武汉4004
陈旭斌,陈 坤,周 昊,张铁柱,王敬雯(.海南省人民医院口腔颌面外科,海南海口 570;.广东医科大学附属医院口腔科,广东湛江 5400;.湖北省武汉市癌灶医院口腔科,湖北武汉 4004)
口腔鳞状细胞癌(OSCC)是头颈部常见的恶性肿瘤,虽然近 50年间其手术、放化疗及生物治疗等方面取得了长足的进步,但 OSCC患者 5年生存率仍低于50%[1],其预后差和病死率较高的主要原因是肿瘤的侵袭及转移。肿瘤的侵袭转移是一个多因素、多步骤、多基因参与的复杂过程,其中细胞外基质的降解、细胞的粘附、肿瘤血管的生成及生长因子、趋化因子的诱导等发挥着重要的作用。近年来研究发现肿瘤转移相关因子1 (MTA1)是与肿瘤侵袭转移密切相关的基因,并与各种实体肿瘤血管生成有关;血管内皮因子(VEGF)是促进新生血管生成的基因,可为肿瘤的生长、增殖、浸润及转移提供基础[2],然而有关MTA1与VEGF在 OSCC组织中的表达及相关性鲜见文献报道。本实验采用实时定量聚合酶链式反应(RT-PCR)及免疫组织化法(IHC)检测MTA1和VEGF在 OSCC组织中的表达,了解MTA1和VEGF与OSCC侵袭、组织病理学分级及颈淋巴结转移的关系。
1 材料和方法
1.1 材料
收集2011年9月-2013年9月在广东医科大学附属医院口腔科住院的 40例 OSCC患者,男 23例,女17例;舌癌 20例,颊癌 8例,牙龈癌 9例,口底癌3例;年龄27~69岁,平均43.6岁。所有患者术前均未行放化疗,经组织病理学确诊,行OSCC灶扩大切除+颈淋巴清扫术。术后切取标本,分为 2组:一组行石蜡切片,用于 HE常规染色和IHC检测;另一组即刻液氮冷冻,-80℃贮存,用于RT-PCR检测。
1.2 主要试剂及仪器
鼠抗人 MTA1单克隆抗体、兔抗人 VEGF单克隆抗体、GTVisionTMⅢ抗鼠/兔通用免疫组织化学检测试剂盒(含 DAB相关试剂)购自基因科技(上海)有限公司;RT试剂盒购自赛默飞世尔科技(中国)有限公司;PCR试剂盒购自天根生化科技有限公司;Trizol、DEPC购自美国Sigma公司。
1.3 方法
1.3.1 免疫组织化学染色 组织的石蜡包埋及切片,蜡块行4 μm厚切片,按 GTVisionTMⅢ抗鼠/兔通用免疫组织化学检测试剂盒操作法:烤片,石蜡切片脱蜡和水化,微波修复抗原,滴加一抗(用3%BSA-PBS封闭液1∶ 50稀释一抗),室温复温45 min,PBS冲洗3次,吸干,滴加适量生物素标记二抗工作液,吸干,加入稀释好的辣根过氧化物酶(HRP)标二抗,室温下湿盒孵育30 min;使用DAB显色试剂盒,加试剂盒中 A、B、C试剂各1 滴(约50 μL),混匀后加至切片,避光保存,室温显色,中性树胶封片,显微镜观察拍照。实验中设阳性对照和阴性对照。
1.3.2 实时定量PCR检测 每个标本分3 组,分别采用两步染料嵌合荧光RT-PCR法检测MTA1、VEGF和GAPDH mRNA水平,Master Cycler Gradient PCR仪和LightCycler480ⅡDNA扩增仪进行分析:Trizol溶液提取标本组织总 RNA,逆转录为 cDNA,再进行实时荧光定量 PCR检测。引物由生工生物工程(上海)股份有限公司设计、合成,见表1。实时定量PCR反应,获取各组标本的标准曲线,计算机分析Ct值。△CT=目的基因 CT-内参 CT;△△CT=(目的基因△CT-正常组织△ CT的均值);相对表达量=2-△△CT。
1.4 统计学处理
采用SPSS20.0软件进行数据分析,以χ2检验分析 MTA1在 OSCC组织与正常组织中表达的差异,Spearman分析 OSCC组织中 MTA1与VEGF表达的相关性,单因素方差分析MTA1 mRNA在 OSCC组织、癌周组织和癌周正常组织中的相对表达量及其与临床病理学的关系,双因素方差分析 MTA1 mRNA与VEGF mRNA相对表达的相关性。
2 结果
2.1 IHC结果判定
MTA1阳性表达位于细胞核,呈棕黄色颗粒物状(图 1);VEGF阳性表达位于细胞浆,呈棕黄色颗粒物状(图 2)。图3 为阴性对照。
2.2 MTA1 和VEGF 在OSCC组织中的表达
MTA1在癌灶周围正常组织和OSCC组织中的阳性率表达分别为20.0%和62.5%,差异有统计学意义(P<0.05);VEGF在癌灶周围正常组织和OSCC组织中的阳性率表达分别为17.5%和57.5%,差异有统计学意义(P<0.05)。MTA1在低、中及高分化组的OSCC组织中表达的阳性率差异有统计学意义(P<0.05);伴有与不伴有颈淋巴结转移组的 OSCC组织中 MTA1阳性率表达差异有统计学意义(P<0.05)。详见表2。

表1 MTA1、VEGF和GAPDH引物序列

图1 OSCC组织MTA1 IHC (×200)
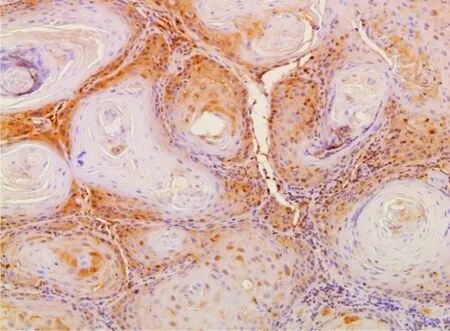
图2 OSCC组织VEGF IHC(×200)
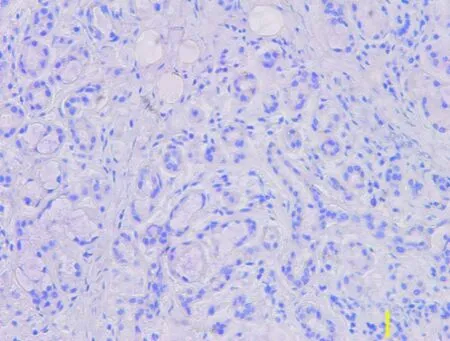
图3 阴性对照(×200)
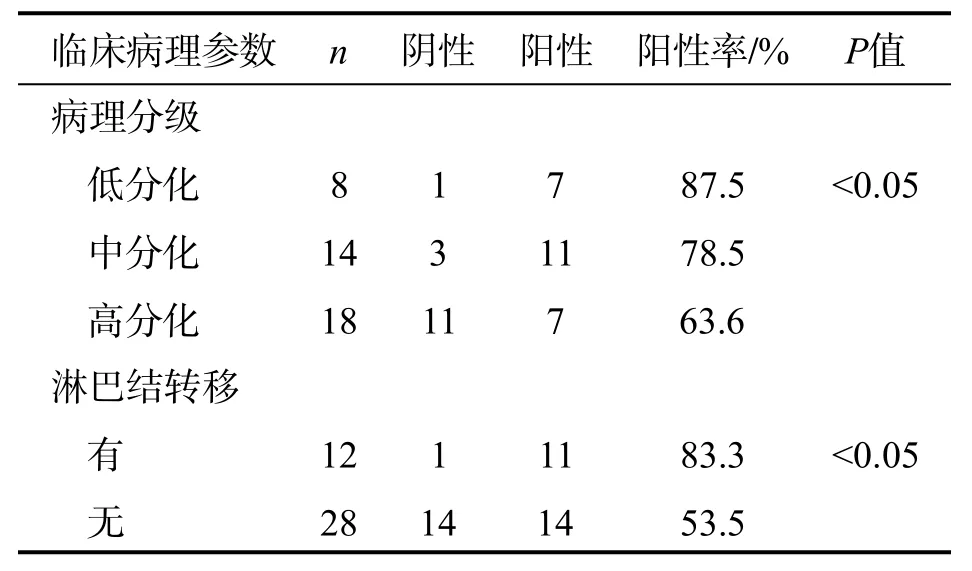
表2 MTA1在 OSCC组织中的表达与其临床病理因素的关系
2.3 MTA1 和VEGF 在OSCC组织中表达的相关性
MTA1和VEGF在 OSCC组织中的表达呈正相关(r=0.588,P<0.05),见表3。

表3 MTA1和VEGF表达的相关性分析
2.4 qRT-PCR 结果判定
MTA1和VEGF 的 PCR产物扩增曲线可见所有样品均进入扩增平台期,证明反应条件设定准确(图4、5);MTA1和VEGF的 PCR产物溶解曲线可见溶解峰值大致相同,说明产物单一,无非特异性产物和引物二聚体等产生干扰,证明所扩增的产物特异性较好(图6、7)。
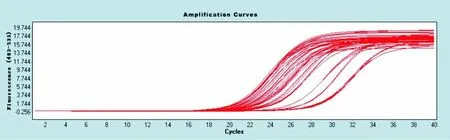
图4 扩增曲线(MTA1)
图5 扩增曲线(VEGF)
图6 融解曲线(MTA1)
图7 融解曲线(VEGF)
2.5 MTA1 mRNA和VEGF mRNA的相对表达量
MTA1 mRNA和VEGF mRNA在 OSCC癌灶组织、癌周边缘组织及癌周正常组织中的相对表达量比较差异有统计学意义(P<0.01),见表4。
2.6 MTA1 mRNA 和VEGF mRNA在 OSCC组织中表达的关系
MTA1 mRNA 和VEGF mRNA 在 OSCC组织中的表达呈正相关(r=0.826,P<0.01)。
表4 OSCC各组织中MTA1 mRNA相对表达量(±s, n=40)

表4 OSCC各组织中MTA1 mRNA相对表达量(±s, n=40)
两两比较均P<0.01
3 讨论
3.1 MTA1 在OSCC组织中的表达与其临床病理因素的关系
口腔鳞状细胞癌是口腔最常见的恶性肿瘤,占口腔颌面部恶性肿瘤90%以上[3],其生物学特性主要表现为局部浸润性生长及早期发生颈部淋巴结转移,而颈淋巴结转移是导致OSCC患者死亡的重要原因之一。对OSCC发生早期的颈淋巴结转移,目前的检测方法难以作出正确的临床诊断。因此,对OSCC侵袭转移机制及相关基因的研究,有助于为OSCC的早期诊断、治疗及预防提供理论依据。
MTA是最近发现的一个基因家族,包括MTA1、MTA2 和MTA3。研究表明 MTA1在人体多种肿瘤中存在异常高表达,并与肿瘤的侵袭转移有关[4]。Kawasaki等[5]发现 MTA1在 OSCC组织中高表达与OSCC侵袭转移有关。刘建平等[6]研究证实食管鳞癌中MTA1 与VEGF-c的表达呈正相关,其可能共同促进食管鳞癌淋巴管的形成及淋巴结转移。翟荣等[7]发现 MTA1在 OSCC癌灶组织较癌周正常组织高表达,MTA1 与OSCC病理分级、有无颈淋巴结转移有关。王永霞等[8]通过免疫组化及原位杂交法研究显示 MTA1蛋白和MTA1 mRNA 在 OSCC中明显高于口腔黏膜白斑及口腔黏膜。综上所述,国内外研究均证实 MTA1在肿瘤中的表达与人体多种实体肿瘤的侵袭转移及血管生成有关,并在OSCC中呈高表达。本实验采用RT-PCR 和IHC法检测MTA1 在OSCC癌灶组织、癌周边缘组织及癌周正常组织中的表达,结果显示MTA1 在OSCC组织中呈高表达,且在低、中分化组中 MTA1的表达明显高于高分化组,提示MTA1 在OSCC中的高表达可能与其发生及恶性程度有关;伴有颈淋巴结转移组织中的 MTA1表达明显高于无颈淋巴结转移组织,提示MTA1 在OSCC组织中的表达与其颈淋巴结转移有关,MTA1的高表达可能在OSCC颈淋巴结转移中起重要作用。本研究结果与上述文献报道结果一致。因此,我们认为MTA1在OSCC组织中的高表达与OSCC的侵袭及颈淋巴结转移密切相关,且与OSCC的发生、发展有关。
3.2 VEGF 在OSCC组织中表达与MTA1表达的相关性
VEGF在肿瘤的实质、间质和上皮细胞中广泛表达,且通过自分泌或者旁分泌方式在肿瘤生长、血管生成及侵袭转移中起重要作用。Naruse等[9]研究显示p-mTOR+/HIF-1α+/VEGF-A+表达与OSCC的肿瘤分级、颈部淋巴结转移及侵润分级有关,结果证明mTOR/HIF-1α/VEGF通路影响OSCC的发生、发展。本研究采用RT-PCR 和IHC法检测 VEGF mRNA与VEGF蛋白在OSCC癌灶组织、癌周边缘组织及癌周正常组织中的表达情况,结果发现VEGF 在OSCC组织中的表达高于癌灶周围正常组织,提示 VEGF在OSCC中的高表达可能与OSCC的发生及侵袭有关。
Du等[10]研究显示直肠癌中 MTA1高表达与肿瘤直径大小有关,且 MTA1的表达水平与肿瘤微血管密度有关,同时还证实MTA1、VEGF-C的高表达与淋巴结转移及临床 dukes标准分期有关;高表达的MTA1可使 VEGF mRNA和VEGF蛋白的表达上调,而用小干扰 RNA(siRNA)敲低 MTA1表达后,VEGF mRNA及其蛋白的表达水平均降低。采用酶联免疫吸附测定法(ELISA)检测发现,相较空质粒转染的直肠癌细胞,MTA1高表达的直肠癌细胞培养液中存在更高含量的VEGF,相反,控制组MTA1沉默的直肠癌细胞所分泌的 VEGF大量减少。Yang等[11]研究显示,在子宫内膜癌中MTA1和VEGF表达均高于正常子宫内膜组织,且两者的表达与子宫内膜癌临床分级、病理分期、淋巴结转移和肌层侵润有关,二者表达呈正相关。本研究采用Spearman分析MTA1、VEGF 在 OSCC组织中表达的相关性,结果显示 MTA1 和VEGF 在 OSCC组织中的阳性率分别为62.5%、57.5%,MTA1 与VEGF的表达呈正相关;同时,采用双因素方差分析 MTA1 mRNA和VEGF mRNA 在 OSCC组织中的相对表达量,结果呈正相关,提示 MTA1 和VEGF 在 OSCC的侵袭转移中可能起协同作用。
3.3 MTA1 与VEGF 在OSCC肿瘤微环境中的作用
研究发现[12],肿瘤在发生发展过程中创造了独立的低氧高酸性微环境,这种条件更适合肿瘤细胞的侵袭转移,并且认为肿瘤微环境中必定有一些成分与适应肿瘤细胞变化有关。肿瘤微环境主要包括肿瘤细胞、基质细胞、免疫细胞、血管和淋巴管等。这些细胞可分泌多种细胞因子和趋化因子,促进肿瘤侵袭转移。特定的肿瘤微环境可以通过影响肿瘤细胞的增殖、调节转移相关基因的表达水平、诱导血管生成以及促进细胞外基质的降解,从而促进侵袭转移的发生[11]。肿瘤新生血管的形成不仅是肿瘤微环境的基础,也是肿瘤发生发展的基础,肿瘤必须不断地产生新生血管,才能维持其继续生长。肿瘤血管与正常血管有以下不同:结构不同、形状呈弯曲状或囊状、较老化及排布杂乱无章。血管的异常导致血液在不同的时间、空间下对肿瘤进行异常的灌注。异常灌注可导致肿瘤细胞缺氧及细胞外 pH值降低,而缺氧又可导致肿瘤的侵袭转移、遗传的不稳定性、血管形成、免疫抑制、炎症反应及上皮间质转化(EMT)等。缺氧可以上调VEGF的表达,VEGF又可以促进异常结果的肿瘤微血管形成,因此形成恶性循环。本研究证实VEGF在 OSCC组织中的表达明显高于癌灶周围正常组织,这与Aggarwal等[13]研究结果一致,说明 VEGF可能与OSCC微环境中异常血管的生成及 OSCC的侵袭转移有关。有研究显示 MTA1在促进乳腺癌侵袭转移比VEGF更有潜力,MTA1可在肿瘤与非肿瘤环境中诱导产生血管[14]。Sun等[15]用蛋白印迹分析法检测胰腺癌中缺氧诱导因子(HIF-α)和VEGF在体外和体内的表达情况,我们发现 MTA1过表达可增强胰腺癌细胞侵袭与转移能力,同时可升高 HIF-α和VEGF蛋白在体外和体内表达水平,而 MTA1被抑制则相反。
综合上述,MTA1是一个潜在的促血管生成的分子,MTA1与VEGF的相互作用调节肿瘤血管的形成及侵袭转移。本研究采用IHC 及 RT-PCR检测结果显示,MTA1和VEGF 在 OSCC组织中表达呈正相关,这与上述研究结果一致,提示 MTA1和VEGF在OSCC肿瘤微环境中起重要的作用,二者可能在OSCC的侵袭转移中起协同作用。
