菊花滑刃线虫RPA 检测方法研究
2021-03-22鞠玉亮王金成郑春生魏亚东黄国明
林 宇,鞠玉亮,刘 娟,王金成,高 建,郑春生,魏亚东,黄国明
(1. 天津海关动植物与食品检测中心,天津 300461;2. 安徽农业大学,安徽 合肥 230036;3. 北京海关技术中心,北京 101300)
菊花滑刃线虫(Aphelenchoides ritzemabosi)是一种植物专性寄生线虫,既能以内寄生方式寄生于植物组织内,又能通过外寄生方式附着于植物花、叶、芽生活[1]。该线虫可寄生于200 种以上高等植物,菊花是其典型危害寄主。其侵染菊花后可引起菊花枯叶病,导致叶片枯死、花芽生长发育受阻或出现畸形。同时该线虫抗逆性强,在种子、植物组织、介质土壤以及植物病残体中能够以休眠或脱水状态长时间存活,具有较高的远距离传播扩散风险[2]。目前,菊花滑刃线虫已在世界70 个以上国家发生,我国的江苏、福建、江西、河南、湖北、广东、广西、贵州、四川、云南等地也发现其为害,对菊花、草莓、烟草等农作物的生产造成了严重影响[3-5]。
伴随着分子生物学技术的快速发展和广泛应用,植物寄生线虫的分类鉴定也从经典的形态学方法拓展到以PCR 为基础的变温分子检测技术和恒温分子检测技术,如PCR-RFLP、SCAR 标记、实时荧光PCR、LAMP、DNA 条形码[6]等,这些鉴定技术为植物线虫的分类鉴定提供了更可靠、更成熟的手段。重组酶聚合酶扩增(recombinase polymerase amplification,RPA)技术是一种在常温下进行核酸扩增的方法,属于等温核酸体外扩增技术的一类[7]。其原理是利用重组酶与引物形成聚合体,在模板DNA 上搜索与之完全互补配对的DNA 序列,通过单链DNA 结合蛋白的作用使模板DNA 解链,同时在DNA 聚合酶的作用下,完成复制延伸过程[8]。
目前,RPA 技术已在植物有害生物检测鉴定方面开展应用研究。魏梅生等[9]建立了番茄细菌性叶斑病菌(Pseudomonas syringae pv. tomato)的RPA 检测方法,这是我国首次报道该技术的实际应用,DNA检测灵敏度可达75 fg/μL,与普通PCR 结果相当。张娜等[10]利用RPA 技术构建了葡萄卷叶伴随病毒3 号(Grapevine leafroll-associated virus 3 , GLRaV-3)的 快速检测方法,将该项技术首次应用于葡萄病毒鉴定检测。Ju 等[11]运用RPA 技术对根结线虫属(Meloidogyne spp.)中南方根结线虫(M. incognita)、花生根结线虫(M. arenaria)、爪哇根结线虫(M. javanica)、象耳豆根结线虫(M. enterolobii)4 个近似种成功实现快速检测与区分。笔者拟利用RPA 技术,建立一种简便高效的菊花滑刃线虫检测方法,为口岸植物检疫快速通关、农业线虫病害田间诊断提供更好的技术支持。
1 材料与方法
1.1 试验材料
用于试验的线虫种群共计12 个,其中菊花滑刃线虫种群2 个、水稻干尖线虫(Aphelenchoides besseyi)种群3 个、内卷滑刃线虫(Aphelenchoides involutus)种群1 个、双尾拟滑刃线虫(Aphelenchoides bicaudatus)种群1 个、真滑刃线虫种群(Aphelenchus avenae)1 个、伞滑刃属线虫(Bursaphelenchus)种群2 个以及未知种群2 个。所有线虫种群均由天津海关动植物与食品检测中心植检实验室收集保存(表1)。
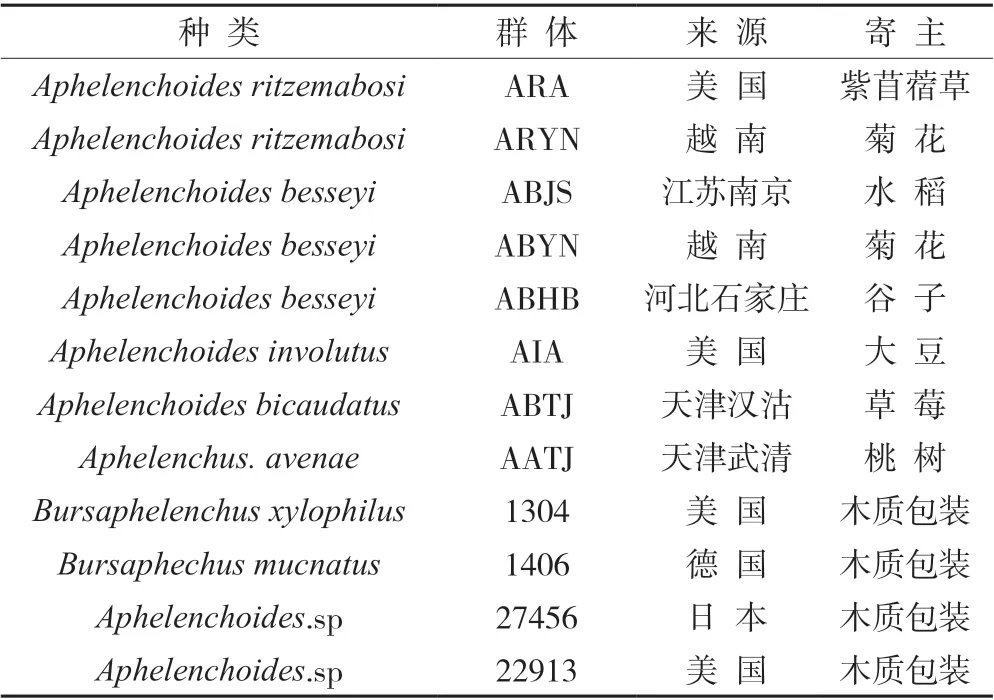
表1 试验线虫种群来源
主要试剂有TwistAmp Basic 试剂盒(TwistDx)、dNTPs、Taq DNA 聚 合 酶、10x PCR Buffer(Mg2+)、DL2000,均购于宝生物工程(大连)有限公司;28S rRNA-D2/D3 区通用引物 D2A/D3B 与RPA 特异性检测引物 AR-R-F/ AR-R-R 由上海生工生物工程技术服务有限公司合成。
1.2 试验方法
1.2.1 单条菊花滑刃线虫DNA 提取 用挑针将线虫置于滴有ddH2O 的载玻片中清洗,清洗后将线虫转入PCR 管(已加入8 µL ddH2O),利用昆虫小型解剖刀在PCR 管中将线虫虫体切裂,后加入2 µL 提取裂解液,置于PCR 仪中56 ℃温浴1 h,95 ℃加热10 min,离心后获得的DNA 提取液可直接用于PCR 扩增或放于-20 ℃冰箱留存[12]。
1.2.2 菊花滑刃线虫28S rRNA-D2/D3 区扩增 利用植物寄生线虫28S rRNA-D2/D3 区通用引物D2A/D3B扩增菊花滑刃线虫28S rRNA-D2/D3 序列。PCR 反应体系(25 μL):2×Taq MasterMix 12.5 μL、正反向引物各1 μL(10 μmol/L)、DNA 模板2 μL,ddH2O 补足至25 μL。PCR 扩增反应程序参照王金成等[13]的方法,95℃10 min;95℃30 s,55℃30 s,72℃1 min,39 个循环;72℃10 min,冷却至室温。PCR 产物进行电泳检测后送测序公司进行克隆测序。
1.2.3 RPA 特异性引物设计 检索Genbank 数据库中已鉴定到种的滑刃属线虫(Aphelenchoides spp.)的28S rRNA-D2/D3 序列进行打包下载,再结合该研究测得的菊花滑刃线虫群体28S rRNA-D2/D3 核酸序列,利用BioEdit 软件进行序列比对,分析差异位点,将上述序列导入Primer 6.0 设计出菊花滑刃线虫RPA 特异性检测引物。
1.2.4 菊花滑刃线虫RPA 检测方法的建立采用设计的RPA 特异性引物AR-R-F(5´- TTCAATGTCGAATAG TCAAGTTAAAGTTATG-3´)/AR-R-R(5´-GAATTTGAC TTATCGTTT CCTTTAAAACACC-3´)对菊花滑刃线虫进行RPA 特异性测试,同时设置阴性对照(ddH2O)。反应体系(50 μL):线虫DNA 模板10 μL、干粉溶解缓冲液(rehydration buffer)29.5 μL、引物(10 μmol/L)各2.4 μL、ddH2O 3.2 μL,加280 mmol/L 醋酸镁2.5 μL 启动反应。混匀后在PCR 仪中38 ℃温浴40 min。RPA 扩增反应结束后,加入50 μL 苯酚/氯仿溶液至RPA 扩增产物中充分混匀,放置离心机12 000 r/min 离心2 min,取表面上清液用于凝胶电泳,扩增产物送至测序公司克隆测序。
1.2.5 RPA 检测方法特异性测试 依据1.2.4 检测反应体系对菊花滑刃线虫及其他10 个种群进行RPA 特异性测试,同时设置阴性对照(ddH2O),对建立的RPA 检测方法特异性进行测试。
1.2.6 RPA 灵敏度测试 提取单条菊花滑刃线虫DNA, 分 别 稀 释 为1/5、1/10、1/20、1/40、1/80、1/160、1/320 这7 个浓度梯度,按照1.2.4 检测反应体系,测试RPA 检测方法的灵敏度。
2 结果与分析
2.1 菊花滑刃线虫28S rRNA-D2/D3 区扩增
根据植物寄生线虫通用引物28S rRNA-D2/D3 区扩增结果(图1)显示,研究收集的菊花滑刃线虫种群均扩增出明亮单一的条带,阴性对照无条带出现。经克隆测序后获得菊花滑刃线虫28S rRNA-D2/D3 区产物长度为750 bp 左右,结合Genbank 数据库中下载的滑刃属线虫(Aphelenchoides spp.)28S rRNA-D2/D3区序列,综合分析比对,设计菊花滑刃线虫RPA 特异性检测引物。

图1 菊花滑刃线虫种群28S rRNA-D2/D3 扩增结果
2.2 菊花滑刃线虫RPA 检测方法的建立
采用RPA 检测特异性引物AR-R-F/AR-R-R 对菊花滑刃线虫DNA 进行扩增,结果如图2 所示,测序后获得约202 bp 的特异性片段,与预期目的条带一致,阴性对照(ddH2O)则无条带出现,将扩增的特异性片段进行序列比对,与目的片段一致。
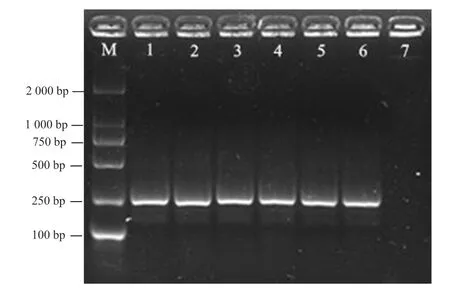
图2 RPA 方法检测菊花滑刃线虫结果
2.3 菊花滑刃线虫RPA 检测方法特异性测试
利用RPA 检测特异性引物AR-R-F/AR-R-R 对菊花滑刃线虫以及近似种进行特异性测试,结果如图3 所示,设计的RPA 引物仅能对菊花滑刃线虫有效,扩增出约202 bp 的特异性目的片段,其余寄生线虫与阴性对照(ddH2O)则无条带出现,证明该检测方法具有较强的特异性。

图3 菊花滑刃线虫RPA 方法特异性检测结果
2.4 RPA 检测灵敏度测试
对单条线虫DNA 按1/5、1/10、1/20、1/40、1/80、 1/160、1/320 的比例进行稀释,然后以稀释后的DNA为模板进行RPA 检测,结果如图4 所示,未稀释的菊花滑刃线虫DNA 扩增的特异性条带明亮清晰;稀释至1/5~1/80 后,RPA 检测特异性产物条带依然质量较高,没有明显的减弱;当稀释至1/160~1/320 时,扩增条带质量明显下降,但整体仍可清楚判别。这表明以该研究设计的RPA 特异性引物为基础建立的菊花滑刃线虫RPA 检测体系具有较高的灵敏度。

图4 菊花滑刃线虫双重RPA 方法灵敏度检测结果
3 小结与讨论
试验以菊花滑刃线虫为对象,利用RPA 技术建立了菊花滑刃线虫RPA 检测方法,可特异性检测菊花滑刃线虫,产生约202 bp 的特异性片段,对其他近似种线虫群体呈现阴性。该恒温扩增检测方法在38 ℃等温条件下温浴40 min 便可完成反应,同常规PCR、SCAR 标记、DNA 条形码等检测方法相比较,有效缩短了检测时间,降低了对PCR 仪的刚性需求,在小型金属浴设备中也能进行扩增,有利于该方法在基层一线实验室的布局和推广。而与等温扩增技术中的典型代表环介导等温扩增技术(LAMP)相比,RPA 技术其优势在于,引物设计简单,仅需一对引物即可完成扩增,避免了引物设计困难、互相干扰性大、扩增条件需大量实验摸索、检测体系不稳定等负面因素,因此RPA 检测方法的建立与实用更简便易行。
同时该研究建立的菊花滑刃线虫RPA 检测方法具有较高的灵敏度,不仅对单条线虫提取DNA 实现高效检测,而且当模板DNA 浓度稀释为单条线虫的1/320 时,扩增出的特异性条带结果依然可以判别。此外,因为RPA 技术对模板DNA 的独特结合方式,要求特异性引物至少由30~35 个碱基构成,这种长引物与模板DNA 的严格互补结合,从而使得RPA 检测扩增的产物特异性较高,不容易出现假阳性结果。
研究基于RPA 技术建立的菊花滑刃线虫检测方法,在有效缩短检测时间的同时,又能保持较高的灵敏度,为菊花滑刃线虫的的检测鉴定提供了一种更为简便、快捷的方法,对于口岸植物检疫快速通关、线虫病害田间调查等应用十分方便。
菊花滑刃线虫是滑刃属线虫中十分重要的植物寄生线虫,属于我国检疫性有害生物[4]。崔汝强等[14]曾利用植物寄生线虫rDNA-ITS 区序列差异性,设计出特异性引物BSF/ArtR,建立了菊花滑刃线虫的常规PCR 特异性引物检测方法,王金成等[15]利用NCBI数据库滑刃属线虫的核糖体28S rRNA-D2/D3 和ITS序列进行系统进化分析得出,28S rRNA-D2/D3 与ITS序列能够较好地区分大部分滑刃线虫种类,可作为滑刃属线虫DNA 条形码候选基因,上述方法一定程度上为菊花滑刃线虫的分子鉴定提供了参考。
