ω-3多不饱和脂肪酸对小鼠急性胰腺炎自噬功能及PI3K/Akt通路的影响
2021-03-21孔祝容唐立蒋文俊
孔祝容,唐立,蒋文俊
重症急性胰腺炎(severe acute pancreatitis,SAP)是指因胰酶异常激活、胰腺局部炎症反应,引起的以全身炎症综合征及多器官功能衰竭、死亡为主要特征的急腹症[1-2]。SAP发病急、并发症多、死亡率高,且无特殊的药物及治疗方法[3]。SAP发病机制复杂,目前研究发现,胰腺腺泡细胞坏死凋亡、炎症反应、氧化应激、自噬等与SAP发生发展关系密切[4]。磷酸肌醇-3激酶(phosphoinositide-3 kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)通路可调控细胞凋亡、自噬、炎症反应等多种生理过程[5],且PI3K/Akt通路在SAP发生发展中扮演重要角色,并可能为SAP的治疗提供新的靶点[6]。寻找SAP特殊的药物及治疗策略,一直是临床研究的热点。ω-3多不饱和脂肪酸(omega-3 polyunsaturated fatty acids,ω-3PUFA)为人类必须的脂肪酸,是一种具有抗炎、抗氧化作用的免疫营养物质[7],近来临床报道发现,ω-3PUFA干预治疗可有效降低SAP及脓毒症患者的炎症反应进程[8],降低SAP患者发生器官衰竭的风险[9],预示ω-3PUFA可能为治疗SAP的潜在有效药物。但ω-3PUFA缓解SAP炎性反应及死亡症状的具体机制还不甚明确。本研究建立SAP小鼠模型,从PI3K/Akt通路介导的炎症、自噬、凋亡等方面,探究其ω-3PUFA缓解SAP病理进程的可能机制,以期为SAP的临床治疗及ω-3PUFA的开发应用,提供一定的实验依据。
1 材料与方法
1.1 实验材料
1.1.1 动物 健康雄性BALB/C小鼠,体质量20~22 g,6~7周育龄,购自于首都医科大学实验动物科学部[SCXK(京) 2015-0006],所有小鼠于本院动物房中饲养。本实验经本院伦理委员会批准,试验动物符合3R原则。
1.1.2 主要试剂及仪器 ω-3多不饱和脂肪酸(ω-3PUFA)(货号:ST1267,上海碧云天生物技术有限公司);自噬抑制剂(3-甲基腺嘌呤,3MA)(货号:CD-07263,武汉纯度生物科技有限公司);PI3K/Akt激活剂(740Y-P)(货号:M05856,北京百奥莱博科技有限公司);淀粉酶、白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)ELISA试剂盒(货号:YK-13288、YK-10490、YK-10854,北京伊塔生物科技有限公司);雨蛙素(货号:YT31544,北京伊塔生物科技有限公司);苏木精-伊红染色(HE)(货号:YT165,北京百奥莱博科技有限公司);TUNEL染色试剂盒(货号:YT137-RJZ,北京百奥莱博科技有限公司);微管相关蛋白轻链3B(LC3B)、PI3K、磷酸化Akt(p-Akt)、核转录因子κB(NF-κB)、磷酸化指标(p-NF-κB)、哺乳动物雷帕霉素靶蛋白(mTOR)、磷酸化mTOR(p-mTOR)、自噬相关蛋白(Beclin1)、B细胞淋巴瘤-2(Bcl-2)、促凋亡相关蛋白Cleaved-caspase-3及Bax抗体(货号分别为:ab192890、ab154598、ab38449、ab220803、ab239882、ab134903、ab278621、ab210498、ab182858、ab214430、ab182733,美国abcam公司)。JCM-6000透射电镜(日本电子光学公司)等。
1.2 方法
1.2.1 小鼠SAP模型建立及分组给药 取小鼠,参照文献[10]腹腔注射雨蛙素50 μg/kg,1次/h,共7次,建立SAP模型,若造模期间小鼠有死亡,解刨死亡小鼠,可见胃、肠极度扩张,胰腺片状出血坏死且呈暗黑色,视为造模成功,共造模成功75只小鼠,随机数字表法分为模型组、ω-3PUFA(2.5 g/kg)组、3MA(PI3K及自噬抑制剂-3-甲基腺嘌呤,10 mg/kg)组、740Y-P(PI3K/Akt激活剂,20 mg/kg)组、ω-3PUFA+740Y-P(2.5 g/kg+20 mg/kg)组,每组15只。另取15只小鼠,与相同时间及频率注射等量生理盐水,作为正常对照组。造模成功后开始给药,ω-3PUFA参照文献[11]设置剂量,并用生理盐水稀释成浓度为0.6 g/mL的混悬液,按10 mL/kg的剂量,经腹腔注射给药。740Y-P及3MA参照文献[12-13]设置剂量并经尾静脉注射给药1次;ω-3PUFA+740Y-P组腹腔注射ω-3PUFA,尾静脉给予740Y-P;各组均给药4 d。给药期间统计各组小鼠死亡情况。
1.2.2 小鼠血清淀粉酶及炎性因子检测 末次给药麻醉后,腹主动脉取血3 mL,离心取血清按ELISA试剂盒检测淀粉酶及炎性因子IL-1β、TNF-α水平。
1.2.3 透射电镜检测及标本采集 处死小鼠,解剖取胰腺组织,剪下约0.3 cm×0.3 cm组织块,2.5%戊二醛浸润固定后,送入电镜室检查胰腺腺泡细胞结构变化及自噬泡形成情况。剩余胰腺组织分成两部分,一部分置于-80 ℃保存,另一部分迅速置于4%多聚甲醛中固定24 h,常规透明、浸蜡、包埋后、切成5 μm切片。
1.2.4 HE及TUNEL染色观察胰腺组织病理变化及腺泡细胞凋亡状况 取1.2.3中部分石蜡组织切片,分别按HE及TUNEL染色试剂盒说明书方法进行染色、封片后,置于光学显微镜下观察胰腺组织病理变化及腺泡细胞凋亡状况。取HE染色切片,参照文献[10]中方法,对胰腺水肿、坏死、出血及脂肪坏死情况、炎症浸润情况等进行评分。
取TUNEL染色切片,光学显微镜下观察并用Image-pro plus软件系统检测棕黄色染色的凋亡细胞数目,细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.2.5 免疫荧光法检测LC3B、PI3K表达 取1.2.3中部分组织石蜡切片,脱蜡、水化、曲拉通透化后,分别加入一抗(LC3B、PI3K,1∶200)4 ℃湿盒孵育过夜。避光加入荧光二抗(异硫氰酸荧光素, 1∶200),DAPI染核 30 min,甘油封片,于荧光显微镜下观察拍照。
1.2.6 免疫组化法检测p-NF-κB、Cleaved-caspase-3阳性表达 取1.2.3中部分组织石蜡切片,脱蜡、水化、抗原修复及灭活后,分别加入一抗(p-NF-κB、Cleaved-caspase-3,1∶500)4 ℃孵育过夜,经DAB显色,苏木精复染,盐酸乙醇分化、脱水、封片后,于光镜下观察并拍照,用Image Pro-Plus 6.0软件进行累计光密度值测量分析。
1.2.7 Western blot法检测胰腺组织Akt、p-Akt、mTOR、p-mTOR、Beclin1、Bcl-2、Bax蛋白相对表达水平 取1.2.3冰冻胰腺组织,4 ℃解冻,裂解提取蛋白,BCA法测蛋白总浓度后,取50 μg蛋白进行电泳及转膜反应,加入一抗(Akt、p-Akt、mTOR、p-mTOR、Beclin1、Bcl-2、Bax,1∶600,β-actin(内参))抗体,1∶800),4 ℃孵育过夜,加入HRP羊抗兔二抗(1∶800),37 ℃孵育3 h,增强化学发光法显色,以化学发光仪观察条带并拍照,以Image-J软件分析各组蛋白相对表达。
1.3 统计方法

2 结果
2.1 ω-3PUFA对小鼠死亡及胰腺损伤大体观察的影响
正常对照组无死亡,胰腺组织正常。模型组及ω-3PUFA+740Y-P组小鼠各有5只死亡,腹腔内血性积液较多,胃、肠扩张及胰腺片状出血、坏死严重。ω-3PUFA组及3MA组小鼠无死亡,腹腔内血性积液减少,胃、肠扩张及胰腺片状出血、坏死缓解。740Y-P组小鼠死亡9只,腹腔内血性积液、胃、肠扩张及胰腺片状出血、坏死进一步加重。
2.2 ω-3PUFA对小鼠血清淀粉酶及炎性因子水平的影响
与正常对照组相比,模型组小鼠血清淀粉酶及炎性因子IL-1β、TNF-α水平升高(P<0.05)。与模型组相比,ω-3PUFA组及3MA组小鼠血清淀粉酶及炎性因子IL-1β、TNF-α水平降低(P<0.05),740Y-P组小鼠血清淀粉酶及炎性因子IL-1β、TNF-α水平进一步升高(P<0.05)。与ω-3PUFA组相比,ω-3PUFA+740Y-P组血清淀粉酶及炎性因子IL-1β、TNF-α水平升高(P<0.05),见表1。

表1 各组小鼠血清淀粉酶及炎性因子水平比较
2.3 ω-3PUFA对小鼠胰腺超微结构变化及自噬空泡形成的影响
电镜观察显示,正常对照组小鼠腺泡细胞核、内质网和线粒体等细胞器结构清晰完整,无自噬空泡形成。与正常对照组相比,模型组及ω-3PUFA+740Y-P组小鼠腺泡细胞胞核及胞浆固缩、线粒体肿胀及细胞器结构消失严重,双层膜结构的细胞自噬空泡形成较多。与模型组相比,ω-3PUFA组及3MA组腺泡细胞胞核及胞浆固缩、线粒体肿胀缓解及自噬空泡形成减少;740Y-P组腺泡细胞胞核及胞浆固缩、线粒体肿、自噬空泡形成进一步加重,见图1。

图1 小鼠胰腺组织电镜观察图(12000×)
2.4 ω-3PUFA对小鼠胰腺组织坏死、炎性浸润、腺泡细胞凋亡的影响
正常对照组小鼠胰腺组织结构完整,染色均匀。HE染色显示模型组及ω-3PUFA+740Y-P组胰腺小叶间呈弥漫性水肿,胰腺细胞坏死、间质出血及炎性浸润明显;TUNEL染色可见腺泡细胞棕黄颗粒物质沉积增多,组织病理学评分及细胞凋亡率升高(P<0.05)。ω-3PUFA组及3MA组小鼠胰腺细胞水肿、坏死、出血及炎性浸润缓解,组织病理学评分降低(P<0.05),细胞凋亡率进一步升高(P<0.05);740Y-P组胰腺组织病理学评分进一步升高(P<0.05),细胞凋亡率降低(P<0.05),与ω-3PUFA组相比,ω-3PUFA+740Y-P组胰腺组织病理学评分升高(P<0.05),细胞凋亡率降低(P<0.05),见表2和图2。

图2 各组小鼠胰腺组织HE及TUNEL染色图(200×)

表2 小鼠胰腺组织病理学评分及细胞凋亡率比较
2.5 ω-3PUFA对小鼠胰腺组织LC3B、PI3K阳性表达的影响
免疫荧光显示,正常对照组小鼠胰腺腺泡细胞胞浆中LC3B、PI3K呈弱阳性表达。与正常对照组相比,模型组小鼠胰腺组织LC3B、PI3K阳性表达升高(P<0.05)。与模型组相比,ω-3PUFA组及3MA组小鼠胰腺组织LC3B、PI3K阳性表达降低(P<0.05),740Y-P组小鼠胰腺组织LC3B、PI3K阳性表达进一步升高(P<0.05)。与ω-3PUFA组相比,ω-3PUFA+740Y-P组小鼠胰腺组织LC3B、PI3K阳性表达升高(P<0.05),见图3和表3。

表3 小鼠胰腺组织LC3B、PI3K阳性表达比较

图3 小鼠胰腺组织LC3B、PI3K免疫荧光染色图(200×)
2.6 ω-3PUFA对小鼠胰腺组织细胞p-NF-κB、Cleaved-caspase-3阳性表达的影响
免疫组化染色显示,p-NF-κB、Cleaved-caspase-3在小鼠胰腺组织细胞胞浆中呈弱阳性表达。与正常对照组相比,模型组小鼠p-NF-κB、Cleaved-caspase-3阳性表达升高(P<0.05)。与模型组相比,ω-3PUFA组及3MA组小鼠胰腺组织p-NF-κB阳性表达降低(P<0.05),Cleaved-caspase-3阳性表达升高(P<0.05);740Y-P组小鼠胰腺组织p-NF-κB阳性表达升高(P<0.05),Cleaved-caspase-3阳性表达降低(P<0.05)。与ω-3PUFA组相比,ω-3PUFA+740Y-P组小鼠胰腺组织p-NF-κB阳性表达升高(P<0.05),Cleaved-caspase-3阳性表达降低(P<0.05),图4,表4。
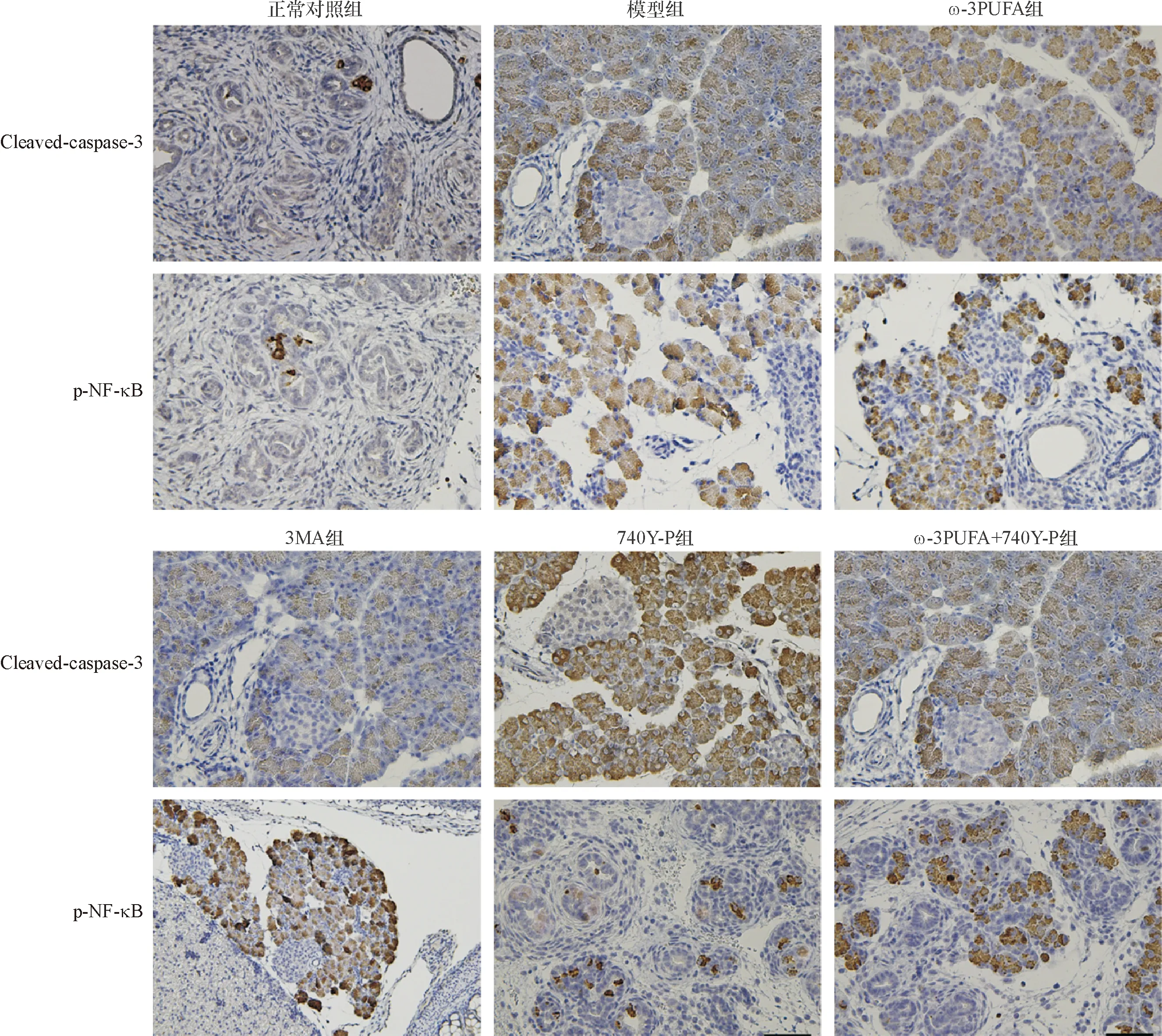
图4 小鼠胰腺组织p-NF-κB、Cleaved-caspase-3免疫组化图(200×)
表4 小鼠胰腺组织p-NF-κB、Cleaved-caspase-3阳性染色比较光密度)
2.7 ω-3PUFA对小鼠Akt、p-Akt、mTOR、p-mTOR、Beclin1、Bcl-2、Bax蛋白表达的影响
与正常对照组相比,模型组小鼠胰腺组织p-mTOR/mTOR
蛋白表达降低(P<0.05),p-Akt/Akt、Beclin1、Bax/Bcl-2表达升高(P<0.05)。与模型组相比,ω-3PUFA组及3MA组小鼠胰腺组织p-mTOR/mTOR、Bax/Bcl-2蛋白表达升高(P<0.05),p-Akt/Akt、Beclin1蛋白表达降低(P<0.05);740Y-P组小鼠胰腺组织p-mTOR/mTOR、Bax/Bcl-2表达降低(P<0.05),p-Akt/Akt、Beclin1表达升高(P<0.05)。与ω-3PUFA组相比,ω-3PUFA+740Y-P组小鼠胰腺组织p-mTOR/mTOR、Bax/Bcl-2表达降低(P<0.05),p-Akt/Akt、Beclin1表达升高(P<0.05),见图5和表5。

表5 各组小鼠肺组织p-Akt/Akt、p-mTOR/mTOR、Beclin1、Bax/Bcl-2蛋白表达比较
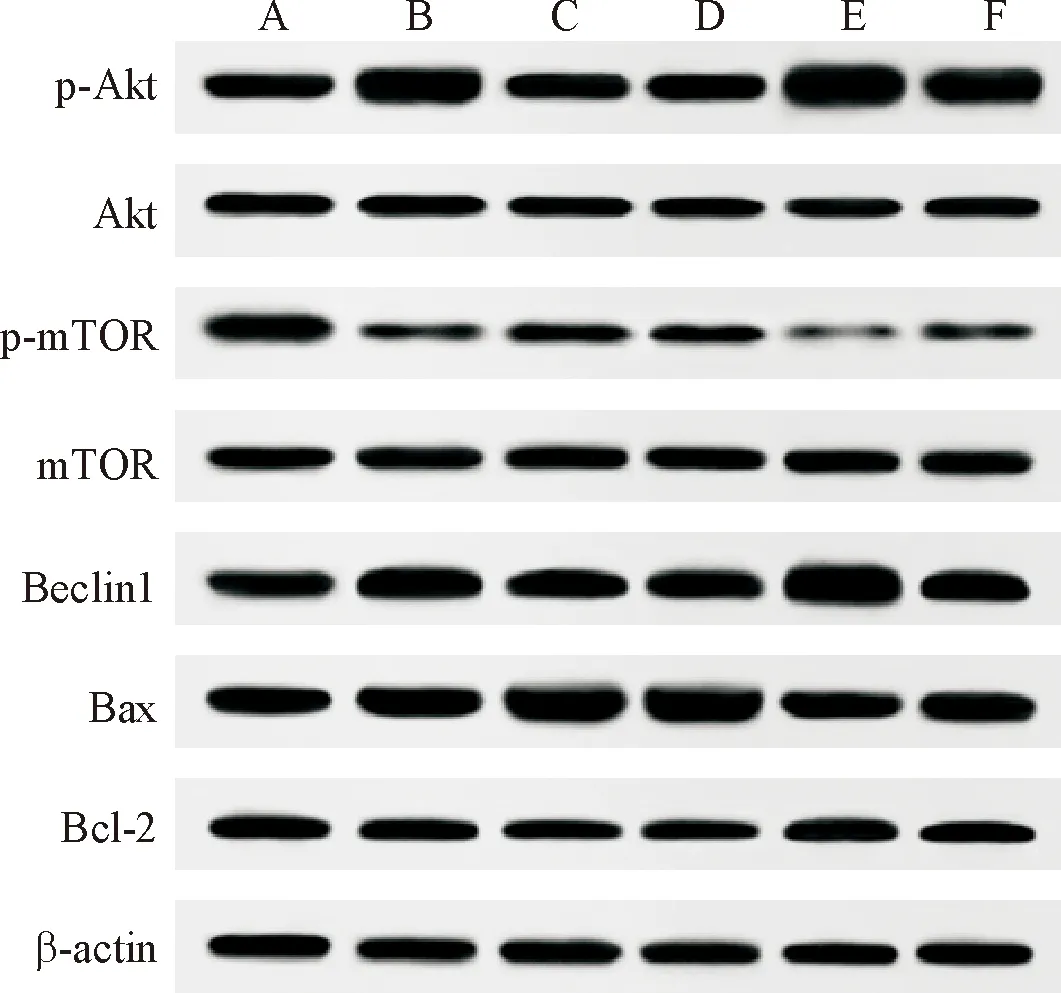
图5 各组小鼠肺组织中Akt、p-Akt、mTOR、p-mTOR、Beclin1、Bcl-2、Bax蛋白表达免疫印迹图 A:正常对照组;B:模型组;C:ω-3PUFA组;D:3MA组;E:740Y-P组;F:ω-3PUFA+740Y-P组
3 讨论
SAP病死率高达30%。高淀粉酶血症是SAP的主要诊断指标[14]。胰腺细胞结构损伤及炎症反应是SAP的主要病理特征[15]。本研究用雨蛙素诱导建立小鼠SAP模型后发现,小鼠死亡增加,血清淀粉酶、炎性因子-IL-1β、TNF-α水平分泌升高的同时,胰腺组织出现明显坏死、炎性浸润等病理损伤,提示造模成功。Wu等[5]认为胰腺炎相关性腹水中的有害物质如TNF-α、白介素及内毒素等,是引起胰腺组织坏死并加剧炎症反应的主要原因,用腹腔穿刺引流等方式降低炎症因子水平,是延迟或避免SAP多器官衰竭及死亡的重要方式。ω-3PUFA具有较好的抗炎作用。陆冰等[16]发现ω-3PUFA能够抑制NF-κB/TNF-α通路激活,降低α-淀粉酶在脑组织中积聚而缓解阿尔茨海默症神经炎性损伤。本研究发现ω-3PUFA干预治疗后,小鼠死亡只数减少,胰腺组织坏死及炎性浸润减轻,表现为血清淀粉酶、炎性因子水平的降低及p-NF-κB炎性活化通路蛋白在胰腺组织细胞中表达降低,提示ω-3PUFA可能通过降低炎性反应来缓解SAP小鼠死亡及胰腺炎性坏死症状。
细胞凋亡或坏死也是SAP主要病理症状。TNF-α和IL-1β等各种细胞因子及因素均可导致腺泡细胞死亡,而腺泡细胞坏死又可进一步促进胰腺组织中胰腺酶活化,并释放出更多炎症介质来加重SAP的病理进程[17]。但近来研究发现,腺泡细胞的凋亡反而会减少SAP患者胰腺酶的活化和释放,减缓SAP的病理进程[18]。Chen等[19]认为炎症可诱发组织坏死,而凋亡对腺泡细胞具有保护作用。本研究发现模型组小鼠胰腺组织中的腺泡细胞凋亡率升高,凋亡途径被激活,表现为凋亡标志蛋白Cleaved-caspase-3在腺泡中阳性表达升高,Bax/Bcl-2促凋亡表达升高,而ω-3PUFA干预组显示出促凋亡途径的进一步激活,提示ω-3PUFA也可能通过激活促凋亡途径,发挥腺泡细胞保护作用,而缓解SAP胰腺组织病理损伤,这与Kong等[18]及Chen[19]等研究报道相一致。
细胞自噬在维持细胞内稳态、炎症反应、细胞凋亡过程中发挥重要作用[20]。近来研究发现,SAP过程中胰腺腺泡细胞异常自噬现象也逐渐受到广泛关注[21]。Lee等[22]在SAP动物模型胰腺腺泡细胞中,发现双层膜结构的自噬空泡增多及高表达自噬标记物-LC3(现象,并认为SAP患者腺泡损伤可能与炎症刺激下的腺泡自噬异常有关。本研究也在模型组小鼠腺泡细胞中检测到大量双层膜结构的自噬空泡形成,且部分空泡内含有大量未消化的细胞内容物,另外腺泡胞浆中LC3B呈强阳性表达,证实自噬异常激活可能参与SAP病理过程。马立峰等[23]发现ω-3PUFA在骨关节疾病中发挥促细胞自噬作用;相反,Lee等[24]发现ω-3PUFA可抑制自噬缓解肌肉萎缩的病理进程,提示ω-3PUFA在细胞自噬过程中发挥正负反馈调节作用。本研究发现,ω-3PUFA组显示出抑制自噬空泡增加及降低LC3B表达作用,提示ω-3PUFA可通过阻断自噬发挥缓解SAP病理进程作用。
PI3K/Akt通路是调控细胞炎性反应、自噬、凋亡等生理过程的关键通路。近来研究发现PI3K/Akt通路在SAP腺泡凋亡坏死、炎性反应及自噬等过程,发挥重要调控作用。Jin等[25]发现,PI3K可调控NF-κB炎症通路激活,加重SAP中胰腺组织炎症坏死程度。Wu等[5]抑制PI3K激活后,可增加NF-κB下游促凋亡基因Bax表达,并显著降低SAP进展;罗晨等[21]发现抑制PI3K/Akt,可抑制NF-κB激活引起的腺泡细胞异常自噬,并促进细胞凋亡,且凋亡相关蛋白Bcl-2也可通过竞争性调节Beclin1,阻断自噬。PI3K/Akt下游调控因子mTOR可直接调控Bcl-2表达,竞争性调节BH3受体域作用,抑制Beclin1依赖的自噬形成来调控自噬及凋亡[26]。本研究发现,模型组小鼠腺泡胞浆中PI3K、p-Akt呈强阳性表达,且介导的自噬及炎症激活、凋亡增加,表现为p-mTOR/mTOR降低,Beclin1表达及p-NF-κB阳性表达升高,Bax/Bcl-2促凋亡升高。用3MA阻断PI3K表达及自噬后,小鼠表现出SAP胰腺组织炎症坏死减少,腺泡促凋亡保护途径进一步激活,炎症反应及自噬相关途径的抑制。相反,740Y-P激活PI3K表达后,小鼠死亡及胰腺组织炎症坏死加重,自噬及炎症激活,促凋亡保护途径减弱。ω-3PUFA组显示出与3MA相似的自噬及炎症抑制、凋亡增加及SAP病理症状的减缓,而740Y-P可逆转ω-3PUFA的上述作用,提示ω-3PUFA抑制SAP炎症及自噬异常反应,促进腺泡促凋亡保护途径激活及缓解SAP病理症状作用,可能与阻断PI3K/Akt途径激活有关。
综上所述,ω-3PUFA可通过抑制PI3K/Akt通路介导的炎症及自噬异常途径活化,促进腺泡促凋亡保护途径激活,来缓解SAP小鼠死亡及胰腺组织炎性坏死的进一步发展。可为ω-3PUFA在SAP领域的开发应用提供一定参考。但SAP自噬、炎症及凋亡等调控网络复杂且多样。ω-3PUFA缓解SAP病理症状的其它途径,还需进一步研究。
