哺乳动物核心岩藻糖基化研究进展
2021-03-20田银平易文
田银平,易文
(浙江大学生命科学学院生物化学研究所,杭州310058)
糖基化是细胞内普遍存在的一种翻译后修饰,它能够参与多种生理病理过程的调控[1]。糖基化修饰以单糖(如O-乙酰葡糖胺)[2]或者糖聚合物的形式连接到脂类或蛋白质上而形成。哺乳动物细胞内参与糖基化修饰的单糖一般有10种。其中,岩藻糖是一种特殊的单糖,细胞内天然的岩藻糖是一种6位脱氧、L构型的6碳糖,其他天然单糖是D构型。糖基化可以根据糖配基(aglycone)的不同进行分类,例如N-聚糖(N-glycans)和O-聚糖(O-glycans)(图1)。核心岩藻糖基化是岩藻糖以α1,6键的形式与N-聚糖最里面的N-乙酰葡萄糖胺(N-acetylglucosamine,GlcNAc)连接的一种修饰(如图1虚线框所示)。本文主要介绍哺乳动物细胞内的核心岩藻糖基化及其相关的生物学功能。

图1 哺乳动物细胞中的糖基化修饰Fig.1 Glycosylation in mammalian cells
1 岩藻糖基化供体与核心岩藻糖基转移酶
所有的岩藻糖基转移酶均利用核苷酸活化的糖供体鸟苷二磷酸(guanosine diphosphate, GDP)岩藻糖进行岩藻糖基化。目前研究发现,哺乳动物细胞中的GDP 岩藻糖有2 条合成途径:从头合成(de novo)途径和补救(salvage)途径。如图2 所示:从头合成途径是以D-葡萄糖为原料经过多步酶催化反应得到GDP 甘露糖;然后,GDP 甘露糖经过3步反应转化为GDP岩藻糖,这一过程在2个酶催化下完成,即GDP 甘露糖4,6 脱氢酶(GDP-mannose 4,6-dehydrogenase, GMD)和异构化还原酶(GDPketo-6-deoxymannose-3, 5-epimerase-4-reductase, FX蛋白)[3]。补救途径以细胞外或溶酶体代谢的岩藻糖为原料合成GDP岩藻糖,岩藻糖激酶催化岩藻糖转化为1-磷酸岩藻糖[4];然后,GDP岩藻糖焦磷酸酶(GDP-fucose pyrophosphatase, GFPP)将1-磷酸岩藻糖转化为GDP 岩藻糖[5];GDP 岩藻糖在细胞质内合成,然后通过转运蛋白进入高尔基体并作为岩藻糖基转移酶的底物对目标分子进行糖基化修饰[6]。已有的研究认为,正常情况下细胞内GDP岩藻糖的合成主要来源于从头合成途径[7],而补救途径会在一些病理条件下发挥作用[8]。
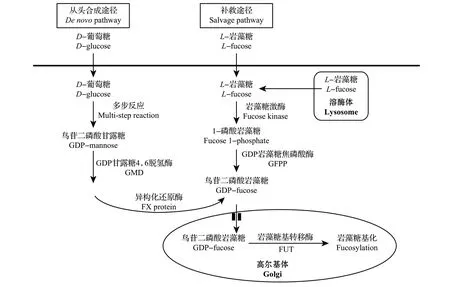
图2 哺乳动物细胞内GDP岩藻糖的生物合成途径Fig.2 Biosynthesis pathway of GDP-fucose in mammalian cells
研究认为,核心岩藻糖基化只发生在N-聚糖上,并且只有一种糖基转移酶——岩藻糖基转移酶8(fucosyltransferase 8, FUT8)能催化这一过程[9]。人体内的N-聚糖具有一个公共的核心五糖结构(Man3GlcNAc2)。如图3A 所示:依据修饰核心五糖分支结构的不同,N-聚糖可以分为3 种类型,即复杂型(complex type)、高甘露糖型(high mannose type)和混合型(hybrid type);此外,N-乙酰葡萄糖胺基转移酶Ⅲ(N-acetylglucosamine transferase Ⅲ,GnTⅢ)可以在核心五糖的第一个甘露糖的4 位加上一个β键连接的N-乙酰葡萄糖胺,这种结构被叫作平分型N-聚糖(bisecting N-glycan)。FUT8 能够以GDP岩藻糖为底物催化岩藻糖通过α1,6键与N-聚糖核心五糖结构的第一个GlcNAc 连接(图3B)。FUT8属于岩藻糖基转移酶家族(EC 2.4.1.68),人的FUT8 基因位于14 号染色体上,人源FUT8 蛋白有575 个氨基酸。2016 年,CALDERON 等[10]对FUT8的受体底物特异性进行研究发现,当N-聚糖没有连接多肽或者蛋白质时,FUT8需要N-聚糖α1,3臂上具有的GlcNAc 修饰才能催化核心岩藻糖形成,而其对N-聚糖α1,6臂上的修饰有很高的容忍度。然而,也有报道称,缺失GnT1(N-聚糖α1,3 臂上无GlcNAc 修饰)的哺乳动物细胞也有核心岩藻糖修饰[11]。例如,缺失GnT1 的中国仓鼠卵巢细胞(Chinese hamster ovary cell,CHO)有核心岩藻糖基化的高甘露糖型N-聚糖[12]。这些研究结果与CALDERON 等[10]报道的FUT8 体外底物活性数据有冲突;而2017年,YANG等[13]研究发现,当N-聚糖的第一个GlcNAc 与多肽或者蛋白质连接时,FUT8能识别高甘露糖型N-聚糖并催化其核心岩藻糖基化。此外,TSENG等[14]发现,FUT8无法识别平分型N-聚糖。这些结果说明,N-聚糖与N-聚糖修饰的蛋白质共同决定了FUT8的底物特异性。
2007 年,IHARA 等[15]首次解析了FUT8 的晶体结构。他们利用杆状病毒感染昆虫细胞Sf21,并表达重组人源FUT8 蛋白,对其单体结构解析发现,FUT8 有3 个结构域:N-端螺旋-螺旋结构域、催化结构域和C-端SH3结构域[在蛋白质三维结构数据库(protein data bank, PDB)编号为2DE0]。2020年,GARCIA-GARCIA 等[16]解析了FUT8、GDP 和复杂型N-聚糖三组分晶体的结构(PDB 编号为6TKV),阐述了FUT8 的潜在催化机制及其底物特异性:根据结构分析认为,FUT8通过双分子亲核取代反应(SN2)原理催化核心岩藻糖修饰;氨基酸残基Arg365、Lys369 和Glu373 不仅参与底物的结合,还参与催化过程,其中Glu373发挥辅助催化碱基的作用;此外,N-聚糖α1,3臂上的GlcNAc可以与FUT8的氨基酸残基(Asp494、Asp495 和His535)形成3 个氢键作用。这解释了α1,3 臂上的GlcNAc 修饰对FUT8催化活性的重要性[10]。而N-聚糖核心五糖第一个甘露糖的4 位羟基与FUT8 蛋白上的氨基酸残基距离小于5 Å,平分型N-聚糖在甘露糖的4 位羟基上有一个GlcNAc修饰,该GlcNAc修饰会破坏受体与蛋白的相互作用。这可能是FUT8无法识别平分型N-聚糖的原因[14],但作者从目前的结构中无法解释FUT8 对高甘露糖型N-聚糖具有催化活性的原因。

图3 人细胞内代表性N-聚糖Fig.3 Representative N-glycans in human cells
2 核心岩藻糖基化的生物学功能
2.1 肿瘤与肿瘤生物标志物
据报道,与正常组织相比,肿瘤组织的核心岩藻糖水平升高[17-18]。而且,许多核心岩藻糖修饰的糖蛋白可以作为肿瘤的重要生物标志物[19]。例如,甲胎蛋白(alpha fetoprotein, AFP)是肝细胞癌(hepatocellular carcinoma, HCC)的重要生物标志物,而其在一些良性肝病中表达量也会升高,但是,AFP的核心岩藻糖修饰只在肝细胞癌中升高[20]。因此,核心岩藻糖修饰的AFP是更可靠的肝细胞癌生物标志物[21]。2005年,甲胎蛋白异质体(AFP-L3)被美国食品与药品监督管理局(Food and Drug Administration, FDA)批准为肝细胞癌的肿瘤标志物[22]。然而,肝细胞癌岩藻糖修饰上调的机制并不清楚。NORTON等[23]对371个肝癌病人样本与核心岩藻糖修饰相关的基因进行了研究,并推测,调控GDP岩藻糖从头合成的基因(GMDS和TSTA3)表达上调可能是肝癌中核心岩藻糖升高的原因之一。
前列腺特异性抗原(prostate specific antigen,PSA)是一种公认的前列腺疾病生物标志物[24]。与良性前列腺增生(benign prostatic hyperplasia,BPH)患者相比,前列腺癌患者的核心岩藻糖基化PSA的比例明显升高,这表明核心岩藻糖修饰在前列腺癌诊断中具有应用价值。而且,血清蛋白核心岩藻糖修饰的增加也与前列腺癌转移风险的增加有关[25]。核心岩藻糖基化触珠蛋白(haptoglobin)是胰腺癌检测的潜在生物标志物。MIYOSHI 等[26]利用橙黄网孢盘菌凝集素(Aleuria aurantia lectin,AAL)检测胰腺癌病人血清时发现,血清中触珠蛋白β 链发生了岩藻糖修饰,且岩藻糖修饰程度与癌症进程有关。AGRAWAL等[27]对黑色素瘤临床样本进行糖组学系统分析发现,核心岩藻糖基化与促病灶转移相关,转移性黑色素瘤FUT8 的表达水平比原发性肿瘤高。这种现象可能与核心岩藻糖基化的L1 细胞黏附分子(L1 cell adhesion molecule, L1CAM)有关。L1CAM的核心岩藻糖修饰能够抑制纤溶酶引起的裂解作用,促进L1CAM与远端器官、血管系统的相互作用,进而促使病灶转移。
此外,研究表明,钙黏蛋白(E-cadherin)[28]和整合素[29]的核心岩藻糖修饰增加会减少细胞黏附作用,促进癌细胞的转移。CHEN等[30]发现:FUT8在非小细胞肺癌(nonsmall cell lung cancer,NSCLC)中的表达量增加;而且,FUT8 表达上调与肿瘤转移、疾病复发和预后差等情况相关。OSUMI 等[31]发现:FUT8和钙黏蛋白在结肠癌病人样本中表达水平增加;在高密度培养条件下,过表达FUT8的人结肠癌细胞WiDr 可上调低分子质量钙黏蛋白的表达,进而增强细胞间的黏附作用。因此,上述研究认为,核心岩藻糖基化对肿瘤细胞间黏附有调控作用。
2.2 免疫系统
核心岩藻糖基化对免疫系统调节也有重要作用[32]。免疫球蛋白G(immunoglobulin G, IgG)与自然杀伤细胞和巨噬细胞表面的受体FcγRIIIa 和CD16结合从而诱导免疫反应,抗体Fc区N-聚糖发生核心岩藻糖基化后,抗体与受体的亲和力降低了98%~99%。因此,去除抗体的核心岩藻糖能够明显提高依赖抗体的细胞毒性(antibody-dependent cellular cytotoxicity, ADCC)[33]。FERRARA 等[34]对糖基化Fcγ受体与抗体Fc区的结晶结构进行解析发现,受体上的聚糖修饰与抗体Fc区无岩藻糖修饰的聚糖发生了特异性的碳水化合物-碳水化合物相互作用,而抗体岩藻糖修饰会破坏这种相互作用。这一发现对研究临床治疗性抗体非常重要[35]。目前,2种无岩藻糖修饰的单克隆抗体已被FDA 批准用于癌 症 治 疗——mogamulizumab 和obinutuzumab。mogamulizumab[36]靶向趋化因子受体4,这是一种重要的信号转换器,它在T 细胞白血病和淋巴瘤中表达上调;obinutuzumab 靶向B 细胞发育过程中的一个抗原CD20,它对治疗慢性淋巴细胞白血病(chronic lymphocytic leukemia, CLL)很有效[37]。然而,岩藻糖缺失可增加抗原-抗体相互作用的特性,在某些情况下可能会对人体有害。例如,新生儿同种免疫性血小板减少症(neonatal alloimmune thrombocytopenia,NAIT)是引起新生儿死亡的重要疾病之一[38]。它是由母体针对父系遗传给胎儿的人血小板特异性抗原1a(human platelet antigen 1a,HPA1a)而产生的抗体引起的。研究者对出生后患有NAIT胎儿的48名产妇的血样进行IgG相关聚糖修饰分析发现,其血样中核心岩藻糖基化水平显著下降,在某些情况下,岩藻糖基化抗体仅为抗体总量的10%[39]。还有研究表明,无岩藻糖基化抗体比例高的登革热感染者更容易患上严重的溶血性疾病[40]。
在小鼠中,敲除Fut8 会导致严重的生长迟缓、发育中过早死亡以及肺气肿样的肺部病变等表型。研究表明:小鼠生长迟缓可能与Fut8缺失导致的表皮生长因子(epidermal growth factor,EGF)[41]或血小板衍生生长因子(platelet derived growth factor,PDGF)受体介导的信号通路下调有关[42];转化生长因子β1(transforming growth factor-β1,TGF-β1)的核心岩藻糖基化水平降低与肺部病变有关[43]。此外,抑制TGF-β1 的核心岩藻糖基化可减轻葡萄糖诱导的大鼠腹膜纤维化[44]。这些研究表明,核心岩藻糖基化对生长因子受体信号转导至关重要。
虽然核心岩藻糖基化调控许多生物过程,但哺乳动物核心岩藻糖的识别分子却鲜有报道。Dectin-1 是一种C 型凝集素型受体[45],它能识别β-葡聚糖进而防止真菌感染。MANABE 等[46]研究发现,IgG 抗体上的核心岩藻糖是Dectin-1 的一种内源性配体,Dectin-1 可以识别IgG 的核心岩藻糖以及N-聚糖修饰天冬酰胺的相邻芳香氨基酸。因此,Dectin-1 可能是第一个参与抗体与N-聚糖多价特异性识别的类凝集素分子。
2.3 干细胞
核心岩藻糖基化与干细胞的研究也有报道[47]。人胚胎干细胞(human embryonic stem cells,hESCs)在未分化状态下可不断增殖(自我更新),并具有最终分化为所有细胞类型的能力(多能性)。人诱导多能干细胞是具有多能性的重编程体细胞。与干细胞多能性相关的N-聚糖修饰已有一些报道。例如,人胚胎干细胞表达高比例的高甘露糖型[48]和双线复杂型N-聚糖核心结构。其中,双线复杂型N-聚糖分支主要为Ⅱ型N-乙酰乳糖胺(LacNAc、Galβ1 和4GlcNAc)修饰,末端为α2,6 和α2,3 连接的唾液酸[49]。此外,人胚胎干细胞N-聚糖修饰的另一个特点是具有非常复杂的岩藻糖基化修饰。SATOMAA等[50]利用核磁共振技术对人胚胎干细胞的岩藻糖修饰进行研究发现,人胚胎干细胞岩藻糖基化信号丰度最高的是α1,6 连接的核心岩藻糖基化。TATENO等[51]利用凝集素探针研究转录因子诱导体细胞重编程过程中细胞糖基化修饰的变化时发现,在诱导体细胞多功能化过程中,末端α1,2岩藻糖基化信号升高,而核心岩藻糖基化信号下降。由于干细胞N-聚糖修饰具有异质性和复杂性,因此,核心岩藻糖基化与干细胞多能性的关系还有待进一步研究。
3 岩藻糖类似物
化学修饰的岩藻糖类似物是研究岩藻糖基化和岩藻糖基转移酶的有效工具分子(图4)。早在1992年就有文献报道岩藻糖基转移酶能够识别6位大体积修饰的GDP 岩藻糖类似物[52]。利用酶的底物多样性,6-叠氮岩藻糖可以进入细胞代谢途径,进而标记岩藻糖基化的生物分子。然后,研究者们利用生物正交的点击反应[53]富集或检测这些岩藻糖基化生物分子。岩藻糖类似物代谢策略可以实现模式生物中岩藻糖基化的体内成像,例如线虫[54]和斑马鱼[55],这一策略也可以实现岩藻糖基化蛋白的体外富集或细胞荧光检测[56-57]。此外,YI 等[58]研究发现,工程化大肠埃希菌细胞可以通过补救途径利用岩藻糖类似物合成多糖。前文介绍到IgG有核心岩藻糖基化。OKELEY等[59]对200个岩藻糖类似物的代谢效率进行筛选发现,6-巯基岩藻糖在CHO细胞内能够高效标记到抗体上,这种非天然硫代抗体与马来酰亚胺修饰药物偶联得到的抗体偶联药物具有明显的细胞毒活性,且比单抗具有更好的同质性。
2016 年,KIZUKA 等[60]发现,7-炔烃岩藻糖能更高效地标记岩藻糖基化,且主要标记的是核心岩藻糖基化。2017 年,他们又报道了6-炔烃岩藻糖,一个已知的岩藻糖代谢标志物,会抑制细胞岩藻糖基化[61];其中,6-炔烃岩藻糖细胞代谢物——鸟苷二磷酸-6-炔烃岩藻糖能够抑制岩藻糖从头合成途径中FX 蛋白的酶活性,进而抑制肝癌细胞的迁移和侵袭。所以,除了能标记岩藻糖基化外,岩藻糖类似物还有可能是岩藻糖代谢途径或岩藻糖基转移酶的潜在抑制剂。研究发现,氟代核苷酸化岩藻糖对岩藻糖基转移酶有抑制活性[62]。用2-氟代岩藻糖喂食小鼠发现,小鼠体内抗体、移植肿瘤和中性粒细胞的岩藻糖基化水平下降,肿瘤细胞生长受到抑制;用高浓度2-氟代岩藻糖培养CHO 细胞发现,核心岩藻糖基化明显减少[63]。6-氟代岩藻糖对细胞岩藻糖基化也有抑制作用[64]。6-三氟代甲基岩藻糖能抑制细胞重组表达抗体的岩藻糖基化水平,且能抑制岩藻糖从头合成途径中GMD 的酶活性;晶体结构显示,6-三氟代甲基岩藻糖能够与GMD的变构位点结合[65]。

图4 岩藻糖类似物Fig.4 Fucose analogue
4 小结与展望
综上所述,FUT8 是目前研究发现的唯一核心岩藻糖基转移酶。FUT8的受体及配体底物特异性已被报道,三元晶体结构解析了FUT8 的潜在催化机制及底物偏好性。哺乳动物细胞内α1,6 核心岩藻糖基化的生物学功能也已被广泛研究。核心岩藻糖基化在免疫应答中起重要作用,如抗体细胞毒活性和器官病变。此外,核心岩藻糖基化也在癌细胞的发生、发展、复发、侵袭和转移中发挥作用。而核心岩藻糖基化蛋白可以作为重要的肿瘤标志物用于癌症的早期检测及分型。岩藻糖类似物除了能标记岩藻糖基化以外,还能抑制细胞岩藻糖基化水平。而且,岩藻糖类似物抑制剂对癌细胞和小鼠移植肿瘤的生长有抑制作用。
近年来,液相色谱-串联质谱联用技术已成为糖蛋白鉴定的有力手段[66]。串联质谱技术与机器学习相结合可以自动预测N-糖基化位点及其连接的糖基组成[67]。对某种糖蛋白特异性富集纯化后进行质谱分析,可以显著提高检测灵敏度,简化数据分析工作。糖基化修饰免疫原性低,很难用抗体识别和纯化。凝集素可以用于岩藻糖基化蛋白的识别和纯化,其中橙黄网孢盘菌凝集素(AAL)和扁豆凝集素(Lens culinaris agglutinin,LCA)主要识别核心岩藻糖基化[17],但凝集素识别效率不高且信号易丢失,不利于糖蛋白的富集纯化。而岩藻糖类似物代谢标记具有广谱性,对糖链结构没有选择性。化学-酶标记法具有高特异性和高灵敏性等特点。目前,特异性标记核心岩藻糖的化学-酶标记法还没有报道,化学-酶标记法使用的酶需要对糖链结构的识别具有严谨性,保证糖结构标记的特异性。同时,酶还需要能够识别非天然糖供体,例如叠氮或炔烃等基团修饰的糖供体,然后通过化学反应与标签连接,在进行结合/下拉(binding/pulldown)实验时富集糖蛋白。目前,本实验室正在进行此方向的探索和研究。
核心岩藻糖发生在N-聚糖上,N-聚糖具有复杂的糖链结构,酶底物选择性的筛选需要使用糖芯片技术,而单一结构的N-聚糖库是建立糖芯片的基础。近几十年来,关于N-聚糖的各种合成方法已被报道[68]。其中,化学合成多糖是最可靠的方法之一,但是这种方法特别耗时,尤其不利于N-聚糖这类复杂糖链结构的合成。而化学-酶合成法的发展为合成多样化的N- 聚糖库提供了新的途径。CALDERON等[69]利用一系列糖苷酶和糖基转移酶,以天然来源的N-聚糖为原料合成一系列不对称分支的N-聚糖。自动合成N-聚糖又是化学-酶合成法的新发展,也被称为固相合成。2015 年,首个商业化的聚糖合成仪问世,即Glyconeer 2.1,它以聚苯乙烯为固相[70]。ZHANG 等[71]报道了一种全自动的水溶液酶法合成低聚糖系统,该系统利用热敏材料作为固相。LI 等[72]报道,人工高尔基细胞器可以用来自动合成N-聚糖。未来,多糖自动合成会进一步发展,就像多肽自动合成和DNA聚合酶链式反应一样。此外,内源核心岩藻糖基化N-聚糖具有高度异质性。这妨碍了我们对其结构和功能关系的深入理解,并阻碍了其在治疗和诊断中的应用。化学-酶合成法可以得到均质的糖蛋白[73],为深入研究其功能提供了可能。此外,多糖芯片还可以实现潜在致病抗原疫苗的快速筛选,为其相关疾病防治提供新的策略。
