白杨素Mannich衍生物的合成及其抗IgE介导Ⅰ型过敏反应活性研究
2021-03-19杨美林仲崇琳
徐 军,杨美林,仲崇琳
(吉林省中医药科学院·吉林 长春 130012)
白杨素(chrysin)化学名称为5,7-二羟基黄酮(结构见图1),是一种在自然界中常见的黄酮类化合物,以蜂蜜和蜂胶中含量较高。白杨素具有抗菌、抗敏、抗炎、抗氧化等广泛的药理活性[3],在临床上的应用以抗炎和抗癌活性居多,但由于其水溶性和脂溶性较差,很少在肠道内吸收,且其5、7位羟基易被糖基化而使之活性降低[4],从而限制了其在临床上的应用。近年来对白杨素的结构修饰主要集中在A环的C-6位和C-8位上,且8位的亲核活性高于6位,理论上,C-8位更易发生取代或成环反应[5-6]。Mannich碱类化合物具有抗癌、降血压、抗炎等多种生物学活性[7]。向同一分子引入不同活性基团可能会改变其生物活性[5]。因此,本文设想向白杨素C-8位引入Mannich碱基团,合成多个白杨素Mannich碱衍生物,并测定其抗敏活性。

图1 白杨素的化学结构
本实验以天然产物白杨素为起始原料,在甲醛和二甲基甲酰胺溶液条件下,与多种胺类发生Mannich反应[8-9],得到目标化合物1a~1d,合成路线如图2所示。

图2 目标化合物的合成路线
1 实验材料
1.1 实验动物 6周龄雄性Wistar大鼠130只,体质量 170~185 g,购于辽宁长生生物技术股份有限公司,合格证号:SCXK-(辽)2015-0001。
1.2 实验药物与试剂 孟鲁司特钠片:购自于杭州默沙东制药有限公司,批号:M04924;白杨素:上海优纯生物科技有限公司,批号:180724。卵白蛋白(OVA):北京鼎国昌盛分装,批号:080M1705V;瑞氏-姬姆萨染色液:珠海贝索生物技术有限公司,批号:417031;ELISA检测试剂盒(批号:20160401)、免疫球蛋白(IgE)、大鼠白三烯(LT)、组胺(His):加拿大Biowen生物公司;所有合成相关试剂均为分析纯级别。
1.3 主要实验仪器 X-4数字显示熔点仪:北京天地宇科技有限公司;Bruker Avance-400核磁共振仪:瑞士Bruker公司,以TMS为内标;Quattro Premier XE高效液相色谱-质谱联用仪:美国Waters公司;柱层析和薄层层析硅胶:青岛海洋化工厂;680型全自动酶标仪:美国BIO-RAD公司;显微镜:日本奥林巴斯公司。
2 实验方法
2.1 目标化合物1a~1d的合成通法 将磁力搅拌子放入微波反应专用瓶,向其中加入2.54 g(10 mmol)白杨素、加入二甲基甲酰胺50 mL使其溶解,分别加入不同体积的哌嗪反应物1.71 mL(15 mmol),再加入37%甲醛溶液(质量分数)1.23 mL(15 mmol),混合均匀。微波反应条件为300 W、45 ℃、1 h,得反应液;将反应液冷却至室温,加50 mL水和100 mL乙酸乙酯提取,无水硫酸钠脱水,乙酸乙酯液减压蒸干,残渣加入丙酮热溶,室温放置,沉淀物用丙酮重结晶得化合物1a-1d。
8-(4-甲基哌嗪-1-甲基)-5,7-二羟基-2-苯基-4H-1-苯并吡喃-4-酮(1a):浅黄色结晶,产率:55.87%,m.p.161~163;1H-NMR (CD3Cl, 300 MHz):δ2.33 (s, 3H, -CH3), 2.71 (s, 8H, piperazine-H), 4.01 (s, 2H, -N-CH2-Ar), 6.28 (d, 1H,J=3.3 Hz, -CO-CH=), 6.63 (d, 1H,J=3.3 Hz, Ar-H), 7.53-7.58 (m, 3H, Ar-H), 7.81-7.83 (m, 2H, Ar-H), 12.18 (s, 1H, -OH), 12.71 (s, 1H, -OH).13C-NMR (CD3Cl, 75 MHz):δ45.84, 52.64, 53.69, 54.74, 98.43, 100.02, 100.17, 104.65, 105.73, 126.05, 129.17, 131.51, 131.77, 154.69, 161.56,063.04, 182.29.ESI-MS ([M+H]+): 367。
8-(4-乙基哌嗪-1-甲基)-5,7-二羟基-2-苯基-4H-1-苯并吡喃-4-酮(1b):浅黄色结晶,产率:70.12%,m.p.161~163;1H-NMR (CD3Cl, 300 MHz):δ1.10 (t, 3H,J=5.4 Hz, -CH3), 2.46 (q, 2H,J=5.4 Hz, -CH2CH3), 2.74 (s, 8H, piperazine-H), 4.01 (s, 2H, -N-CH2-Ar), 6.29 (s, 1H, -CO-CH=), 6.63 (s, 1H, Ar-H), 7.51-7.56 (m, 3H, Ar-H), 7.81-7.83 (m, 2H, Ar-H), 11.90 (s, 1H, -OH), 12.71 (s, 1H, -OH).13C-NMR (CD3Cl, 75 MHz):δ12.05, 52.06, 52.42, 52.73, 53.76, 98.48, 99.99, 100.20, 104.69, 105.76, 126.05, 129.18, 131.55, 131.78, 154.70, 161.60, 163.04, 165.71, 182.34.ESI-MS ([M+H]+): 381。
8-(4-异丙基哌嗪-1-甲基)-5,7-二羟基-2-苯基-4H-1-苯并吡喃-4-酮(1c):黄色结晶,产率:69.41% ;m.p.163~165;yield %.1H-NMR (CD3Cl, 300 MHz): δ 1.05 (s, 3H, -CH3), 1.07 (s, 3H, -CH3), 2.65-2.75 (s, 8H, piperazine-H), 3.99 (s, 2H, -N-CH2-Ar), 6.26 (s, 1H, -CO-CH=), 6.60 (s, 1H, Ar-H), 7.52-7.54 (m, 3H, Ar-H), 7.79-7.82 (m, 2H, Ar-H), 12.63 (s, 2H, -OH).13C-NMR (CD3Cl, 75 MHz): δ 18.53, 48.29, 53.06, 53.77, 54.34, 98.52, 100.00, 100.16, 104.65, 105.71, 126.03, 129.16, 131.53, 131.76, 154.67, 161.57, 163.00, 165.77, 182.32.ESI-MS ([M+H]+): 395。
8-(4-叔丁基哌嗪-1-甲基)-5,7-二羟基-2-苯基-4H-1-苯并吡喃-4-酮(1d):黄色结晶,产率:55.01%,m.p.164~166;1H-NMR (CD3Cl, 300 MHz): δ 1.09 (s, 9H, -C(CH3)), 2.73 (s, 8H, piperazine-H), 4.00 (s, 2H, -N-CH2-Ar), 6.29 (s, 1H, -CO-CH=), 6.63 (s, 1H, Ar-H), 7.52-7.56 (m, 3H, Ar-H), 7.80-7.83 (m, 2H, Ar-H), 11.56 (s, 1H, -OH), 12.70 (s, 1H, -OH).13C-NMR (CD3Cl, 75 MHz): δ 25.93, 45.55, 53.43, 53.73, 98.54, 100.00, 100.22, 104.71, 105.78, 126.06, 129.18, 131.59, 131.78, 154.72, 161.64, 163.02, 165.82, 182.41.ESI-MS ([M+H]+): 409。
2.2 大鼠体内抗敏活性测试
2.2.1 建模与给药[10-13]将130只大鼠随机分为13组(正常对照组、模型对照组、孟鲁司特组、白杨素及白杨素衍生物1a~1d高、低剂量组),分别于第0天和第14天给予大鼠一次性腹腔注射含1 mg OVA和10 mg Al(OH)3的生理盐水1 mL;第15天,开始采用1% OVA生理盐水雾化吸入激发哮喘,每天1次,20 min/次,连续7 d,复制过敏性哮喘大鼠模型。正常对照组注射等体积生理盐水。给予OVA雾化后10 min内出现喘促、咳嗽等呼吸道痉挛梗阻症状即表示造模成功。各组于致敏前1 h至末次诱导哮喘前1 h每天灌胃给药1次,正常对照组及模型对照组给予等体积5% Tween-80水溶液。
2.2.2 观察指标及测定
2.2.2.1 外周血IgE和LT、His检测 大鼠末次雾化激发后24 h,腹腔注射300 mg·kg-1水合氯醛进行麻醉,腹主动脉采血,3 000 r/min离心10 min取上清,各组随机选取8个样本,按ELISA试剂盒说明书操作,采用全自动酶标仪测定450 nm的吸光度值,通过标准曲线计算全血IgE、His、LT含量。
2.2.2.2 全血EOS计数[14]制作全血涂片,采用瑞氏-姬姆萨染色法,镜下对白细胞进行分类计数,计数200个白细胞中嗜酸性粒细胞所占百分数,按下列公式计算:嗜酸性粒细胞数量(EOS计数)=全血白细胞数×嗜酸性粒细胞%。
2.2.2.3 BALF中EOS计数[15]大鼠腹主动脉采血后处死,消毒后打开胸腔,左侧肺支气管插管,缓慢注入D-Hanks液5 mL,停留10 s,缓慢抽回,重复3次,合并回收液约4 mL,注入消毒试管,1 500 r/min离心15 min后取少量白细胞沉淀制作涂片,按全血方法进行白细胞分类计数,剩余沉淀用4 mL生理盐水稀释,镜下进行白细胞计数,按全血方法计算嗜酸性粒细胞数量。
2.2.2.4 肺组织病理观察 大鼠采血后处死,取其右下肺组织(未经灌洗)甲醛固定,苏木精-伊红染色法进行染色,镜下观察肺组织病理学改变。
3 结果
3.1 对过敏性哮喘大鼠血清IgE、LT、His含量的影响 模型对照组大鼠血清IgE、LT、His含量与正常对照组大鼠相比明显增高,其它不同组分灌胃给药的大鼠同模型组相比,有不同程度降低,其中白杨素衍生物1a~1d作用均优于白杨素,结果见表1。
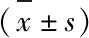
表1 各组大鼠血清IgE、LT、His含量比较
3.2 对过敏性哮喘大鼠全血、BALF中EOS计数的影响 模型对照组大鼠全血和BALF中嗜酸性粒细胞数与正常对照组大鼠相比明显增高;与模型对照组相比,白杨素衍生物1a、1b、1d可明显减少全血及BALF中嗜酸性粒细胞数量,而1c作用不明显,结果见表2。
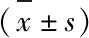
表2 各组大鼠全血、BALF中EOS计数比较
3.3 对过敏性哮喘大鼠肺组织病理形态的影响 正常对照组大鼠肺组织结构正常,肺泡壁薄,肺泡腔透亮,未见炎性细胞浸润,且肺泡支气管黏膜上皮结构完整清晰。模型对照组可见炎性细胞的肺泡、肺泡囊、肺泡管显著变小,肺间质增生显著,肺泡支气管黏膜上皮细胞排列紊乱,成片脱落。白杨素衍生物1a~1d和白杨素组,与模型组相比肺泡壁有不同程度炎症细胞浸润,少量肺泡扩张,中小支气管内渗出物,黏膜上皮脱落及炎症细胞浸润减轻,整体上炎症面积明显减小。
4 讨论
IgE在过敏性哮喘的炎症反应中发挥着重要作用,当过敏原首次进入体内时,通过树突细胞(dendritic cell)的呈递从而引发一系列炎症级联反应:Th2细胞诱导B细胞产生大量IgE抗体及炎症因子(如IL-4、IL-9等),IgE抗体与肥大细胞和嗜碱性粒细胞表面的IgE高亲和力受体结合形成复合物。当过敏原再次进入机体时,即可迅速与上述复合物结合,导致His、LT、前列腺素等炎症介质大量释放,引起黏液的分泌、气道平滑肌收缩、血管通透性增高等反应。特异性的IgE分子还可以与树突状细胞结合,加强其抗原呈递作用,上调肥大细胞、嗜碱性粒细胞表面的IgE高亲和力受体的表达[16-17]。此外,过敏性哮喘的特征性指标之一表现为嗜酸性粒细胞增多,且许多研究表明哮喘的严重性与气道嗜酸性粒细胞浸润相关。LT在上下呼吸道的炎症中起重要作用,在诱导鼻过敏性反应方面,其强度比His强1 000多倍。在变态原诱导的鼻过敏反应中,在速发型或迟发型超敏反应阶段,LT的数量均明显增加。哮喘患者粒细胞释放LT的数量要高于正常人,所以说LT是引起过敏性哮喘的关键物质。
本实验通过向白杨素的C-8位引入Mannich碱基团,合成4个结构新颖的白杨素衍生物,提高了部分生物活性。再以Al(OH)3和OVA和为抗原,致敏和激发大鼠过敏性哮喘模型,通过测定特异性IgE、全血及BALF中嗜酸性粒细胞数量以及白三烯变化情况,对白杨素及4种白杨素衍生物的抗过敏性哮喘活性进行筛选。结果表明,模型组大鼠的血清IgE、白三烯含量明显增高,全血及BALF中白细胞及嗜酸性粒细胞数量明显增高,肺组织病理切片显示肺组织炎性细胞浸润及炎症面积明显增加。而通过一定剂量的白杨素及其衍生物给药治疗后,上述指标表现出不同程度的降低,说明白杨素衍生物1a~1d和其起始产物白杨素可明显降低大鼠血清IgE、His及白三烯含量,其中白杨素衍生物1a-1d作用明显优于天然产物白杨素;白杨素衍生物1a、1b、1d可明显减少全血及BALF中嗜酸性粒细胞数量;肺组织病理学检查结果显示,新化合物能够明显缩小肺组织炎症面积,综合各项检测指标,活性强弱次序为:白杨素衍生物1b>白杨素衍生物1c>白杨素衍生物1d>白杨素衍生物1a>白杨素。
