强迫症的表观遗传学研究进展
2021-03-19林梁俊王卫娣林关宁
林梁俊,王卫娣,王 佩,林关宁,王 振
上海交通大学医学院附属精神卫生中心,上海200030
强迫症是一种病因尚未明确的致残率较高的精神疾病,在我国的终身患病率为2.4%,年患病率为1.6%[1]。了解强迫症的致病机制对其治疗至关重要。研究[2]表明遗传因素在强迫症的病因中扮演了重要角色,但目前基于家系及大样本研究所知的基因变异及位点多态性无法完全准确解析其病理机制。神经精神疾病已被证明是基因与环境共同作用的结果[3-4]。强迫症同样受到遗传因素和环境因素的影响。表观遗传学则对环境和遗传机制进行桥接,从而在一定程度上解释了环境参与遗传修饰作用并导致疾病状态变化[5]。同时,表观遗传修饰的可逆性可以为疾病的治疗提供新的方向。因此,理解社会环境、心理因素及周围暴露等因素对于诱导强迫症发病的表观遗传修饰机制,对进一步阐明强迫症的病理生理机制显得尤为重要。本文旨在综述强迫症在表观遗传学领域的研究成果,为进一步探究强迫症的发生发展提供信息。
1 强迫症发生的遗传因素及环境因素
强迫症的发生与遗传因素密切相关。家系、双生子、大规模人群研究都证明了遗传因素对强迫症发生的影响[6-9]。强迫症可能相关的易感遗传因子包括大片段结构变异[10]、新发突变[11]、常见基因型相关的单核苷酸多态性位 点(single nucleotide polymorphism,SNP) 等[2,6]。研究也发现了一部分易感基因,如通过强迫症家系遗传连锁研究锁定了染色体9p 区段[12],其中9p24 片段为风险区域[13],且位于该区域的溶质转运体家族1 成员1(solute carrier family 1 member 1,SLC1A1)基因被证实为强迫症候选基因。全基因组关联研究(genome-wide association study,GWAS)获得的多态性遗传位点为强迫症遗传学研究提供了更多候选基因,如大同源物关联蛋白1(DLG associated protein 1,DLGAP1)基因、红藻氨酸离子型谷氨酸受体2 (glutamate ionotropic receptor kainate type subunit 2,GRIK2)基因和Fas 凋亡抑制分子2 (Fas apoptotic inhibitory molecule 2, FAIM2) 基因等[6,8-9]。
遗传因素研究加深了对强迫症发病机制的认识,但不可忽略的是,包含童年创伤在内的应激性等环境因素对于强迫症发病也可能起着重要作用[14]。Brander 等[15]纳入128项研究分析强迫症与环境因素的相关性,发现围产期并发症、生殖周期事件(如流产、绝经等)、压力性及创伤性生活事件可能是强迫症发病的潜在环境风险因素。
由此可见,强迫症的发生是遗传基因基础和后天环境因素两者作用引起的。因此,也有针对特定环境因素影响下强迫症与遗传因素的关联研究,特别是多态性位点与应激作用的交互作用导致强迫症发病风险产生差异的遗传研究。例如,McGregor 等[16]发现强迫症患者中单胺氧化酶(monoamine oxidase A/B,MAOA/B)基因、儿茶酚胺转移酶(catechol-O-methyltransferase,COMT)基因的多种单倍型与童年创伤事件的交互作用与强迫症发病风险均显著相关。
2 强迫症的表观遗传研究
表观遗传学修饰包括DNA 甲基化修饰、组蛋白修饰及非编码RNA 调控表达等方式[17]。DNA 甲基化的常见催化位点为启动子或附近CpG 岛,该过程通常抑制转录过程,与基因沉默有关[18]。组蛋白修饰包括乙酰化、泛素化、甲基化及磷酸化等过程,这些过程可以调节染色体的活性并调控转录过程[19]。非编码RNA按照长度可分为长链非编码RNA 和非编码小RNA,而非编码小RNA中的微RNA(microRNA,miRNA)经过加工成熟后可与靶基因识别结合形成沉默复合体[20],从而通过抑制翻译等方式调节基因表达[21]。
在强迫症的表观遗传研究中,DNA 甲基化和miRNA调控作用已有相关研究报道(表1),但未见组蛋白修饰相关的内容。
2.1 强迫症易感基因的DNA甲基化
目前强迫症DNA 甲基化研究主要采用靶向特异性DNA 甲基化位点检测和基于芯片的全基因组范围的DNA甲基化检测方法。2 种方式都已发现强迫症易感基因的DNA甲基化修饰作用在患者和健康人群中存在显著差异,如强迫症患者外周血脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)基因及γ-氨基丁酸B型受体1(γ-aminobutyric acid B receptor 1,GABBR1)基因等启动子甲基化水平出现差异性变化。这些DNA 甲基化修饰作用与强迫症的发生发展存在密切关联。
2.1.1 BDNF基因 BDNF基因编码一种广泛表达于中枢神经系统的神经营养因子,被认为与多种精神疾病的发病机制相关,如精神分裂症[36]、双相情感障碍[37]、抑郁障碍[38]等。通过比较强迫症患者和健康对照的外周血中BDNF基因表达情况,发现患者中BDNF mRNA表达水平显著上升[22],而BDNF 蛋白表达水平则表现并不一致[39-40]。D'Addario 等[22]通过比较35 例长期稳定服用5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor,SSRI)的强迫症患者和32 例健康对照之间的BDNF 基因表达及BDNF 启动子外显子Ⅰ、Ⅳ、Ⅸ甲基化和去甲基化水平发现,强迫症患者BDNF mRNA 表达与启动子外显子Ⅰ区域甲基化水平存在关联,BDNF基因启动子外显子Ⅰ区域甲基化水平低于正常对照。Ferrer等[23]则发现强迫症患者BDNF 启动子Ⅳ的第10 个CpG位点甲基化水平与强迫症严重程度呈正相关。该结果与D'Addario 等[22]研究结果不一致,可能是因为抗抑郁药物的治疗改变了BDNF 甲基化水平。在抑郁症患者中发现外周血BDNF 蛋白表达水平下降,而经抗抑郁治疗后BDNF 蛋白表达水平却较治疗前明显升高[41]。这些研究结果表明,在强迫症患者中BDNF 基因启动子区的甲基化修饰状态,可以影响基因mRNA 和蛋白表达水平,从而参与疾病的发生发展过程。
2.1.2 SLC6A4基因 临床药物治疗研究发现强迫症与5-羟色胺能系统功能的失调密切相关,临床治疗上SSRI 也是作为强迫症治疗的一线药物[42]。多项研究发现5-羟色胺能系统中溶质转运体家族6 成员4(solute carrier family 6 member 4,SLC6A4) 基 因[43-44]、5-羟 色 胺 受 体 基因[44-45]多态性均与强迫症发病相关。5-羟色胺转运体基因 连 锁 多 态 性 区 域 (serotonin-transporter-linked polymorphic region,5-HTTLPR)是强迫症研究中的关键候选区域,而SLC6A4 启动子也得到了广泛关注。Grünblatt等[25]发现SLC6A4 基因rs25531 位点多态性与早发型强迫症相关,并且在这些儿童及青少年强迫症患者的唾液中发现SLC6A4 启动子区甲基化水平升高,成人中的结果却与之相反,表明SLC6A4 甲基化水平可能与年龄相关。Schiele 等[26]则发现强迫症患者较低的基线SLC6A4 甲基化水平预测了认知行为治疗结果不佳。这些研究均表明SLC6A4 基因启动子区甲基化与强迫症发病及治疗效果存在密切关联。
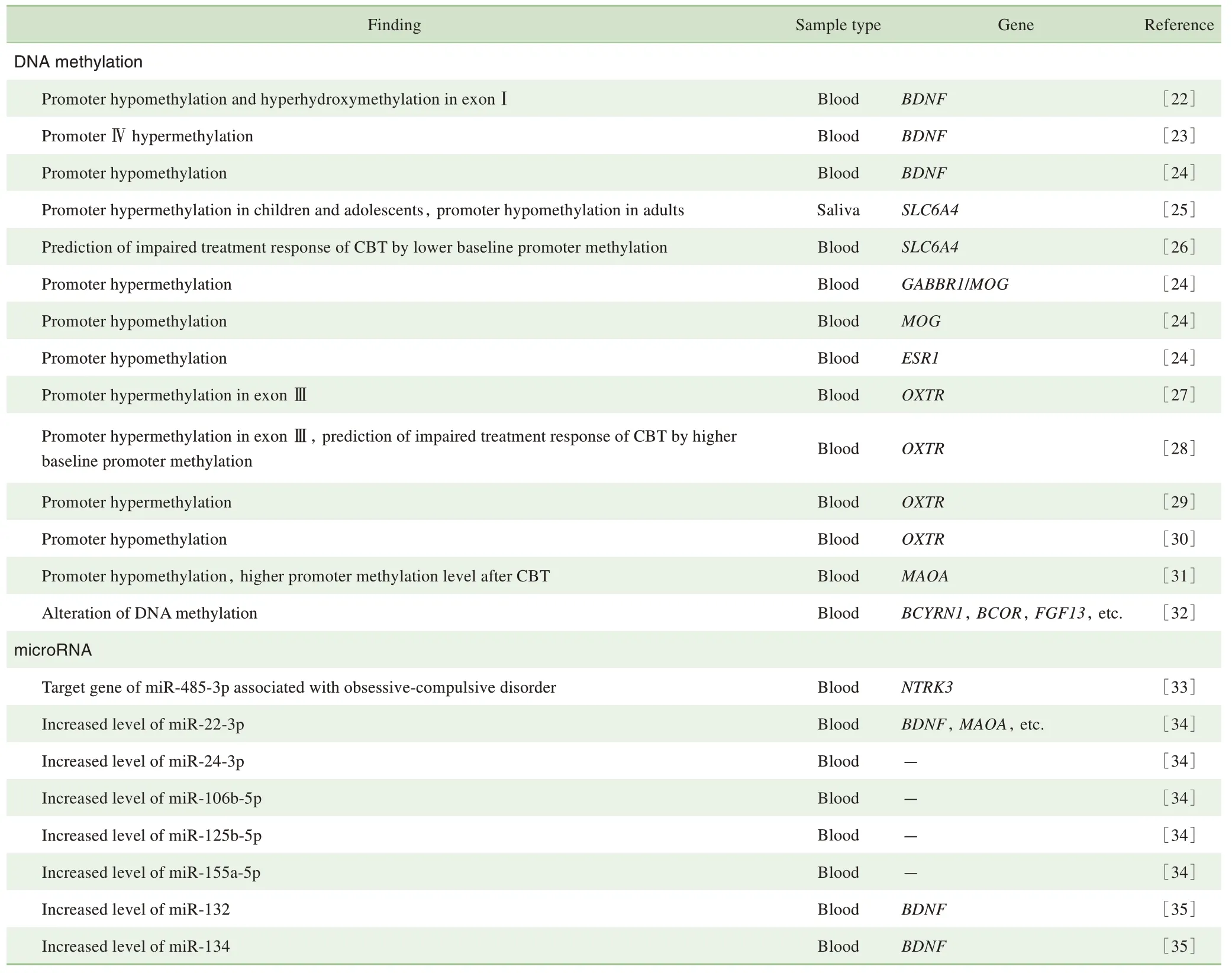
表1 强迫症的表观遗传学研究Tab 1 Summary of epigenetic genes in obsessive-compulsive disorder
2.1.3 GABBR1 基因和MOG 基因 γ-氨基丁酸(γaminobutyric acid,GABA)是大脑中的抑制性神经递质。Richter 等[46]发 现 在 强 迫 症 患 者 中GABAB受 体(γaminobutyric acid receptor type B,GABABR)介导的抑制性神经传递通路存在缺陷。GABABR 由GABAB1与GABAB2亚基组成,其中编码GABAB1亚基的GABBR1 基因位于6p21.3。遗传关联研究发现该区域与强迫症相关[12]。Zai 等[47]也 通 过159 个 家 系 样 本 研 究 确 认GABBR1上的多态性位点与强迫症发病有关。
在6号染色体上近邻GABBR1基因的髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)基因上的四核苷酸TAAA 重复序列被报道与强迫症发病相关[48]。Nissen等[24]对女性儿童或青少年被试出生时及被诊断为强迫症时的血液甲基化水平进行研究,发现被试出生时期血液GABBR1/MOG 的甲基化水平高于健康对照,而被诊断为强迫症时被试的MOG 基因甲基化水平较健康对照降低。由于该研究涉及的基因探针位于GABBR1转录起始区域附近并且与MOG 基因仅相隔2 bp,以致GABBR1/MOG 基因探针存在重叠,而无法确切证实2 个基因的调控作用。以上研究结果进一步提示强迫症患者中GABA 能系统中GABABR 介导的神经通路可能存在功能异常,并且也不能排除临近GABBR1 基因的MOG 基因与强迫症的关联性。故研究患者中可能早已存在的神经通路结构的表观遗传修饰改变,有助于强迫症的早期诊断及早期强迫症发病的预防。
2.1.4 ESR1 基因 性激素与强迫症的关系也是强迫症领域的研究热点之一。其中雌激素参与了5-羟色胺能、多巴胺能及谷氨酸能系统信号传递的调节[49],提示雌激素可能是与强迫症发病机制相关的生物标志物。雌激素受体α(estrogen receptor α,ERα)是雌激素受体的亚型之一,由雌激素受体1(estrogen receptor 1,ESR1)基因编码。Alonso 等[50]发 现 带 有ESR1 基 因rs34535804*Ars488133*C-rs9478245*C-rs2234693*C-rs9340799*G 单倍型的强迫症患者ERα 表达水平上升,并且其患有强迫清洗症状的风险降低。Nissen 等[24]发现女性儿童或青少年患者被诊断为强迫症时的血液样本的ESR1基因CpG 甲基化水平较健康对照降低,并且其甲基化水平与治疗前的疾病严重程度呈负相关,进一步说明ESR1 基因可能与强迫症存在关联。但是目前尚无足够证据确切证实雌激素及其受体在强迫症患者中的表达情况。且该研究中男性被试及对照较少,仍需进一步在男性及不同年龄患者中进行相关研究以验证ESR1 甲基化与强迫症发病风险的关系,并分析ESR1 在强迫症患者中的表达是否具有性别及年龄差异。
2.1.5 OXTR基因 催产素及其受体同样被认为参与了强迫症的病理生理过程。催产素会增加5-羟色胺的释放[49],而催产素受体(oxytocin receptor,OXTR)在与强迫症有关的脑部区域(丘脑、纹状体、前额叶皮层等)中大量表达[51]。Kang 等[52]发现,OXTR 基因多态性与强迫症患者的发病年龄显著相关。Cappi 等[27]发现强迫症患者OXTR 基因外显子Ⅲ2 个靶序列位点的CpG 岛甲基化水平较高,并且与强迫症的症状严重程度呈正相关。Schiele等[28]也同样发现强迫症患者OXTR 基因外显子Ⅲ甲基化水平较健康对照上升,并且较高的基线OXTR甲基化水平预测了不佳的认知行为治疗结果。但Park等[30]的实验结果则表明强迫症患者的OXTR 甲基化水平显著降低,与Cappi[27]及Schiele[28]等的结果不一致。
2.1.6 MAOA 基因 MAOA 酶参与并调节了5-羟色胺的代谢过程[53],与强迫症的发病机制密切相关。而MAOA基因多态性也与男性强迫症发病风险存在关联[54]。Schiele等[31]发现未经治疗的强迫症患者MAOA启动子甲基化水平较健康对照明显降低,而经认知行为治疗后的患者耶鲁- 布朗强迫量表(Yale-Brown Obsessive Compulsive Scale,Y-BOCS)得分变化与MAOA启动子甲基化水平变化呈负相关,提示经认知行为治疗后强迫症症状改善程度高的患者MAOA甲基化水平上升更多。
2.1.7 全基因组范围的DNA 甲基化研究 全基因组范围的DNA 甲基化分析因具有测量精度高、覆盖范围广等优势 在 疾 病 研 究 中 逐 渐 展 开 应 用[55]。Yue 等[32]利 用Illumina 450K 甲基化芯片对强迫症患者及健康对照之间的血液样本进行了全基因组水平DNA 甲基化分析,结果发 现 脑 细 胞 质RNA 1 (brain cytoplasmic RNA 1,BCYRN1)、 BCL-6 协 同 阻 遏 物(BCL6 corepressor,BCOR) 和成纤维细胞生长因子13 (fibroblast growth factor 13,FGF13)等基因的DNA 甲基化水平在2组间存在显著差异,并通过通路分析发现肌动蛋白细胞骨架调节、细胞黏附分子等通路相关基因的甲基化水平同样存在显著差异。Stewart等[8]利用来自强迫症患者和健康对照GWAS 研究的SNP 位点和脑组织的DNA 甲基化表达数据,发现其中的甲基化性状数量位点(methylation quantitative trait loci,mQTLs)与额叶中的表达数量性状位点存在关联。
2.2 强迫症有关的miRNA
目前关于miRNA 与强迫症发病机制的相关性研究较少。Muiños-Gimeno 等[33]在对强迫症患者全长亚型及短截亚型的神经营养受体酪氨酸激酶3 (neurotrophic receptor tyrosine kinase 3,NTRK3)基因的3'非翻译区重新测序后发现,短截亚型r28521337 位点的C 等位基因突变与强迫症囤积症状类型显著相关,并且该突变位点位于miR-485-3p的功能目标靶点区域,但r28521337位点变异并未影响靶向结合功能。Kandemir等[34]分析强迫症患者血液中miRNA 的表达差异,发现强迫症患者的miR-22-3p 及miR-155a-5p 等表达丰度较健康对照上升。已有研究[56]指出miR-22 可抑制与强迫症相关的BDNF 和MAOA 等基因的表达。miR-155 在免疫稳态中起到关键作用,参与调节细胞因子、趋化因子和转录因子等多个免疫相关基因[57]。而免疫炎症反应通路则被报道为强迫症潜在的发病机制[58]。Yue等[35]则发现强迫症患者血液中miR-132 及miR-134 水平较健康对照显著上升。目前研究已发现miR-132 及miR-134 与突触可塑性存在密切关联,并均可影响BDNF 的表达[59-60]。研究相关miRNA 的表达差异为进一步理解强迫症病因提供了可能。
3 局限性与展望
截至目前,强迫症的表观遗传学研究虽然匮乏但也取得一定的成果进展。大多数研究仍聚焦于DNA 甲基化位点的修饰变化,尚不能全面概括强迫症的表观遗传学机制。多数研究的样本量较小,研究结论尚且无法统一,亟需扩大样本量或针对特异性人群进行有效验证。不容忽略的是,表观遗传修饰具有组织特异性、细胞系特异性,因此已有研究结果的一致性尚存在争议。当前大部分研究采集外周血DNA 进行分析,并不能确定其研究结果是否能够代表中枢神经的表观遗传学变化。除了使用外周血,可更多注重对脑脊液、尸脑等材料的应用。未来的研究方向还需更多关注组蛋白修饰及非编码RNA,从而拓展强迫症表观遗传学的研究领域。
