Ⅰ期食管鳞癌的生物学特征和外科治疗结果
2021-03-19张晓彬刘智超孙益峰郭旭峰顾海勇李志刚
张晓彬,刘 鹏,刘智超,杨 洋,李 斌,孙益峰,华 荣,郭旭峰,何 毅,顾海勇,李志刚
1.上海市胸科医院/上海交通大学附属胸科医院胸外科-食管外科,上海200030;2.山东省泰安市宁阳县第一人民医院胸外科,宁阳271400
基于外科治疗后的食管癌患者远期生存分层分析,《美国癌症联合委员会(American Joint Committee on Cancer,AJCC) 分期手册》 第8 版的食管癌分期将T1N0M0Gany和T2N0M0G1归为Ⅰ期[1]。Ⅰ期包括ⅠA 期和ⅠB 期。 其 中ⅠA 期 包 括T1aN0M0G1, ⅠB 期 包 括T1aN0M0G2-3、T1bN0M0Gany、T2N0M0G1。Ⅰ期是一组转移风险非常低的早期食管癌,涵盖了低危的T1a(肿瘤侵犯黏膜层)、T1b(肿瘤侵犯黏膜下层)和部分T2(肿瘤侵犯固有肌层)患者。低危的T1b患者通常表现为肿瘤侵犯SM1层(黏膜下层上1/3)、肿瘤高分化(G1)、肿瘤直径小于5 cm 和淋巴管侵犯(lymphovascular invasion,LVI)阴性。T2N0M0G1在Ⅰ期食管癌患者中所占比例较小,然而国际食管癌协作组(Worldwide Esophageal Cancer Collaboration,WECC)回顾了13 300 例患者临床病理资料,其研究结果显示T2N0M0G1患者的生存规律与T1aN0M0G2-3和T1bN0M0Gany患者一致,因此《AJCC 分期手册》第8版将T2N0M0G1期患者归入Ⅰ期中的ⅠB期[2-4]。
日本食管协会(Japanese Esophageal Society,JES)公布的2012 年日本全年食管癌数据结果显示,对于Ⅰ期食管癌患者,5 年生存率可达80.2%[5],与同等年龄人群自然死亡率非常接近。为了进一步提高此类早期患者的治疗质量,有必要对这些Ⅰ期肿瘤的详细生物学特征进行描述。同时,食管癌手术具有明显高于其他胸外科手术的围术期死亡率。那么,Ⅰ期食管癌患者是否存在非外科手术治疗的可能,比如根治性放射治疗和化学治疗(放化疗)和内镜治疗?这都需要根据其生物学特征来确定。本研究拟通过单中心大组的病例报道来确定Ⅰ期食管鳞癌患者的以上特征,为治疗技术向更加无害化进步提供背景信息参考。
1 资料与方法
1.1 研究对象
回顾性分析2015—2019 年在上海交通大学附属胸科医院接受食管癌根治术的3 185 例食管癌患者。选取其中的TNM分期Ⅰ期(依据《AJCC分期手册》第8版)患者进行分析,剔除非鳞癌性食管癌、既往放化疗病史、同时合并其他恶性肿瘤的患者。最终入组379 例(11.9%)Ⅰ期食管鳞癌患者。通过回顾病历,获取患者的术前信息、手术方式、围术期恢复参数、术后病理、随访复发和生存信息。研究获得上海交通大学附属胸科医院伦理委员会批准(伦理审批号:KS2057)。
1.2 肿瘤分期及分析指标
本研究中肿瘤分期采用《AJCC 分期手册》第8 版的食管癌分期标准[1],仅使用其中的鳞癌部分。该分期由肿瘤侵犯深度(T)、区域淋巴结(N)、远处转移(M)、肿瘤分化(G)、肿瘤位置(L)5 个因素构成。该分期主要依据WECC 纳入的22 645 例食管癌患者的回顾性分析结果。
Ⅰ期包括ⅠA 期(T1aN0M0G1)和ⅠB期(T1aN0M0G2-3、T1bN0M0Gany、T2N0M0G1)。T1a指肿瘤侵犯深度不超过黏膜肌层,T1b指肿瘤侵犯深度至黏膜下层但并不累及固有肌层,T2指肿瘤侵犯深度至固有肌层,但并未累及外膜。N0指无淋巴结转移,M0指无远处转移,G1-3分别对应肿瘤高、中、低分化程度,Gany指分化程度为高、中、低任意一种。
肿瘤大小用肿瘤直径表示。本研究分别对术前内镜下肿瘤直径和术后病理测量肿瘤直径进行分析。淋巴脉管侵犯指脉管围绕肿瘤细胞巢(细胞角蛋白染色呈棕黄色)超过一半即判断为阳性。肿瘤位置:胸上段,颈段食管至奇静脉下缘水平;胸中段,奇静脉下缘至下肺静脉下缘水平;胸下段,下肺静脉下缘至胃食管交界处水平。
1.3 手术方式
手术方式包括微创手术和传统开放手术。手术类型包括经左颈部-右胸-上腹部三切口食管癌根治术(McKeown)、经右胸-上腹部两切口食管癌根治术(Ivor-Lewis)、经左胸一切口食管癌根治术(Sweet)和经裂孔路径食管癌根治术。微创手术包括达芬奇机器人辅助微创手术(达芬奇机器人辅助McKeown、达芬奇机器人辅助Ivor-Lewis) 和胸腔镜辅助微创手术(胸腔镜辅助McKeown和胸腹腔镜辅助Ivor-Lewis)。
1.4 术后并发症
采用Clavien-Dindo 手术并发症分级标准[6]对出现并发症的患者进行分级:①Ⅰ级:任何偏离术后正常恢复过程出现的症状,但不需要药物治疗、手术干预、内镜或介入治疗;包括使用止吐药、退热药、镇痛药、利尿药、补液和理疗,也包括可在床旁处理的感染切口。②Ⅱ级:需要除了Ⅰ级中列出药物之外的药物治疗,还包括输血和全肠外营养。③Ⅲ级:需外科、内镜、介入放射治疗等进一步处理,其中Ⅲa 不需要全身麻醉,Ⅲb 需要全身麻醉。④Ⅳ级:危及生命的严重并发症,包括中枢神经系统并发症及其他需要重症监护处理的并发症,其中Ⅳa 为单器官功能不全,Ⅳb 为多器官功能不全。⑤Ⅴ级为死亡。Ⅰ~Ⅱ级为轻度并发症,Ⅲ~Ⅴ级为重度并发症。围术期安全性以术后30 d 内死亡率和术后90 d 内死亡率描述和评估。
1.5 术后随访
术后随访间隔为每6 个月1 次。随访检测包括胸腹部计算机断层扫描(CT)、上消化道内镜、颈部超声、骨扫描(如有临床骨痛时使用)、头颅磁共振成像(MRI,如有神经系统症状或低分化时使用)、正电子发射断层显像(PET,选择性使用)。复发分为原位复发(吻合口)、区域淋巴结复发、远处转移3种。本研究末次随访截止日期为2020年5月1日。
1.6 统计学分析
采用SPSS 23.0 软件对数据进行统计学分析。定量资料以x±s 表示,定性资料以n(%)表示。采用Kaplan-Meier 法估计不同临床特征Ⅰ期食管癌患者的生存情况并进行Log-rank 检验,并对各指标进行单因素分析;将差异有统计学意义的因素进一步纳入多因素Cox 比例风险回归模型分析,结果以HR值及其95%CI表示。P<0.05认为差异有统计学意义。
2 结果
2.1 患者基本信息
全组Ⅰ期食管鳞癌患者379例,平均年龄(63.4±7.6)岁,男性占79.2%。术前合并基础疾病发生率33.5%。术前吸烟发生率35.4%,饮酒发生率24.5%。肿瘤位置分布:胸上段54 例(14.2%),胸中段166 例(43.8%),胸下 段159 例(42.0%)。临 床T 分 期 分 布:T1期220 例(58.0%),T2期144 例(38.0%),T3期15 例(4.0%)。临床N 分 期 分 布:N0期313 例(82.6%),N1期63 例(16.6%),N2期3例(0.8%)。
2.2 围术期结果
全组开放手术占18.5%,胸腔镜辅助微创手术占71.2%,机器人辅助微创手术占10.3%。术后总体并发症发生率为40.9%,其中Clavien-Dindo 分级Ⅲ级以上的并发症发生率为20.8%。开放手术、胸腔镜微创手术、机器人辅助下胸腔镜微创手术在Clavien-Dindo 分级Ⅲ级以上并发症发生率和总体并发症发生率差异均无统计学意义(P=0.573,P=0.370)。发生率较高的并发症依次为喉返神经损伤(14.2%)、肺炎(13.5%)、吻合口瘘(12.4%)、胸腔积液(11.1%)(表1)。全组30 d 内死亡率0.5%,90 d内死亡率1.3%。90 d内5例死亡患者的死因分别为肺栓塞(1 例)、呼吸功能不全(2 例)、自杀(1 例)、心源性猝死(1 例)。术后平均住院天数(16.2±14.8)d。8 例(2.1%)患者住院期间需要再次手术,包括2 例术后开胸止血,2 例坏死管胃切除,1 例胃瘘开胸修补,1 例乳糜胸行胸导管结扎,1 例气管食管瘘行气管支架置入,1 例术后上消化道梗阻行食管扭转复位。
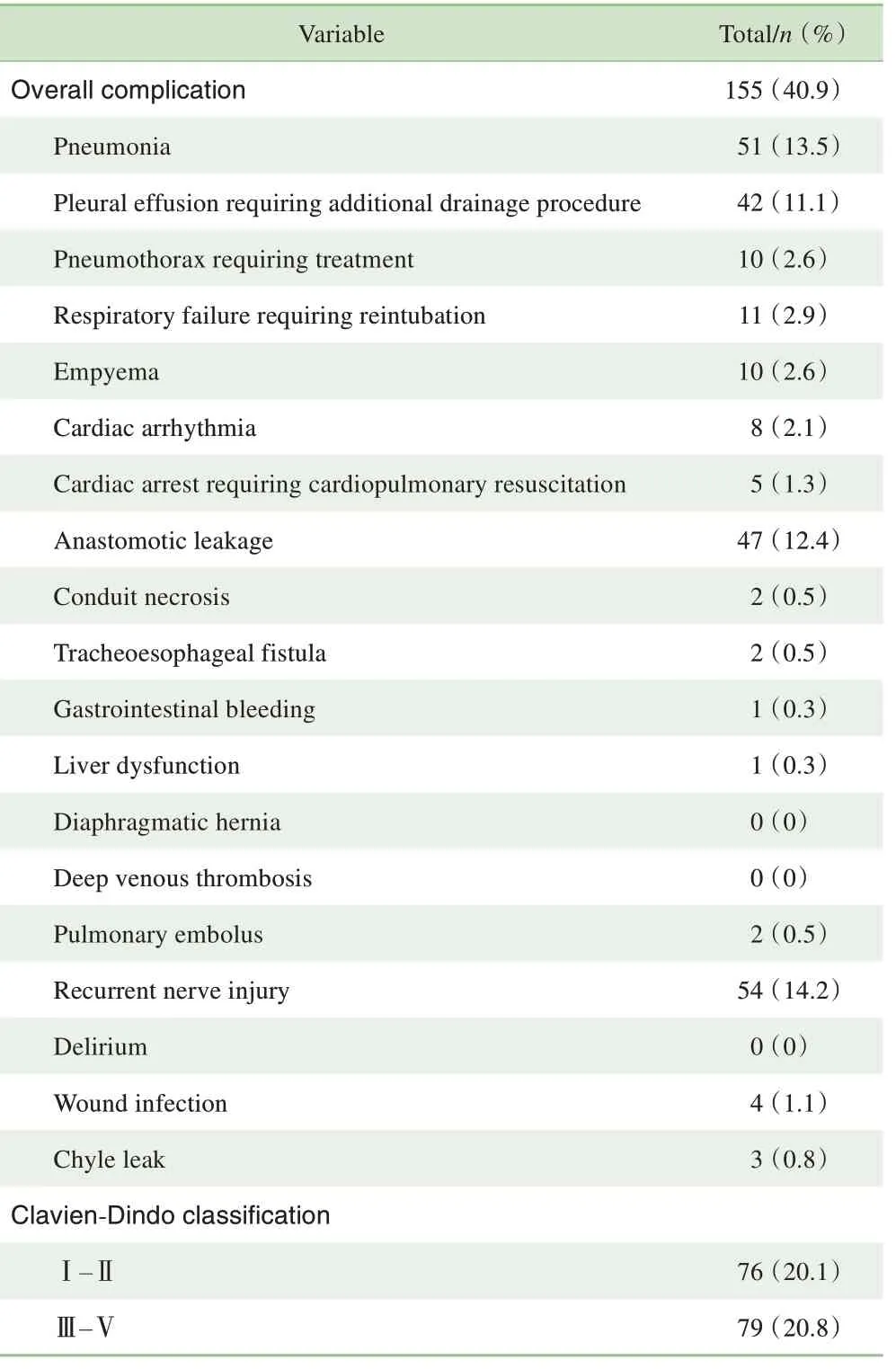
表1 379例Ⅰ期食管癌患者术后并发症发生情况Tab 1 Postoperative complications of 379 patients with stage Ⅰesophageal cancer
全组患者术后病理标本的平均肿瘤直径为(2.1±1.1)cm,略小于术前内镜测量的肿瘤直径[(3.2±2.2)cm]。病理分期T1a、T1b和T2分别占20.6%、69.4%、10.0%。78例病理分期T1a患者中,肿瘤环周侵犯的占38.5%,术前内镜下测量肿瘤长度大于5 cm 的占21.8%,术前临床诊断为临床分期T1b甚至T2-4a的占58.9%,临床分期N1-2的占17.9%,而不包含以上4 种情况理论上合适内镜下治疗的患者占12.8%。LVI 阳性率为5.8%,其中T1a为1.2%,T1b为6.8%,T2为7.9%。手术R0切除率为96.0%,15 例R1患者表现为近端切缘癌残留(10 例)、高级别上皮内瘤变(4 例)、不典型增生(1 例)。平均淋巴结清扫数(18.0±9.3)枚。220 例临床分期T1患者中,216 例术后病理分期为T1,仅4例患者术后病理分期为T2。病理分期T1的术前临床预测准确率为57.0%,病理分期T2的术前临床预测准确率为7.4%,临床分期N0的临床诊断准确率为82.6%。
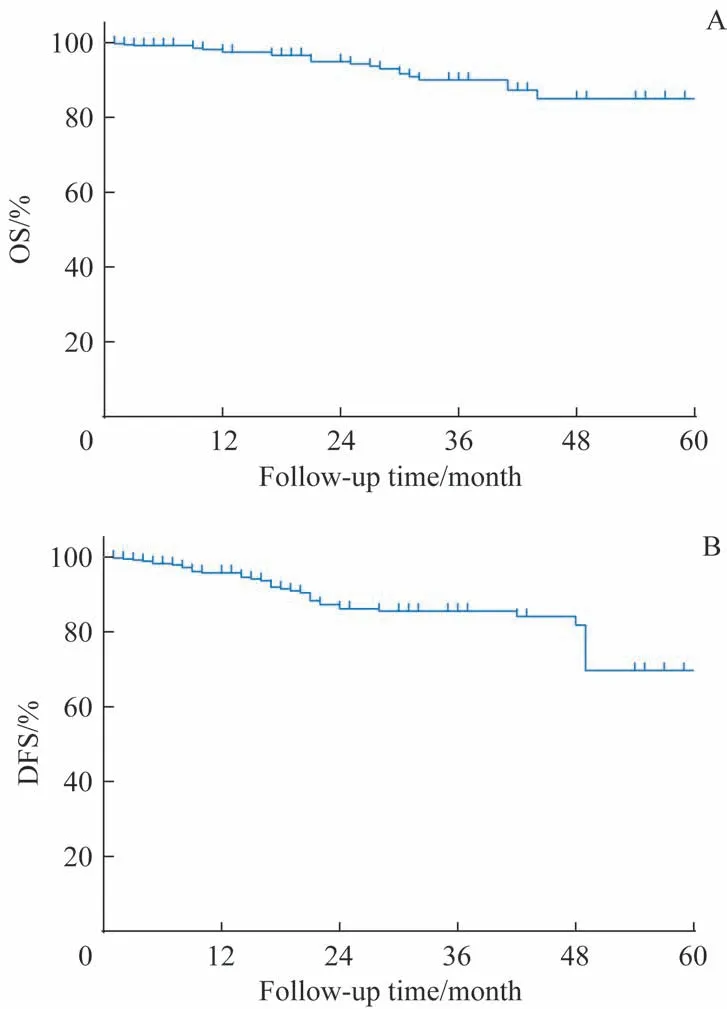
图1 379例Ⅰ期食管鳞癌患者OS及DFS情况Fig 1 Survival outcomes of 379 patients with stage Ⅰesophageal squamous cell cancer
2.3 Ⅰ期食管鳞癌患者术后远期生存结果
全组随访时间为1~61 个月,中位随访时间为24 个月。随访期间,总体复发率为8.2%,局部区域复发率和远处转移率分别为7.4%(28 例)和2.9%(11 例)。11 例远处转移病例中,肺转移8例、骨转移2例、肝转移4例。1 年、2 年 的 总 体 生 存(overall survival,OS) 分 别 为97.2%、94.2%,1 年、2 年的无病生存(disease-free survival,DFS)分别为95.3%、85.7%(图1)。
单因素分析显示年龄、淋巴结清扫数与OS相关(P=0.025,P=0.011),临床分期T和病理分期T、淋巴结清扫数与DFS 相关(P=0.017,P=0.005,P=0.001)(表2)。多因素分析显示:OS 的独立危险因素为年龄≥65 岁(HR=2.800,95%CI 1.231~6.367,P=0.014)和淋巴结清扫 数 少 于15 枚(HR=3.569,95%CI 1.408~9.044,P=0.007),DFS的独立危险因素为临床分期T2-3(HR=2.096,95%CI 1.036~4.239,P=0.040)和淋巴结清扫数少于15枚(HR=3.652,95%CI 1.811~7.361,P=0.000)(表3)。
图2 列出了影响OS 与DFS 的2 个独立危险因素生存结果间的差异,年龄≥65岁的患者2年OS低于年龄<65岁的患者(P=0.020);临床分期T2-3的患者2 年DFS 低于临床分期T1的患者(P=0.015);淋巴结清扫数<15 枚的患者,2 年OS 和DFS 均低于淋巴结清扫数≥15 枚的患者(P=0.007,P=0.000)。
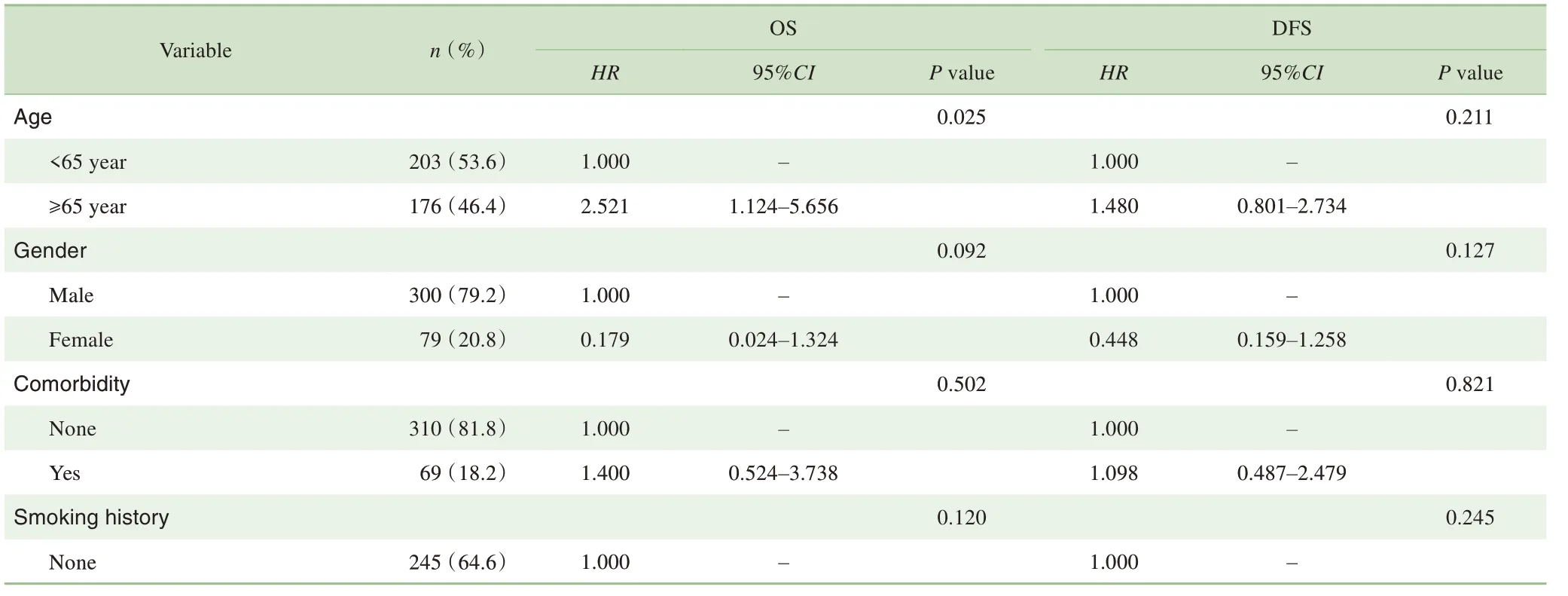
表2 影响OS与DFS的单因素分析Tab 2 Univariate analysis of risk factors on OS and DFS
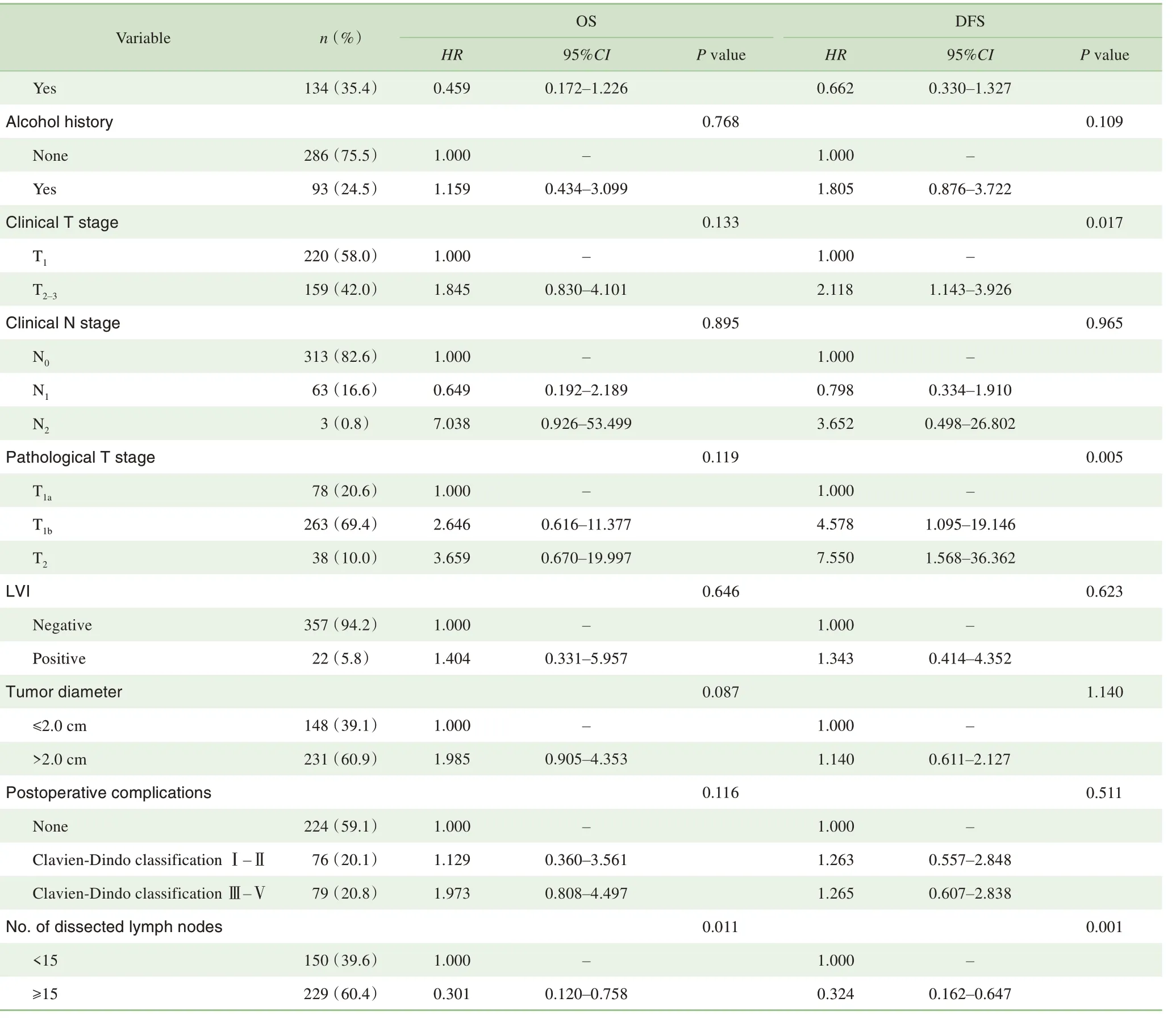
Continued Tab
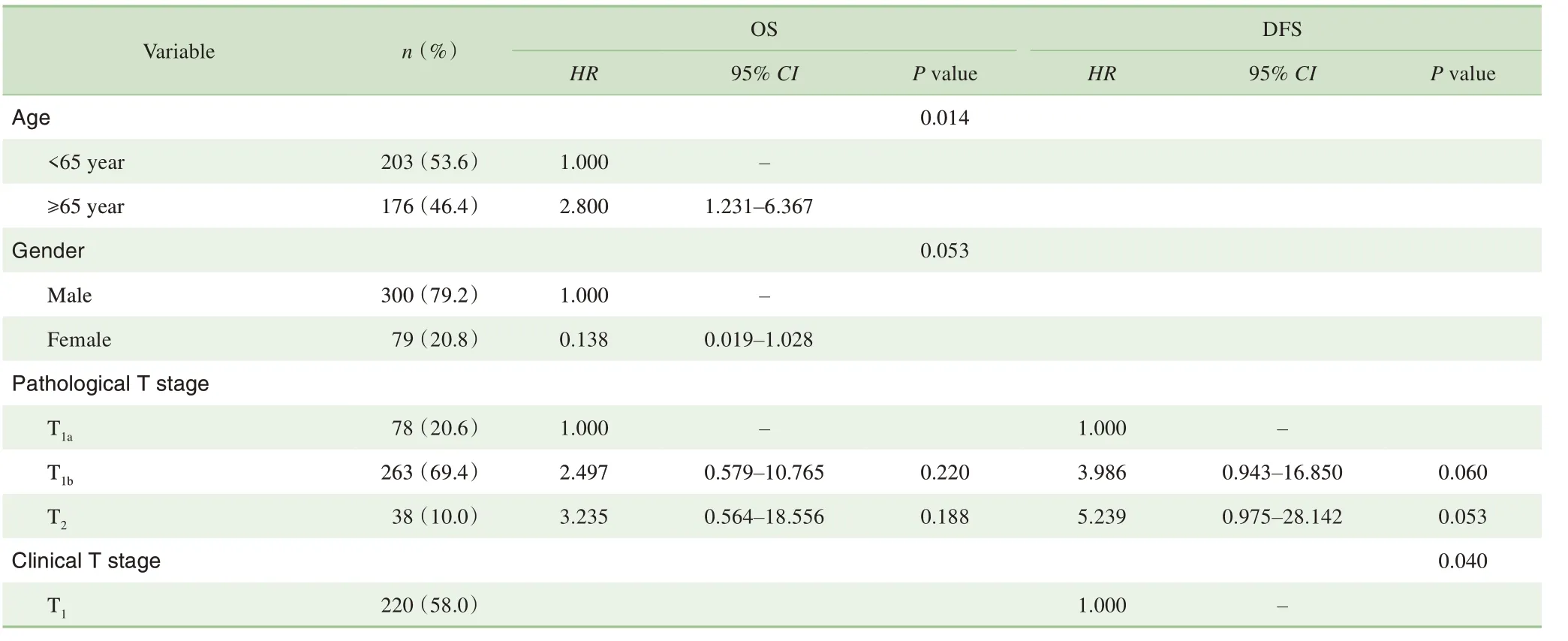
表3 影响OS及DFS的多因素分析Tab 3 Multivariate analysis of independent risk factors on OS and DFS
Continued Tab
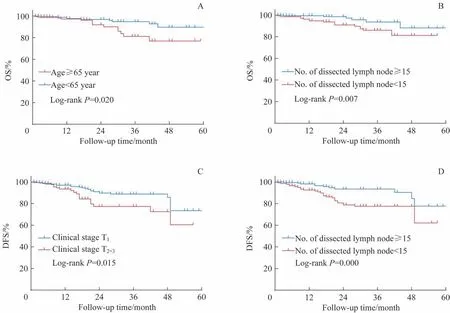
图2 不同独立危险因素影响下的OS和DFS的Kaplan-Meier生存曲线结果Fig 2 Kaplan-Meier curves for OS and DFS according to the independent risk factors
3 讨论
在《AJCC分期手册》(第8版)的食管及胃食管交界区肿瘤的分期中,国际学者依据WECC 22 645 例食管癌患者资料分析结果,将T1N0M0和T2N0M0G1划分为Ⅰ期,即肿瘤局限于黏膜下层之内并且无淋巴结转移(T1N0M0)和肿瘤侵及固有肌层并且无淋巴结转移且肿瘤呈高分化表现(T2N0M0G1)[2-4]。
根据《AJCC分期手册》(第8版)数据分析,临床诊断的“早期食管癌患者”往往存在低估的现象,即实际病理分期要晚于临床分期。在本研究中,220例临床分期T1的患者,216 例为术后病理分期T1,仅4 例患者为术后病理分期T2。 在目前食管超声内镜(endoscopic ultrasonography,EUS)普及的情况下,低估临床分期T是非常少见的,尤其是浅表病变。低估的主要是预测淋巴结转移的临床分期N。由于Ⅰ期食管癌患者可选择的治疗方式多样,尤其可以选择内镜下黏膜切除术(endoscopic submucosal dissection,ESD),从而避免外科手术带来的创伤,因此诊疗单位内综合检查后判断的临床分期N0与病理分期N0结果一致性越高,则该单位内有更多Ⅰ期患者可选择创伤更小的内镜治疗。本研究中临床分期N0的预测准确率高达82.6%。因此本单位对一个Ⅰ期的患者而言,低估临床分期T和临床分期N都是不太容易的。这与WECC的结果是有冲突的[1-4]。但此结果仅仅是术后病理结果分期与临床分期的对比,而非远期生存的对比,因此我们需要更多随访信息去评估WECC 的结论。
尽管对于Ⅰ期患者,内镜治疗可达到潜在完全治愈效果,并且避免外科手术带来的创伤,然而外科医师往往担心此类患者接受非外科手术治疗后潜在的肿瘤复发隐患。原因在于一方面外科医师担心综合检查后评估的临床分期低于术后病理分期,另一方面已有的一些全系膜切除后食管癌分析中发现部分临床分期T1N0M0的患者术后意外发现淋巴结转移[7-8]。但日本最近公布的JCOG0508 研究可以打消我们部分的疑虑[9]。JCOG0508研究是一项旨在评估临床分期T1N0M0食管鳞癌的内镜切除和放化疗联合治疗的有效性和安全性的Ⅱ期临床研究。该前瞻性研究对低危的浅表型病变患者进行了亚组干预,其中病理分期T1a+R0切除+LVI 阴性的患者仅做观察(n=74),病理分期T1a+LVI 阳性/病理分期T1b+R0切除的患者对淋巴结引流区域行预防性辅助放化疗(41.4 Gy)(n=87),病理分期T1b+R1(垂直切缘肿瘤残留)的患者行原发灶根治性放疗(50.4 Gy)(n=15)。经过ESD 和后续选择性非手术干预后,全组3 年OS 达到92.6%。由此可见对于可以首诊用ESD 干预的浅表病变,再手术的应用率可能很低。
JCOG0508 仅涵盖了肿瘤直径小于5 cm 的病理分期T1a或病理分期T1b-SM1(肿瘤侵犯黏膜下层上1/3)和病理分期T1b-SM2的患者,并未涵盖所有浅表型病变情况,尤其是大于5 cm、侵犯深度至SM3的患者涉及很少(仅15例)。对于这些高危患者行外科手术还是辅助放化疗的争议还很多,需要更多样本量的Ⅲ期临床试验佐证。本中心目前正引导一项多中心、开放、随机化联合前瞻性观察的Ⅲ期临床试验(AdESD 研究)[10],希望可以获得更全面的对比结果。病理分期T1a一直被认为是ESD 治疗的绝对适应人群[11-13]。但本研究中有78例病理分期T1a患者,接受了外科治疗而非内镜ESD 切除。生物学特征分析发现,肿瘤环周侵犯的占38.5%,术前内镜下测量肿瘤直径大于5 cm 的占21.8%,术前临床诊断为临床分期不低于T1b的占58.9%,临床分期N1-2占17.9%,而不包含以上4 种情况理论上合适内镜下治疗的患者为10 例(12.8%)。而有研究[14]显示,此类高危T1a患者具有9%以上的淋巴结转移风险。因此本研究中,对于此类高危的病理分期T1a患者,外科医师从肿瘤学长期结果角度考虑,选择了手术治疗方式。
我们期望对患有Ⅰ期食管癌的患者给予“治愈性治疗”,同时期望将治疗相关并发症降至最低。食管切除手术的术后并发症一直备受关注。日本全国数据库显示食管癌手术后并发症发生率为42.8%,即便是微创手术也无法明显降低术后并发症发生率[15]。本研究中总体并发症发生率为40.9%,其中重度并发症发生率为20.8%(Clavien-Dindo 分级Ⅲ~Ⅴ)。90 d 内术后手术相关死亡3例(0.7%),低于日本报道的2.4%[15]。可以看出目前的外科技术已经可以将食管癌的外科相关死亡降低很多,但仍会有手术相关死亡。而在JCOG0508研究中,经过内镜和辅助CRT 治疗未出现治疗相关死亡[9]。因此我们还不能将外科治疗对患者的危害降至最低,尤其是对Ⅰ期食管癌这样一个“可治愈”疾病。
除了手术早期失败(手术死亡)外,更多死亡病例为术后随访期间的肿瘤复发所致食管癌相关死亡。本研究中术后总体复发率为8.2%,其中局部复发率明显高于远处转移率(7.4%vs 2.9%),由此可见对于早期食管癌,多数患者表现为手术治疗不彻底的局部病变,而其远处转移并不常见。所以对于早期病变,尤其需要进行更加彻底的手术切除。全系膜切除是有必要推荐的。JCOG0508 研究中的复发率是8.5%,10 例患者出现了单纯局部淋巴结复发,5例患者出现远处转移,同样表现为局部复发更加严重。这提示隐匿的局部淋巴结复发是这些早期患者治疗失败的重要因素。因此即便采用内镜治疗,更广泛的淋巴结干预是非常重要的。本研究中多因素Cox 分析结果显示,淋巴结清扫数少于15 枚是影响Ⅰ期食管鳞癌患者OS和DFS 的独立危险因素。这更加证实了彻底淋巴结清扫的重要性。
本研究为回顾性研究,涵盖了一个大组的单中心Ⅰ期食管癌患者。由于是从病理结果逆行筛选病例,因此很难反映术前表现为早期的患者的实际治疗选择和结果,但仍能对这一类患者进行建议性分析。结果显示在现代外科条件下,我们可以对Ⅰ期食管癌患者带来满意的远期生存收益,但仍然不能将手术死亡率降低至0。而肿瘤学失败的主要原因是局部复发。由此可见如果选择手术治疗,对于Ⅰ期食管癌患者应采取更加彻底的淋巴结清扫。目前经过外科治疗的Ⅰ期食管癌患者中,仍有部分可以进行内镜加放化疗的非手术治疗组合,但如何预防局部肿瘤复发是此类治疗选择未来推广的关键。
