囊性肾肿物行腹腔镜肾部分切除术的技术特点
2021-03-19吴进锋叶烈夫
吴进锋 叶烈夫
随着体检的普及和影像学检查的增加,越来越多的人被诊断出囊性肾肿物(cystic renal masses,CRM)。60岁以上人群有三分之一可在腹部影像检查时发现至少一个单纯性肾囊肿[1]。传统的Bosniak分类法已广泛应用于CRM的诊断,但在诊断标准和处理原则上还存在争议。肾部分切除术是T1期肾肿瘤的首选术式,且多数可在腹腔镜下完成,这一原则也适用于CRM[2]。本文将着眼于CRM的特殊性,对腹腔镜肾部分切除术(laparoscopic partial nephrectomy,LPN)的技术特点进行归纳分析。
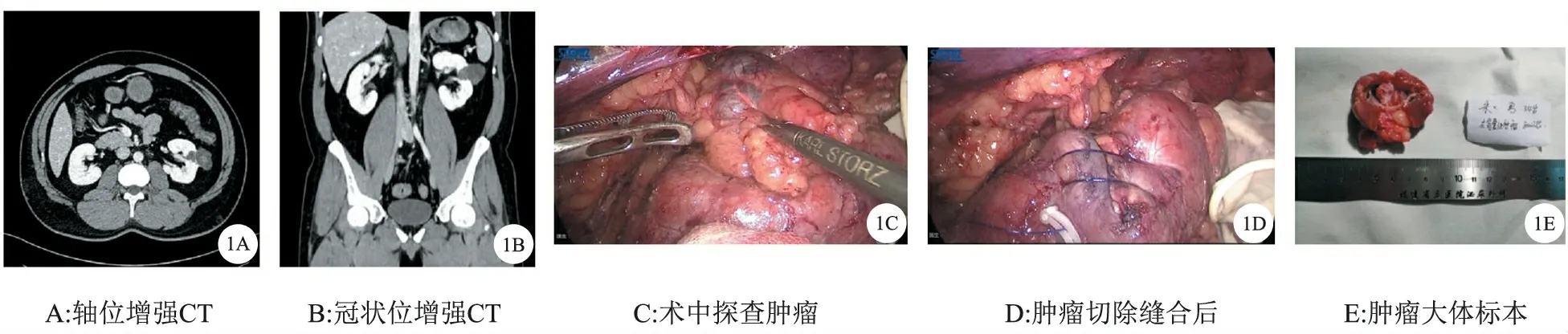
图1 BosniakⅡF型囊性肾癌示例
一、CRM诊断进展
1.定义:从形态学角度,CRM包括所有囊性结构为主的肾脏病变,良性病变有单纯性囊肿、复杂性囊肿、脓肿和囊性肾瘤等;恶性病变有肾癌囊性变(因出血坏死形成假性囊肿的肾癌)和囊性肾细胞癌(cystic renal cell carcinoma,CRCC)。目前对于“囊性肾细胞癌”的定义没有统一标准,存在临床和病理学认识的分歧。Hartman等[3]曾将囊性肾癌分为4类:多房囊性肾细胞癌(透明细胞肾细胞癌)、单房囊性肾细胞癌(主要是乳头状肾细胞癌)、囊性坏死肾细胞癌和单纯囊肿肾细胞癌。2016版WHO肾肿瘤分类中纳入的囊性肾肿瘤包括低度恶性潜能的多房囊性肾肿瘤(原分类称多房囊性肾癌),管状囊性肾细胞癌,获得性囊性疾病相关性肾细胞癌、幼年性囊性肾瘤等。有关囊性成分占比的标准也有很大差异(5%~90%),近期Park等[4]研究发现,囊性比例≥45%是有利生存的独立预后因素。
2.Bosniak分类法及预后:CRM最常用的影像学分类法是由Bosniak[5]于1986首次提出并不断改进。该分类是一种恶性预测系统,通过CT扫描来观察囊壁和分隔的厚度、数量、有无钙化以及其是否强化等参数,在排除感染、炎症和血管性病因后将CRM分为5型。各型对应的恶性可能呈递增趋势:Ⅰ型为良性单纯性肾囊肿;Ⅱ型囊肿稍复杂,绝大多数是良性;ⅡF型中度复杂,恶性比例8%~27%(图1);Ⅲ型恶性比例约54%(图2);Ⅳ类则接近90%[6]。
3.Bosniak分类法的改进:传统Bosniak分类法存在明显缺陷:(1)分类标准中的术语表达不明确、无法量化;(2)CT片清晰度不同会造成主观判断差异;(3)对CT表现不典型的良性CRM诊断困难,也不能完全区分侵袭性癌和惰性癌。这些缺陷导致许多良性CRM被切除却没有明显获益。2019版Bosniak分类系统则致力于克服这些缺点[7]。新版标准通过对模糊术语重新定义来明确诊断标准,同时引入MRI分型标准来提高诊断精确度。这些修改的目的是让更大比例CRM进入低风险级别,从而减少过度治疗,尤其是对预后争议较大的Ⅲ型囊肿。
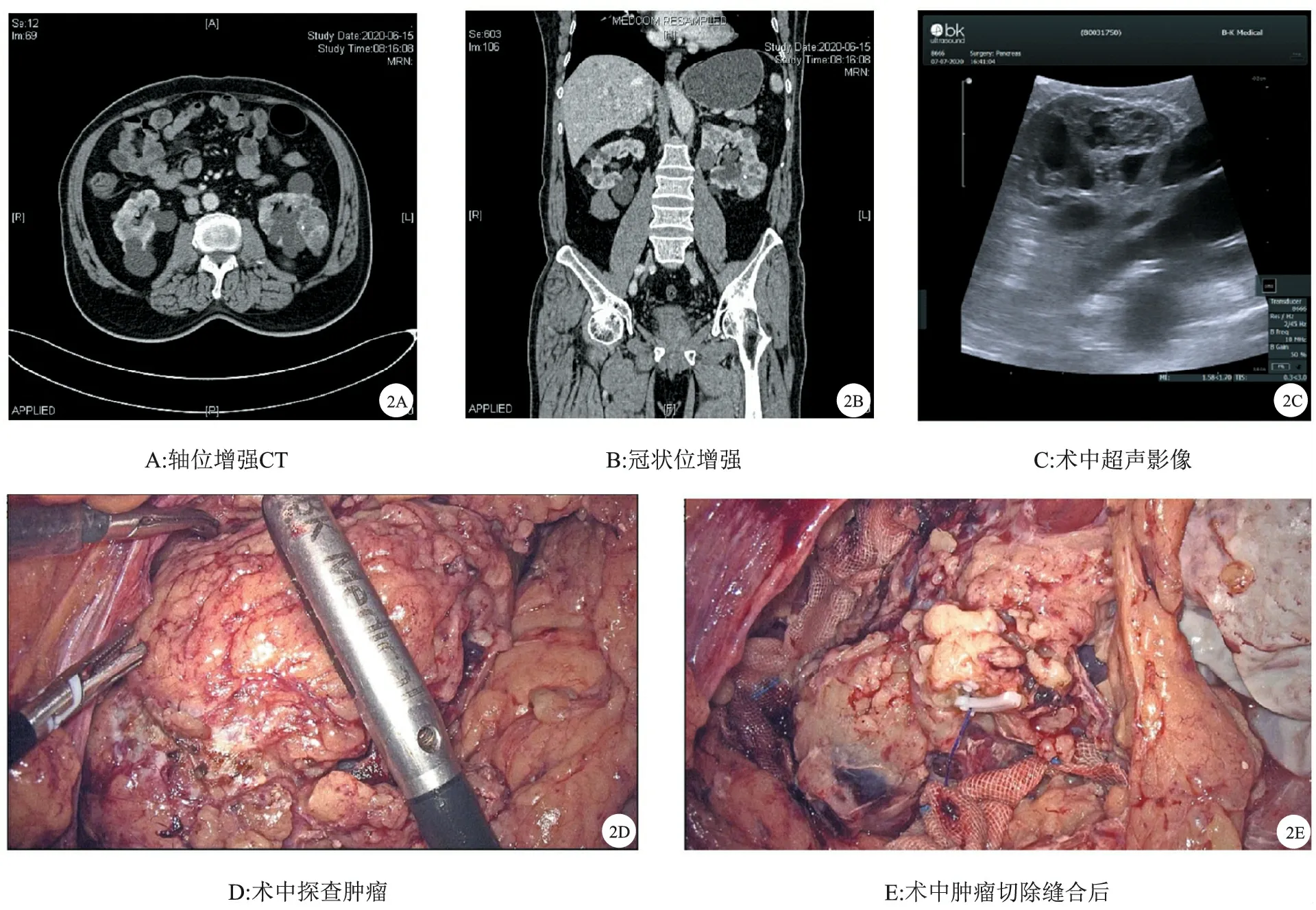
图2 Bosniak Ⅲ型囊性肾癌示例
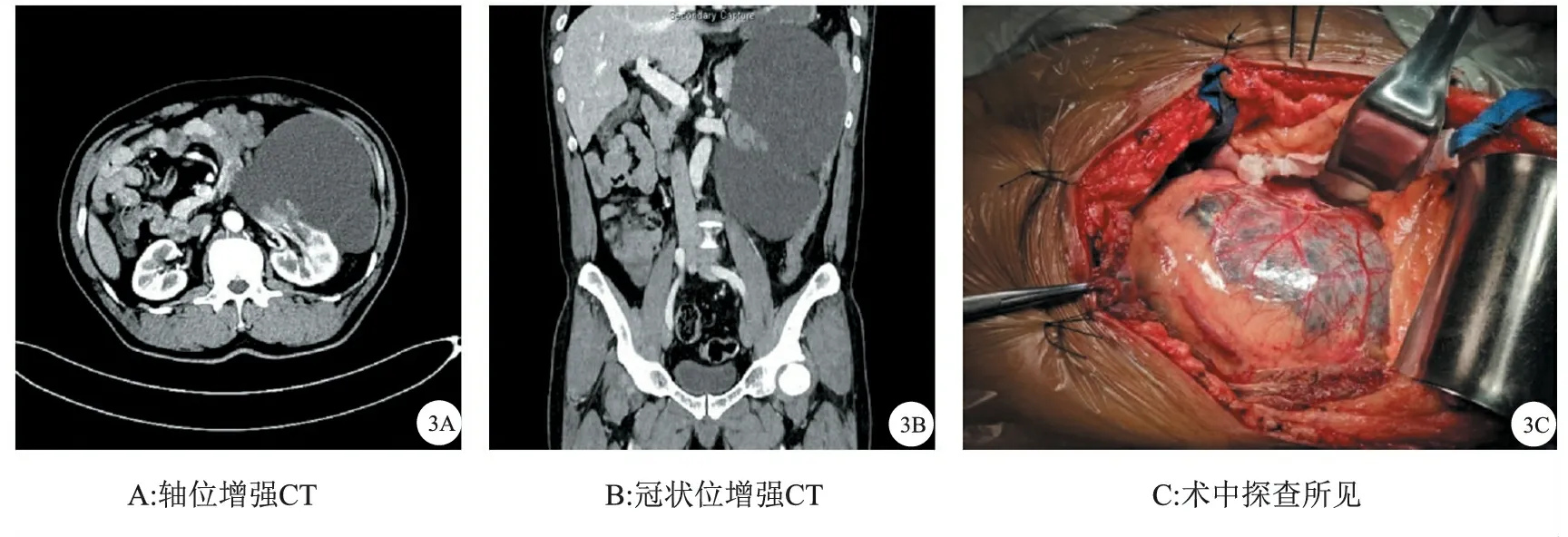
图3 BosniakⅣ型巨大囊性肾癌示例
二、CRM的治疗原则
以往认为,Ⅰ和Ⅱ型CRM可以不处理,ⅡF型应密切观察,而Ⅲ和Ⅳ型应积极治疗。最新的AUA指南也支持对无预期寿命限制,肿块直径≥2 cm的Ⅲ和Ⅳ型CRM手术切除[2]。但随着临床证据的积累,目前对CRM的处理原则趋向谨慎。因为Ⅲ和Ⅳ型CRM大部分是CRCC,其转移潜力低,预后良好,有学者建议将CRCC在临床分期中单列为T1c以指导随访[8]。因此,CRM的治疗不能简单地按Bosniak分类法进行,还需考虑病人年龄、共病情况、预期寿命、治疗偏好和风险承受能力等因素。尤其对于高龄、有基础病的Ⅳ类CRM病人,治疗方法和手术时机都值得探讨。
三、CRM的手术方式和特殊性
CRM的手术方式主要包括肾部分切除术和根治性切除术,多数可在腹腔镜下完成。对于巨大CRM也可行开放手术(图3)。故应综合考虑肿瘤性质、手术难度、病人意愿、术者技术偏好等诸多因素进行个体化选择。
与实质性肿瘤相比,CRM的特殊性在于术中囊肿破裂(cyst rupture,CR)导致溢液可能,理论上有肿瘤播散和复发的风险。但目前多数文献认为这种溢液不会增加局部复发的风险。CR发生率很低,目前最大宗研究来自Pradere等[9],其术中CR率高达18.7%,但随访期内并未影响肿瘤学结果。
然而,需要警惕的是一些罕见但高度恶性的肾肿瘤也可表现为CRM。例如肾髓质癌、遗传性平滑肌瘤病和肾细胞癌综合征相关性肾癌等。这些肿瘤预后差,术中一旦发生CR,肿瘤进展风险将会显著增加[10]。所以LPN术中应尽一切可能避免CR,不建议行肿瘤剜除术。
四、CRM行腹腔镜肾部分切除术的技术特点
由于CR是CRM相较于实性肿瘤行手术治疗的额外风险,所以防止CR的措施就是CRM行LPN的最大技术特点。Gill等[11]研究表明,LPN对于复杂性肾囊肿的处理比实体病变更具挑战性。操作必须非常小心,以避免在游离和切除肿瘤时出现CR,必须保留足够的正常实质边缘。需要从LPN的每个技术细节入手,最大限度避免发生CR。
1.手术难度评估:虽然LPN的手术指征是以肿瘤大小确定(T分期),但实际上手术复杂性需要考虑许多因素。目前,RENAL,PADUA和C-Index评分系统最常用。另一个重要因素是肾周脂肪状态。伴有糖尿病、肾周脂肪增厚及纤维化时手术难度会明显增加[12]。常用梅奥评分系统来进行术前评估[13]。CRM具体术式同样取决于肿瘤大小和周围解剖的复杂性,应根据手术难度来决定手术方法和相关设备和技术。
2.手术入路选择:LPN常用入路为经腹入路和经腹膜后入路,经腹入路的优点包括:套管位置选择多,操作空间大,解剖标志清晰等;缺点是肾动脉显露较困难和影响胃肠道功能恢复。经腹膜后入路则与之相反。目前没有证据表明何种方法更优。一项Meta分析表明,对T1a肾肿瘤,腹膜后入路除了手术时间较短外,其他方面均无显著差异[14]。CRM的手术入路主要由肿瘤位置和术者习惯决定。对于肾门腹侧、内上方或者体积巨大的CRM,经腹入路更具优势。
3.热缺血时间:由于CRM术中需特别注意防止出现医源性CR,为了保证术野清晰和安全性,一般都需要阻断肾血管。所以应尽量缩短热缺血时间(warm ischaemia time,WIT)。目前多数研究认为,如果没有采用冷缺血、选择性阻断等技术,WIT不应超过30 min[15]。目前有许多技术可以减少WIT:(1)肾脏低温技术(冷缺血阻断技术):通过术中肾表面降温、经输尿管灌注或肾动脉灌注冰水等方式降低肾实质温度,可为复杂LPN手术提供更长的缺血操作时间窗。肾表面冰水灌注技术简单易行,一举多得,通过助手操控还能实现循环灌注,又能清洁创面,我们中心已常规应用于后腹腔LPN中。经输尿管逆行灌注冰水也简单易行,对于需要逆行置管的病人应用方便,且不受手术入路限制。经肾动脉灌注效果最好但需行介入手术,又有影响全身体温和液体超负荷风险,故实际应用很少。总之,LPN冷缺血方法的使用因人而异,对CRM病人也应个体化选择。(2)肾血管阻断技术与开放阻断技术:肾血管阻断技术包括肾动静脉全阻断、动脉主干阻断、选择性肾动脉分支阻断、必要时阻断和无阻断等技术。开放阻断技术包括早期开放阻断和序贯开放阻断技术。在CRM行LPN时,肾血管阻断和开放阻断技术应灵活应用:CR风险不大的病人可参照一般原则,比如预计WIT在25 min以内,可以阻断肾动脉主干,不但术中视野清晰,还不影响术后肾功能恢复。对于可能超时的复杂病例,在创面内层缝合确切的情况下,采用早期开放阻断技术能显著减少WIT。对于CR风险大的病人,对肿瘤显露要求很高,尤其是肿瘤位于肾门部时,要尽量保证创面清晰,可采用肾动静脉全阻断技术。对于肿瘤由肾分支供血或副肾动脉供血的CRM,可以采用选择性肾动脉分支阻断、必要时阻断和序贯开放阻断技术。对于体积较小的浅表外生性CRM,可慎用无阻断技术。
4.肿瘤显露技术:肿瘤的显露是LPN的核心问题之一,良好的显露是肿瘤切除和缝合的基础,对CRM而言尤为重要。术中肾脏和肿瘤的游离程度取决于肿瘤的位置和大小。一般定位清楚、操作角度不受限的外生型CRM无需过多游离患肾。而肾门部、上下极肿瘤或操作角度不佳的肿瘤常需完全游离患肾,通过摆动或旋转肾脏来改善操作角度,保障CRM手术安全性。此外,游离肿瘤时应保留覆盖在肿瘤表面的脂肪,即能通过术中牵引来改善肿瘤基底显露,又能在术后评估脂肪是否侵犯。另外,肿瘤切除前用电钩在肾表面标记也是简单实用的技术,既能标记肿瘤切除范围,又能使切除的肾包膜与肾实质不易分离,方便牵引肿瘤。肿瘤显露技术中还包括各种悬吊技术,包括后腹腔镜时使用的肾周筋膜悬吊技术、经腹腹腔镜时使用的侧腹膜悬吊技术和肿瘤自悬吊技术。肾周筋膜悬吊技术可以改善后腹腔镜术中腹膜反折对术野的遮挡。同理,侧腹膜悬吊技术则可以改善经腹腹腔镜术中结肠对术野的干扰。肿瘤自悬吊技术主要用于后腹腔镜LPN术中切除腹侧肿瘤时,通过保留肿瘤表面脂肪与肾周筋膜不分离,利用气腹压让肿瘤“挂在”肾周筋膜上,起到“自悬吊”作用,相当于助手通过肿瘤表面脂肪提拉肿瘤[16]。对于一些巨大囊性肾癌,术中无需完全游离肿瘤,通过悬吊让肿瘤保持在原位,切除肿瘤后患肾与肿瘤就能自然分离而不影响缝合。因为游离肿瘤不但操作不便,巨大的瘤体也会对创面显露造成很大影响。
5.肿瘤切除技术:LPN的目标是“三连胜”:即肿瘤切缘阴性,避免并发症和保留尽可能多的肾组织。目前,对于肾肿瘤切除的“安全距离”并无定论,一般认为只要肿瘤包膜完整,无需刻意追求安全距离。但对囊壁较薄的CRM,为避免CR,应适当远离肿瘤包膜。LPN术中肿瘤切除技术主要包括血管阻断后冷剪除技术、锐性剪除+钝性分离技术和能量平台切除技术。冷剪除技术速度快,且无热损伤;锐性剪除+钝性分离技术能更好地辨认正常组织与肿瘤组织,可贴近肿瘤包膜切除,既能完全切除肿瘤,又可以保留更多的肾组织,是目前应用最多的方法。对于无阻断的肿瘤,可应用电刀、超声刀或激光等能量平台切除,可以减少术中出血。对于有CR风险的CRM,应避免使用“肿瘤剜除”技术,术中要尽量使用阻断后剪除或钝锐性分离技术,保持创面和肿瘤清晰可见,才能最大限度减少并发症。
6.创面缝合技术:肿瘤切除后创面缝合技术按层次可分为全层缝合、分层缝合。缝合方法包括间断八字缝合、连续Hem-o-lok锁定缝合、连续捆绑式缝合、连续环形锁边缝合等。具体采用的缝合技术要根据创面大小和深度来决定。创面表浅用全层缝合即可;创面较深,血管断端较多或集合系统开放则应当分层缝合;无法对拢的较大创面或肾门部肿瘤适合用连续环形锁边原位缝合,有时需要在创腔填塞止血材料来加强止血效果。目前倒刺缝线已广泛使用,连续捆绑式缝合因其兼具效率与可靠性,因而应用最多,如果配合Hem-o-lok锁定技术,则缝合可靠性更高。CRM行LPN在创面缝合技术方面并无特殊之处。
7.特殊技术与设备:除了上述常规技术,还有许多新技术可用于LPN,比如三维立体成像导航技术和虚拟现实技术[17]、术中超声辅助定位技术[18]、机器人辅助腹腔镜系统和吲哚菁绿荧光显像技术等[19]。三维立体成像技术有助于术者更好地了解肿瘤与周边结构的解剖关系,而虚拟现实技术通过将全息虚拟模型与术中影像实时融合,能为术者提供非常直观的视觉体验,拥有广阔的应用前景。术中使用吲哚菁绿荧光染色有助于肿瘤边界的判断和选择性分支阻断技术的应用。术中超声辅助定位技术无疑最适用于完全内生性肿瘤,但是对于肾门肾窦部肿瘤、边界不清的肿瘤、CRM和肾周皂化脂肪所致的肿瘤显露困难都拥有很好的定位效果,也大大降低了CRM肿瘤切除过程中破裂的风险。机器人辅助LPN的机械臂自由度高,滤除手颤后操作精准,裸眼3D影像清晰立体,应用于LPN有很大优势,已有相关报道提示术后肿瘤学结果良好[20]。
8.复杂CRM行LPN的策略:对于复杂CRM行LPN应采用个体化手术策略。术前应仔细研究影像学资料来明确肿瘤的位置及其与肾血管分支、集合系统的关系,从而制定出合理的手术方案,从手术入路、Trocar布局到显露、阻断、切除和缝合策略等各个环节都应考虑周全。对于较深的CRM,应常规术前逆行插管,术中可以准确判断集合系统破损位置并检验缝合可靠性。总之,术者可以灵活应用文中提及的各种技术来实现CRM的“三连胜”切除目标。
五、总结
CRM作为肾占位性病变的一个特殊类别,在诊断和手术技巧方面亦有其特殊性。最新的Bosniak分类标准更加细致和标准化,但其诊断效能还需实践检验。对于技术上可行的CRM应尽可能选择LPN,但要特别重视防止出现CR,应采用个体化手术策略。术者应全面掌握相关技术和策略,并积极使用最新的设备来提高手术效率,保障手术安全。必须重视术前评估、术中操作和术后管理的每个环节,才能最终实现“三连胜”的目标。
