青海湖裸鲤不同繁殖群体繁殖特性的比较研究*
2021-03-19谢振辉吕红健赵荣荣陈灵涵史建全祁洪芳姚维志
谢振辉 吕红健 付 梅 赵荣荣 陈灵涵史建全 祁洪芳 姚维志①
(1. 西南大学动物科技学院 西南大学渔业资源环境研究中心 国家贝类产业技术体系重庆综合试验站 重庆 400715;2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室 青岛市海水鱼类种子工程与生物技术重点实验室青岛 266071;3. 青海湖裸鲤救护中心 西宁 810016)
青海湖裸鲤(Gymnocypris przewalskii),又名湟鱼,属于高原裂腹鱼类,仅分布在青海湖及其水系(Tong et al, 2015)。青海湖裸鲤作为湖中特有的本土硬骨鱼类,是在青海湖的形成发展过程中经过长期演化的鱼种,是湖中唯一的经济鱼类,处于青海湖整个生态系统的核心地位(武云飞等, 1991; 王玉娇等,2014)。从20 世纪60 年代初~90 年代末,由于受到自然环境和人为因素的双重干扰,加之繁殖力低和生长缓慢的特性,导致青海湖裸鲤的资源量由开发利用前的6.9 亿尾降至不足0.25 亿尾(Tong et al, 2015; 蒋鹏等, 2009; 陈大庆等, 2011)。2004 年,青海湖裸鲤被《中国物种红色名录》收录并列为濒危物种(汪松等,2004)。进入21 世纪以来,青海湖裸鲤一直是当地政府和学者关注和重点保护的对象,并采取了封湖育渔、增殖放流和修设洄游通道等资源保护措施(史建全等, 2009)。仅2018 年,在青海湖沙柳河就投放裸鲤幼鱼(1 龄)约1100 万尾(未发表数据)。
青海湖位于海拔为3200 m 的青藏高原,是中国最大的半咸水湖泊。由于青海湖极端的水文环境,如高盐、低温、低溶氧和食物匮乏等,青海湖裸鲤的生长十分缓慢(Walker et al, 1995; 李吉均等, 1998),大约3 年才能达到性成熟的个体大小(张信等, 2005)。每年的5~7 月,性成熟的个体集群到青海湖周边各淡水支流进行产卵(Cao et al, 2009),一般根据洄游至淡水支流的不同,将其分为不同的产卵群体。Tian 等(2019)研究表明,这种季节性繁殖受到内在和外在信号的严格控制。目前,对青海湖裸鲤繁殖特性的研究,特别是针对不同繁殖群体间繁殖特性的比较研究仍然缺乏。此外,随着向湖区投放裸鲤幼鱼数量的逐渐增多,研究人员不得不考虑是否应该针对不同的繁殖群体采取不同的增殖措施,以便更加有效地养护其野生资源。
因此,本研究尝试比较不同繁殖群体的繁殖特性,包括性比(Sex ratio, SR)、生物学最小型(Biological minimum size, BMS)、性成熟系数(Gonadosomatic index,GSI)、绝对繁殖力(Total fecundity, Ft)和相对繁殖力(Relative fecundity, Fr),进而从繁殖生物学角度来验证不同繁殖群体的分化趋势,为不同青海湖裸鲤野生群体的资源养护措施,特别是增殖放流策略的优化提供基础数据。
1 材料与方法
1.1 样本采集
本研究自2017 年7 月~2018 年6 月,在青海湖的洱海、大湖、黑马河口、布哈河口、泉吉河口和沙柳河口6 处采样点,使用30 m 三层刺网共采集青海湖裸鲤样本295 尾,不同采样点青海湖裸鲤样本的基本信息见表1,各采样点设置见图1。性成熟青海湖裸鲤一般按照洄游河流进行分群,因此,采样点按照地理平均分布,且尽量采集河口繁殖群体的原则进行设置。
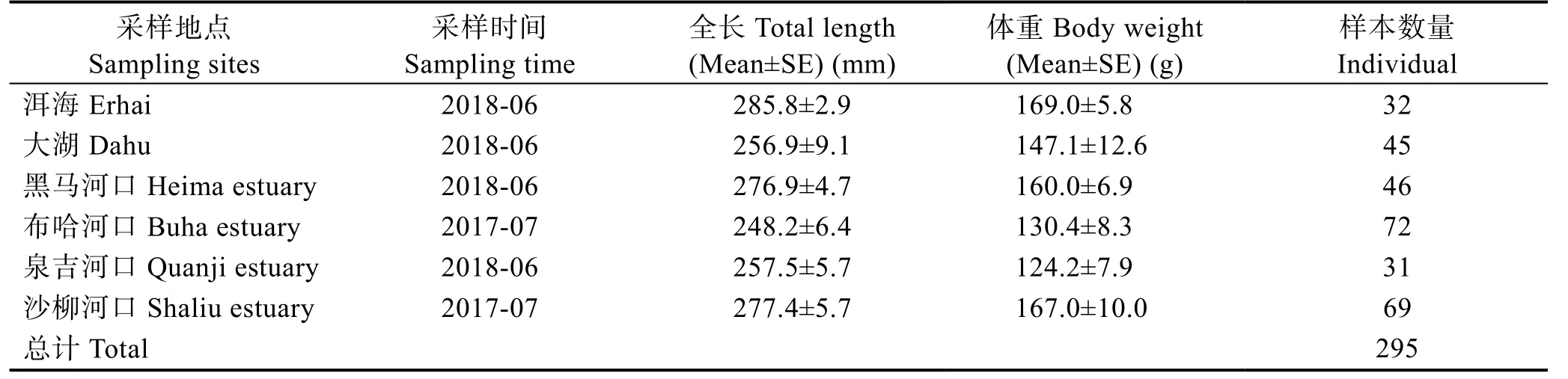
表1 不同采样点青海湖裸鲤的基本数据Tab.1 Basic data of G. przewalskii from different sampling sites
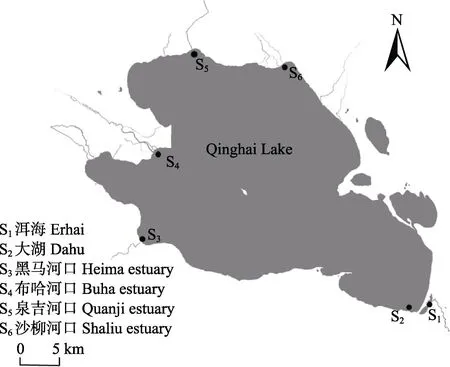
图1 青海湖裸鲤采样点示意Fig.1 Sampling sites of G. przewalskii in Qinghai Lake
1.2 样本处理
采样现场对鱼体样本进行体长、全长、体重、纯体重和性腺重等常规生物学测量,全长和体长精确到1 mm,体重、纯体重以及性腺重精确到0.1 g。样本鉴定性别并记录性腺发育时期后,使用10%福尔马林对雌性样本的卵巢进行固定,卵巢将用于后续繁殖力计算。本研究采用臀鳞作为年龄鉴别的材料(熊飞等,2006)。
1.3 数据处理
本研究中,SR 指在一个繁殖群体中,雌性个体数量与雄性的比值。BMS 指鱼类初次达到性成熟的最小体长或体重,称为生物学最小型。Ft指在繁殖季节,一个青海湖裸鲤雌性个体成熟卵巢(包括Ⅳ末和V期)中卵细胞的绝对数量。Fr是指一个雌性青海湖裸鲤的Ft与纯体重(Wp,即空壳重)的比值,即单位重量所含有的可能排出的卵子的数量,用公式表示如下:

样本GSI 由性腺重(Wg)与Wp的比值再乘100%得到:

数据使用Excel 2016 进行统计汇总。使用单因素方差(One-way ANOVA)分析不同采样点青海湖裸鲤的GSI、Ft和Fr。使用成对数据t 检验(Two-samples t test)比较同一采样点雌雄性样本间的GSI。使用0.05差异显著性水平,数据处理软件使用SPSS 23.0。
2 结果
2.1 性比
在采集的295 尾样本中,雌雄个体分别为195 尾和100 尾,SR(♀∶♂)为66.1%∶33.9%。单独分析不同繁殖群体的SR,大湖、黑马河口、布哈河口和沙柳河口繁殖群体的性比均大于 2 (♀∶♂),分别为71.1%∶28.9%、69.6%∶30.4%、72.2%∶27.8%和68.2%∶31.8%,4 个群体雌性个体数量是雄性的2 倍多;洱海繁殖群体的SR 略低,为56.3%∶43.7%,但雌性个体的数量仍多于雄性;然而,泉吉河口繁殖群体的SR 为45.1%∶54.9%,是唯一雌性个体数量小于雄性的繁殖群体(图2)。
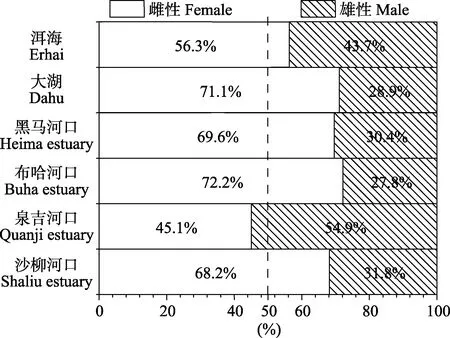
图2 青海湖裸鲤不同繁殖群体的性比Fig.2 Sex ratio of G. przewalskii from different spawning stocks
2.2 生物学最小型
本研究中,6 个繁殖群体的雌雄样本BMS 信息见表2,雌性的BMS 均大于雄性。从表2 可以看出,综合6 个繁殖群体的所有鱼体样本,雌性个体BMS 为5 龄,体长为157 mm,体重为42.5 g,为布哈河口采集样本;雄性个体BMS 年龄为4 龄,体长为124 mm,体重为24.5 g,为沙柳河口采集样本(表2)。其中,洱海群体雄性和雌性个体的BMS 均最大。
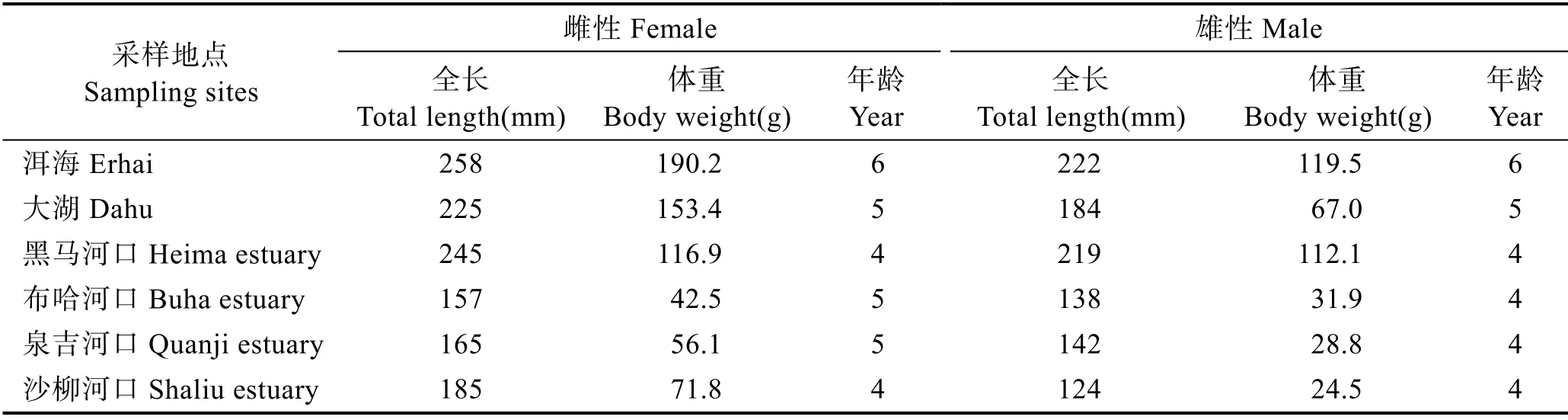
表2 不同采样点青海湖裸鲤的生物学最小型Tab.2 Biological minimum size of G. przewalskii from different sampling sites
2.3 性成熟系数
6 个繁殖群体的雌性个体平均GSI 为(15.48±0.49)% (Mean±SE),雄性为(6.92±0.32)% (Mean±SE)。不同群体内部雌性样本 GSI 均显著大于雄性样本GSI(P<0.05)。此外,沙柳河口雌性样本GSI 显著(P<0.05)大于洱海、大湖雌性样本的GSI,而与其他群体间差异不显著(P>0.05)(表3)。其中,沙柳河口雌性个体GSI 最大,为(19.67±1.36)% (Mean±SE),洱海群体GSI 最小,为(10.28±1.36)% (Mean±SE) (表3)。此外,本研究所有雄性群体 GSI 间差异不显著(P>0.05)(表3)。
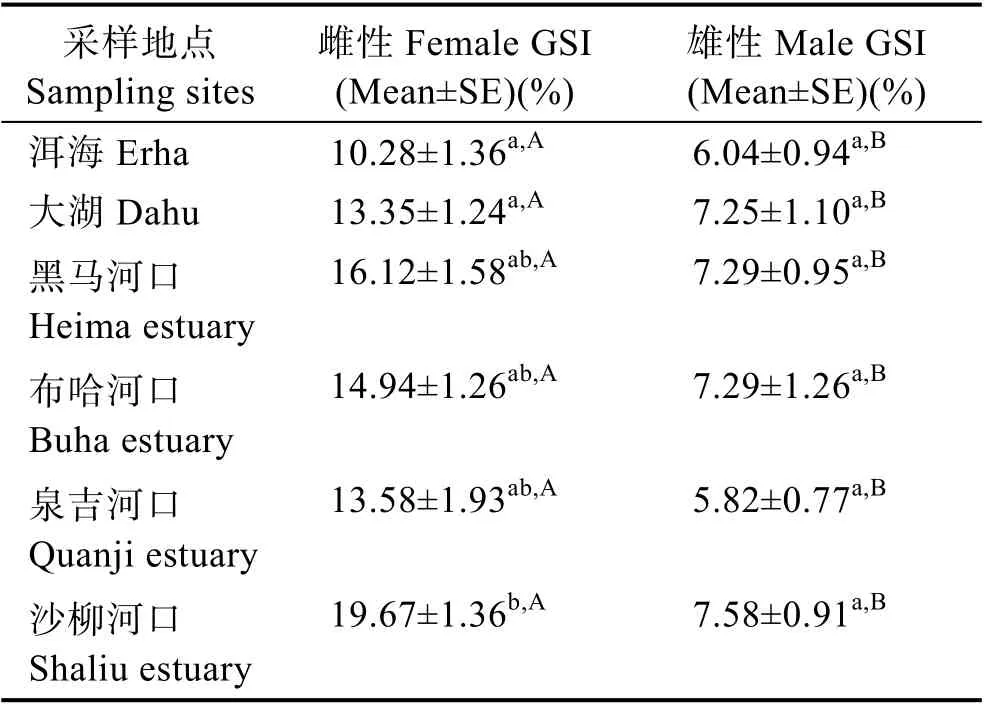
表3 不同采样点青海湖裸鲤的性成熟系数Tab.3 GSI of G. przewalskii from different sampling sites
2.4 绝对繁殖力和相对繁殖力
本研究中,所有青海湖裸鲤雌性样本的平均Ft为6910.94 粒,平均Fr为49.91 粒/g。其中,沙柳河口Ft为(10699.40±613.91)粒、Fr为(82.68±4.63)粒/g,均大于其他群体;黑马河口Ft为(3338.18±324.25)粒、Fr为(21.88±2.10)粒/g,均最小。沙柳河口繁殖群体Ft显著高于大湖、黑马河口、布哈河口与泉吉河口(P<0.05);泉吉河口和沙柳河口的Fr显著高于洱海、大湖、黑马河口与布哈河口(P<0.05)(表4)。
3 讨论
3.1 性比
SR 是鱼类种群结构的重要指标,其在一定程度上影响种群数量的变动,对于繁殖群体来说尤为重要(Alonzo et al, 2004)。赵利华(1982)研究表明,20 世纪60 年代和80 年代青海湖裸鲤种群性比(♀∶♂)分别为1.7∶1 和3.7∶1。史建全等(2000)调查发现,1997年和1998 年青海湖裸鲤的性比(♀∶♂)分别为1.4∶1 和1.9∶1。本研究所采集青海湖裸鲤总体性比(♀∶♂)为1.95∶1,雌性个体数量约为雄性个体的2 倍。本研究结果与历史数据一致,即青海湖裸鲤雌雄数量关系一直是雌性多于雄性,且与1998 年调查数据基本相同。
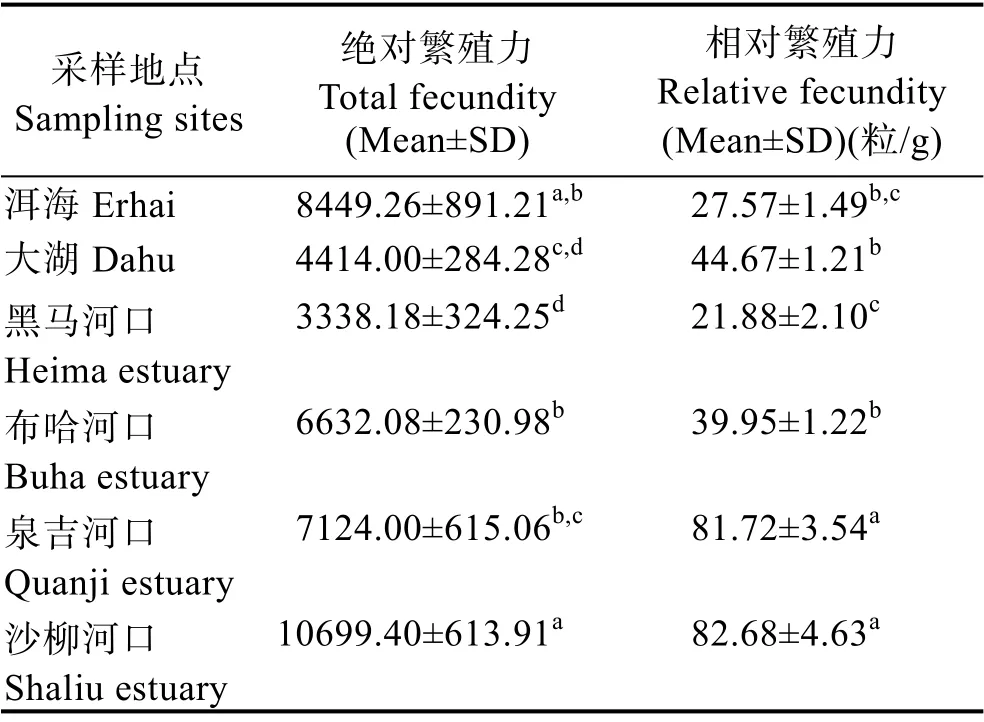
表4 不同采样点青海湖裸鲤的繁殖力Tab.4 Fecundity of G. przewalskii from different sampling sites
鱼类大多数是雌雄异体,行两性生殖(Brito et al,2003; Guimaraes-Cruz et al, 2005),在一个鱼类群体中,雄性个体的比例或数量偏大,可能会影响群体的结构和繁殖潜力(Ospina-Alvarez et al, 2008)。换句话说,在一个群体中,性别比例发生变化,雄性个体数量增加,群体的繁殖潜力会出现降低的趋势(Smith et al,2018)。本研究中,除泉吉河口繁殖群体外,其余繁殖群体的SR(♀∶♂)均大于1。基于以上理论,6 个繁殖群体的繁殖潜力从大到小依次为布哈河口>大湖>黑马河口>沙柳河口>洱海>泉吉河口。胡安等(1975)研究发现,在繁殖时期,青海湖裸鲤产卵场雄性个体数量要多于雌性,而在湖区雌性多于雄性,但总体上雌性个体数量多于雄性。因此,本研究中,不同采样群体间SR 的差异可能与采样地点和采样时间有关。此外,随着近年来青海湖裸鲤种群数量的迅速增长,也不应轻易排除不同繁殖群体间SR 差异是由群体分化引起的可能性。
3.2 生物学最小型
鱼类性成熟不仅与年龄有关,也与个体的大小有关(Aim, 1959; Stearns et al, 1986; 苏锦祥, 1980),鱼类即便是年龄达到了性成熟年龄,个体太小也不能性成熟。本研究中的青海湖裸鲤为重复产卵类型鱼类,综合本次调查6 个采样点的研究结果,雌性青海湖裸鲤BMS 的年龄为5 龄,体长为157 mm,体重为42.5 g;雄性BMS 的年龄为4 龄,体长为124 mm,体重为24.5 g。与陈大庆等(2006)的调查结果(雌性BMS 为170 mm,雄性BMS 为130 mm)相似,然而,却明显小于史建全等(2000)的调查结果(雌性BMS 为220 mm,雄性BMS 为190 mm)。因此,推断雌性和雄性青海湖裸鲤部分繁殖群体的初次性成熟体型,较20 世纪初仍然处于小型化阶段。
此外,本研究比较6 个繁殖群体的BMS 数据发现,不同群体雌雄个体的BMS 差异较大。鱼类的生长与其周围的生态因子息息相关,如温度、盐度、光照和饵料等(Borowsky, 1973; Sohn, 1977; 陈大刚,1997; 赵文, 2011)。本研究中,除洱海群体外,其余5 个群体分别位于5 条河流的河口处,水环境条件受河流的径流量、人类活动、降雨和冰川融化等影响较大,5 条河流的河口处水文条件差异较大。此外,洱海群体的雌雄性BMS 大于其他5 个群体。洱海作为位于青海湖东的一个淡水湖泊(王基琳等, 1986),由于周边人类活动较多,生活污水为水体带来丰富的营养盐,增加了洱海水体的初级生产力;另外,人类活动还间接减少了鸟类的捕食。上述因素均为洱海中青海湖裸鲤的生长创造了优良的环境条件,从而造成洱海中青海湖裸鲤BMS 大于其他群体的结果。
3.3 性成熟系数
GSI 是鱼体繁殖投入的一个重要指标,能够反映鱼类性腺发育程度和鱼体能量在性腺和躯体之间的分配比例(Smith et al, 2018)。本研究调查得到所有青海湖裸鲤雌性个体平均GSI 为15.48%,雄性样本仅为6.92%。这与张信等(2005)的调查结果类似,其青海湖裸鲤雌性个体平均 GSI 为 18.95%,雄性为7.02%,即雌性卵巢的 GSI 要远大于雄性精巢的GSI(殷名称, 1995)。
Brewer 等(2008)研究表明,仅仅通过GSI 来分析鱼类的繁殖周期是片面的,因为不同繁殖策略的种群内部和种群间的GSI 存在差异。本研究首次对不同产卵群体间的GSI 进行了比较,结果表明,不同群体内部雌性个体GSI 显著大于雄性个体(P<0.05)。除洱海、大湖2 个群体外,其他4 个群体雌性GSI 均是雄性的2 倍多。这种现象体现了在繁殖期间亲鱼将能量主要分配给卵巢,使卵黄足够沉积,以保证受精卵发育成为仔鱼(殷名称, 1995)。
此外,不同群体之间,沙柳河口雌性个体GSI显著大于洱海和大湖渔场(P<0.05),而与其他群体之间无差异(P>0.05)。各群体雄性个体 GSI 无差异(P>0.05)。研究表明,影响硬骨鱼类性成熟的环境因素不是单独存在的,而是相互作用的结果(殷名称,1995),且部分环境因素的作用机制尚不清楚(温海深等, 2001)。推测环境差异是造成不同雌性群体GSI 出现差异的外源性因素,如温度和盐度(Louiz et al, 2009)。Brewer 等(2008)指出,鱼类的生长状况可能会影响GSI 的大小,因为性腺的重量取决于体重,即性腺重和体重不一致,就会使得GSI 值出现偏差(Hails et al,1982)。总之,青海湖裸鲤雌性群体之间GSI 的差异可能与环境以及鱼类的生长状况有关,但也不排除本研究未提到的外源性和内源性因素导致的差异,而雄性个体GSI 无差异可能是因为雄性个体受环境制约较少所致(温海深等, 2001)。
3.4 繁殖力
鱼类的繁殖力体现了物种或种群对环境变化的适应性(Levanduski et al, 1988),青海湖裸鲤的繁殖能力较弱,熊飞(2003)与张霞等(2018)研究表明,这与其极端的生存环境有关。本研究采集所有青海湖裸鲤的Ft平均为6910.94 粒,Fr平均为49.91 粒/g。此结果高于秦桂香等(2001)调查得到的青海湖裸鲤Ft为4407 粒、Fr为28.11 粒/g,同时,也高于熊飞(2003)统计得到的青海湖裸鲤的Ft为4337.81 粒、Fr为27.09粒/g 的研究结果。此外,此研究结果与20 世纪60 年代调查数据相比,Ft明显低于当时的16242 粒,而Fr却高于当时的28.75 粒/g(胡安等, 1975)。基于鱼类随着年龄和体重的增加,而Fr会降低的理论(Murua et al,2003; Cakmak et al, 2018),推测青海湖裸鲤呈现个体小型化的趋势,这一结论与BMS 的结果一致。
本研究结果显示,6 个群体间Ft和Fr存在不同程度的差异。沙柳河口的Ft和Fr均最大,分别为(10699.23±613.91)粒和(82.68±4.63)粒/g;黑马河口最小,分别为(3338.18±324.25)粒和(21.88±2.10)粒/g,且二者的Ft和Fr均存在显著差异(P<0.05)。Ganias(2013)提出,鱼类不同群体的繁殖模式选择主要受其生境的影响。据此推断,6 个繁殖群体的Ft和Fr的差异,有可能是其生存环境的差异所引起的(Witthames et al, 1995),但也不排除繁殖策略(Brewer et al, 2008)以及个体大小不同(Kjesbu et al, 1996、1998)等因素的作用。此外,张春霖等(2005)与王朝溪等(2015)对青海湖裸鲤遗传多样性的研究表明,不同繁殖群体具有固定的洄游模式以及交配对象。据此推断,不同青海湖裸鲤群体间繁殖力的差异也可能是由不同群体遗传特性的差异所引起的,此推论有待进一步验证。
进入21 世纪以来,随着封湖育渔、增殖放流和修设洄游通道等资源保护措施的实施,青海湖裸鲤的资源量迅速增加。但是,青海湖裸鲤的个体小型化的问题仍然存在。此外,不同繁殖群体的SR、BMS、GSI、Ft和Fr均存在不同程度的差异。以上研究结果均从繁殖生物学角度证明了不同繁殖群体间出现了分化趋势或已经分化。不难推测这一分化趋势,会随着青海湖裸鲤资源量的进一步增加,以及青海湖面积的进一步扩大,将愈加明显。这一研究结论也有待从分子生物学角度进行印证。此外,青海湖中不同群体之间个体的迁移对不同群体繁殖特性的影响,也应作为未来青海湖裸鲤研究的一个重要部分。综上所述,在保护和扩大青海湖裸鲤产卵场的同时,封湖育鱼和增殖放流政策应该继续实施,但对青海湖裸鲤资源量的保护,应“分群”进行,即针对青海湖中不同群体制定不同的渔业资源保护措施和增殖放流策略。最后,为了更好地了解和评价青海湖裸鲤繁殖特性差异的原因,还需要进行更多的遗传学和组织学方面的研究。
