坛紫菜泛素连接酶PhCUL1 基因克隆与功能验证*
2021-03-19林键章王文磊纪德华陈昌生谢潮添
林键章 王文磊 徐 燕 许 凯 纪德华 陈昌生 谢潮添
(农业农村部东海海水健康与养殖重点实验室 福建省水产生物育种与健康养殖工程研究中心集美大学水产学院 厦门 361021)
紫菜是一类具有重要经济价值、营养价值和生态价值的大型海藻,不仅可以食用,还被广泛用作肥料、药物和化学物质的来源(Blouin et al, 2011),而且作为“蓝碳”物种和生物燃料,具有巨大的潜力(Nellemann et al, 2009; Xu et al, 2016)。经估算,大型海藻每年可固定约173 Tg 的碳,并作为碳供体将90%固定的碳输送至深海,其余则埋藏在沿海沉积物中,该估算值超过沿海生境中被子植物的碳埋藏估值(Krause-Jensen et al, 2016、2018),表明大型海藻在固碳方面有着巨大潜力。此外,由于紫菜等大型海藻含有较高的结构多糖和低木质素、不占用耕地等原因,其为生物燃料的优质原料(Ghadiryanfar et al, 2016; Sudhakar et al,2018)。Duarte 等(2017)指出,养殖海藻全部用于生物燃料生产,每平方千米养殖海藻每年可减少1500 t CO2排放。2018 年,我国栽培紫菜产量超过201779 t(干重),占养殖海藻产量的8.6%,其中,以坛紫菜(Pyropia haitanensis)为主要栽培对象的福建省紫菜产量已超过 74628 t (干重)(中国渔业统计年鉴,2019),带来了可观的经济效益和生态效益。
然而,近年来,随着全球气候变暖,温度成为限制紫菜产业发展的主要因素(陈伟洲等, 2015; Wang et al, 2018)。尽管一些坛紫菜耐高温品系(Z-26、Z-61和 ZS-1)已广泛栽培(Chen et al, 2008; Yan et al,2010),但有关坛紫菜的耐高温机制仍然知之甚少。因此,阐明坛紫菜的耐高温机制对耐高温品系的选育具有重要意义。目前,对于坛紫菜耐高温机制的研究主要集中在比较组学分析,例如,Wang 等(2018)比较了Z-61 和野生型坛紫菜的转录组,发现Z-61 可以通过更为积极的转录调节抵御高温环境。Shi 等(2017)使用iTRAQ 技术在坛紫菜中鉴定了151 种应激反应蛋白,其中,参与清除未折叠蛋白或变性蛋白的泛素蛋白酶体系统在坛紫菜应答高温胁迫过程中显著上调表达,但其具体功能有待进一步验证。
泛素蛋白酶体系统是最重要的胁迫响应系统之一,通过降解受损或多余的蛋白质来维持细胞中蛋白质的平衡。泛素化过程由3 种酶介导:E1(泛素激活酶,UBA);E2(泛素结合酶,UBC);E3(泛素连接酶)(Zhang et al, 2015)。其中,E3 连接酶识别配体蛋白并决定蛋白质降解的高特异性,因此,在泛素化过程中起关键作用。许多研究表明,E3 是植物响应非生物胁迫的“调节剂”,甚至单个E3 可以调节植物响应多重非生物胁迫(Moin et al, 2019)。Cullin-RING 连接酶是真核生物中被广泛研究的多亚基E3 连接酶,在植物中有3 种类型:CUL1、CUL3a/b 和CUL4 (Stone,2014)。CUL3 可以促进DREB2A 的降解来提高拟南芥(Arabidopsis)的耐热性(Morimoto et al, 2017)。此外,水稻Cullin 家族基因在应对非生物胁迫时呈现上调表达的趋势(Moin et al, 2019)。以上结果说明,Cullin E3 连接酶可能在植物响应非生物胁迫中发挥重要作用。本实验室在前期研究中发现,坛紫菜的CUL1 基因也积极响应高温胁迫(Wang et al, 2018),但其具体功能有待进一步实验验证。
由于坛紫菜的特殊结构及缺乏启动子和转化方法等问题,目前尚未在坛紫菜中建立一套稳定的遗传操作体系,对这些候选基因和蛋白的功能还不明确。莱茵衣藻(Chlamydomonas reinhardtii)作为一种真核单细胞绿藻,被广泛用于验证基因的功能和基本的生物学进程。同时,随着基因工程技术的发展,已开发出一些可应用于莱茵衣藻的遗传操作技术,包括核转化、叶绿体和线粒体转化系统(Dejtisakdi et al, 2016)。到目前为止,许多异源基因已在莱茵衣藻中成功表达,包括微藻Chlorella zofingiensis (Cordero et al,2011)和大型海藻Porphyra seriata (Kim et al, 2011)。Jin 等(2017)成功将甘紫菜(Pyropia tenera)HSP19.3 转入莱茵衣藻,并证实了其在耐热方面的作用。以上结果表明,莱茵衣藻可能是表达坛紫菜基因的良好载体。因此,本研究将坛紫菜的PhCUL1 基因转入莱茵衣藻进行耐热性分析,探究坛紫菜泛素连接酶(PhCUL1)在抗高温中的作用,为坛紫菜耐高温品系的选育提供基因信息。
1 材料与方法
1.1 实验材料培养
本实验所选用的坛紫菜耐高温品系Z-61 由集美大学坛紫菜种质改良和应用实验室选育和纯化。培养条件:温度(21±1)℃,光照强度50~60 μmol/(m2⋅s),光周期12 L∶12 D,每2 d 更换1 次新鲜的Provasoli's enrichment solution (PES)培养液,并充气培养。培养藻体长度至15 cm 左右时,选取表面光滑、无破损、无扭曲的健康藻体进行后续实验。
莱茵衣藻细胞壁缺失株系“CC-400 cw15 mt+”被用于PhCUL1 转基因功能验证。莱茵衣藻细胞在Trisacetate-phosphate (TAP)培养液中培养:温度25℃,光照强度50 μmol/(m2⋅s),光周期14 L∶10 D。每隔2 h 轻摇1 次培养液,防止细胞贴壁生长。
1.2 总RNA 的分离纯化和cDNA 的合成
采用E.Z.N.A 植物RNA 提取试剂盒(OMEGA,德国)提取坛紫菜和莱茵衣藻的总RNA。使用1%凝胶电泳检测所提取总RNA 的完整性,并在紫外分光光度计上分别测定OD260nm和OD280nm值,计算出RNA的浓度,判断其纯度。
用于实时荧光定量PCR 分析的cDNA 用PrimeScript RT reagent kit (TaKaRa)进行反转录,合成的cDNA 稀释10 倍备用。
1.3 坛紫菜PhCUL1 基因的全长克隆
根据坛紫菜转录组的注释结果,筛选出一条注释结果为脐形紫菜(Porphyra umbilicalis) CUL1 的Unigene0010232。根据序列设计1 对扩全长引物(正向引物加KpnⅠ酶切位点序列,反向引物加XbaⅠ酶切位点序列,便于后续实验) PhCUL1F 和PhCUL1R(表1),PCR 扩增PhCUL1 基因的保守序列,预期长度为2481 bp;扩增体系为25 μl:2×Mix 12.5 μl,ddH2O 9.5 μl,每条引物0.5 μl,cDNA 模板2 μl。PCR扩增程序:95℃变性5 min;95℃ 40 s;62℃ 30 s;72℃ 2 min 30 s,35 个循环;72℃,延伸10 min。将扩增产物割胶回收、转化和测序,验证全长克隆的正确性。

表1 实验用到的引物名称和序列Tab.1 Primers and sequences used in this experiment
1.4 PhCUL1 基因的生物信息学分析
使用在线软件NCBI(http://www.ncbi.nlm.nih.gov)分析PhCUL1 基因核苷酸序列,推导氨基酸序列和开放阅读框(ORF)。通过 SMART (http://smart.emblheidelberg.de/)来识别保守结构域。使用MEGA6 软件的Neighbor-Joining 法构建PhCUL1 系统进化树。
1.5 PhCUL1 衣藻表达载体构建
使用KpnⅠ和XbaⅠ内切酶双酶切目的基因和衣藻表达载体V3,载体图谱见图1。酶切体系:目的基因2 μg,10×M 缓冲液3 μl,KpnⅠ内切酶1 μl,XbaⅠ内切酶1 μl,用ddH2O 补足体系。V3 载体1 μg,10×M 缓冲液2 μl,KpnⅠ内切酶1 μl,XbaⅠ内切酶1 μl,用ddH2O 补足体系。酶切程序:37℃,140 min,65℃,10 min。将酶切后的基因和V3 载体16℃过夜连接,转化和涂板。挑取阳性菌落进行PCR 验证,获得含有目的基因的V3 衣藻表达载体。
1.6 莱茵衣藻核转化
莱茵衣藻核转化采用“玻璃珠转化法”。莱茵衣藻“CC-400 cw15 mt+”在TAP 培养液中培养至对数生长期(细胞数约为2×106个),室温6000 r/min 离心5 min,弃上清液,倒置1 min。用300 μl TAP 培养液重悬细胞,加入到含300 mg 灭菌并烘干的玻璃珠的2 ml 离心管中,再加入0.1 ml 20% PEG 6000,2 μg 线性重组载体,5 μl 鲑鱼精DNA。置于漩涡振荡器上震荡30 s,停歇30 s,重复2 次。把混合液加入到40 ml新鲜TAP 培养液,在100 r/min 摇床过夜培养。室温6000 r/min 收集细胞,去上清液,用400 μl TAP 培养液重悬细胞,混匀后倒在TAP 平板上(含10 μg/ml 潮霉素B),24℃光照培养7~10 d,平板上长出单个克隆藻。
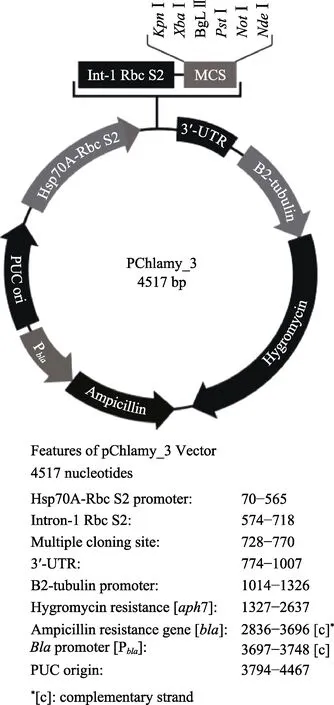
图1 衣藻表达载体V3 图谱Fig.1 V3 expression vector of C. reinhardtii
1.7 PhCUL1 基因表达水平的qPCR 分析
根据PhCUL1 的序列,设计qPCR 正反向引物,并以 β-tubulin 基因作为内参(表 1),进行高温下PhCUL1 在莱茵衣藻中的表达水平分析。20 μl 体系:10 μl 2×SYBR green Master Mix(TaKaRa, 日本),0.4 μl正反向引物(20 mmol/L),2 μl 稀释模板,0.4 μl ROX Dye 和6.8 μl ddH2O。扩增程序:95℃ 30 s,95℃ 5 s,60℃ 31 s,40 个循环。循环结束后,检查扩增的熔解曲线,确保扩增的特异性。荧光定量PCR 扩增在ABI7300 型定量PCR 仪(Applied Biosystems, 美国)上进行。
1.8 数据统计分析
所有实验均设置3 个重复。利用Excel 和SPSS 17.0 对实验数据进行统计分析,并采用单因素方差分析(One-way ANOVA)和最小显著差异法(LSD)比较不同数据组间的差异,P<0.05 表示存在显著差异,P<0.01表示差异极显著。
2 结果
2.1 PhCUL1 基因的克隆及序列分析
以坛紫菜cDNA 为模板,PhCUL1F/PhCUL1R 为引物进行扩增,获得1 条扩增条带,长度约为2500 bp(图 2a)。通过 BLAST 比对发现,其与 Porphyra umbilicalis (GenBank No.: OSX79849.1)的cullin-1 基因核酸序列同源性达到85.14%,进而推断该片段为PhCUL1 的基因片段。

图2 PhCUL1 基因克隆产物凝胶电泳和保守结构域Fig.2 Agarose electrophoresis of PCR products of PhCUL1 gene and protein domain analysis of PhCUL1
通过ORF Finder 软件分析发现,PhCUL1 基因的ORF 为2481 bp,起始密码子为ATG,终止密码子为TGA,编码827 个氨基酸,预测分子量为91.34 kDa,理论等电点为6.43。通过SMART 分析其保守结构域,发现PhCUL1 存在1 个Cullin (407~618 aa) 结构域和1 个Cullin Nedd8 (754~821 aa)结构域(图2b)。
2.2 PhCUL1 基因系统进化树分析
为了确定PhCUL1 的系统进化关系,采用Neighbor-Joining 法构建了PhCUL1 氨基酸序列系统进化树。进化树结果显示(图 3),PhCUL1 与红藻门角叉菜(Chondrus crispus)、龙须菜(Gracilariopsis chorda)和脐形紫菜(Porphyra umbilicalis)聚为一侧,而与高等植物明显区分开来,这说明PhCUL1 基因在红藻门中较为保守。而在红藻门中,PhCUL1 与脐形紫菜聚为一支,这说明PhCUL1 基因在紫菜中较为保守。
2.3 PhCUL1 基因在高温胁迫下的差异表达变化

图3 采用NJ 法构建的基于PhCUL1 基因所编码氨基酸序列的系统进化树Fig.3 Phylogenetic tree based on PhCUL1 amino acid sequences by NJ method
为了研究坛紫菜PhCUL1 对高温胁迫的响应,本研究采用荧光定量PCR 技术检测PhCUL1 基因在高温31℃处理不同时间水平(0、3、6、12 和24 h)下的相对表达水平变化。结果显示(图4),高温对PhCUL1基因表达水平有显著影响,高温处理3 h,PhCUL1的表达量是0 h 的11 倍;高温处理6 h 和12 h,表达水平较之于高温处理3 h 有所下降,但显著高于0 h,其表达量分别是0 h 的5.1 倍和8.0 倍。高温处理24 h后,PhCUL1 的表达量达到最高值,是0 h 的16.9 倍。

图4 坛紫菜PhCUL1 基因在高温31℃胁迫过程中相对表达变化Fig.4 The relative expression of PhCUL1 gene in P. haitanensis under 31℃ treatment
2.4 转PhCUL1 莱茵衣藻阳性克隆子的筛选
随机挑选8 个潮霉素B 抗性品系的衣藻,提取DNA,使用PhCUL1 特异引物(表1)进行PCR 验证。琼脂糖凝胶电泳结果显示,所有挑选出的衣藻都检测到阳性PCR 产物,但在野生型品系中未发现阳性克隆,表明PhCUL1 基因已成功转入衣藻基因组(图5)。选择第4 个转基因品系(T4)进行后续功能分析。
2.5 转PhCUL1 衣藻对高温胁迫的耐受性分析
为了研究转基因衣藻对高温胁迫的耐受程度,在33℃下培养野生型和转基因衣藻36 h,每天观察其生物量(图6),并测定其在750 nm 的吸光度(表2)。结果显示,高温33℃胁迫12 h 后,转基因衣藻(T4)的生物量高于野生型衣藻(WT)。高温33℃胁迫36 h 后,转基因衣藻(T4)的生物量明显高于野生型衣藻(WT)。相应的OD750nm也与此结果吻合(表2)。

图6 高温33℃胁迫下衣藻的生物量变化Fig.6 Biomass of C.reinhardtii under 33℃ treatment
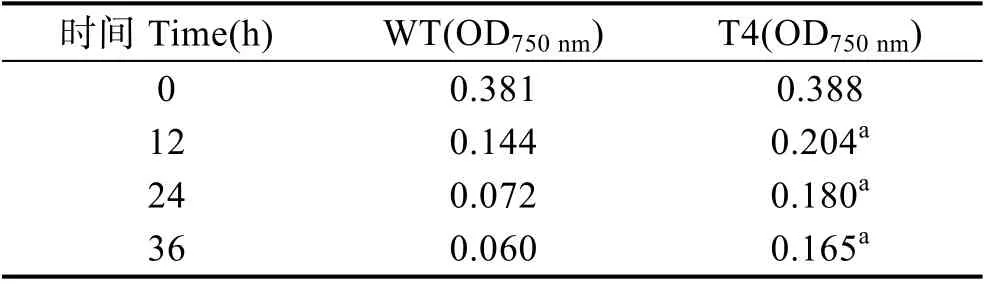
表2 高温33℃胁迫下衣藻浓度的变化Tab.2 Concentration of C. reinhardtii under 33℃ heat stress
2.6 PhCUL1 基因在莱茵衣藻中的差异表达变化
高温33℃胁迫1~6 h 后,PhCUL1 基因的表达水平显著升高(P<0.05)(图7),且在胁迫3 h 时,基因的表达水平最高,约为对照组的3 倍。胁迫9 h后,PhCUL1 表达水平下降,与对照组无显著差异。

图7 高温33℃胁迫下PhCUL1 基因在莱茵衣藻中的相对表达水平Fig.7 The relative expression level of PhCUL1 gene in C. reinhardtii under 33℃ treatment
3 讨论
温度是影响紫菜产业发展的一个主要因素。近年来,频繁出现的秋季高温回暖天气严重影响了坛紫菜栽培工作的有序开展,水温过高导致坛紫菜幼苗或成菜发生病烂,造成严重减产(陈玉婷等, 2015)。进一步研究坛紫菜的耐高温机理对于快速选育耐高温品系具有重要的理论意义。前期研究已证实,泛素系统在响应高温、高盐和干旱等非生物胁迫中扮演着重要角色(Zhang et al, 2015)。其中,E3 连接酶因其决定靶蛋白的特异性而被广泛研究。Cullin-RING E3 连接酶是真核生物中一个被充分研究的基因家族,Cullin 蛋白一般含有1~3 个结构域(Moin et al, 2019)。本研究克隆获得的坛紫菜PhCUL1 基因含有2 个保守结构域,407~618 位点是cullin 结构域,754~821 位点是Cullin Nedd8 结构域。其中,Nedd8 结构域是蛋白融合位点,它能赋予cullin E3 泛素连接酶活性(Hori et al,1999),表明PhCUL1 也可能具有泛素连接酶活性,Nedd8 是PhCUL1 介导泛素连接酶活性的体现。
已有大量文献报道和证据表明,cullin 家族基因可以积极响应非生物胁迫。例如,Moin 等(2019)在研究水稻的逆境胁迫表达谱时发现,水稻cullin 家族基因在多种逆境胁迫下上调表达。本研究也分析了坛紫菜PhCUL1 基因在高温胁迫下的表达模式。研究结果显示,在高温31℃胁迫下,PhCUL1 基因在不同时间点均呈现上调表达趋势;高温胁迫 3 h 时,PhCUL1 基因的表达量是0 h 的11 倍,说明PhCUL1基因对高温胁迫反应非常迅速,短时间内可以大量积累表达;随着胁迫时间的延长,PhCUL1 基因的表达量有所下调,但仍然高于0 h,高温胁迫6 h 和12 h的PhCUL1 基因表达量分别是0 h 的5.1 倍和8.0 倍;当胁迫时间持续到24 h 时,PhCUL1 仍然处于高表达状态,其表达量是0 h 的16.9 倍。以上结果表明,PhCUL1 在高温胁迫过程中均上调表达,可能是坛紫菜响应高温胁迫的一个关键基因,但具体功能需进一步验证。
随着基因工程技术的发展,许多研究人员利用遗传操作手段对E3 连接酶的功能进行了验证。Peng 等(2019)发现,过表达拟南芥E3 连接酶AtPUB48 可以增强拟南芥种子发芽和幼苗生长阶段的耐热性。此外,过表达水稻E3 连接酶OsHIRP1 使水稻在高温下具有比对照组更高的萌发率(Kim et al, 2019)。然而,有关E3 连接酶基因在大型海藻抗逆过程中发挥的具体功能尚未发现报道。本研究在莱茵衣藻中转入PhCUL1 基因来研究其耐热功能。qRT-PCR 结果显示,高温33℃胁迫下转基因衣藻的PhCUL1 基因显著上调表达,表明该基因能被高温胁迫诱导。生理实验结果显示,在持续的高温胁迫下,转基因衣藻比野生型具有更高的存活率,证明PhCUL1 基因可能通过维持蛋白稳态调控了坛紫菜的耐热过程。当然,一个机体对非生物胁迫的调控机制是非常复杂的,至于PhCUL1 基因是如何在这个复杂的网络中起作用,还有待进一步研究。
4 结论
本研究成功克隆了坛紫菜的泛素连接酶PhCUL1基因,而且该基因被高温显著诱导。转入PhCUL1 基因的莱茵衣藻也比野生型衣藻具有更强的耐热性,证明了PhCUL1 基因的耐热功能。这为坛紫菜耐高温机制的解析提供了有用的基因信息,也为耐高温品系的培育奠定了理论基础。
