林可霉素和3种大环内酯类抗生素对厌氧消化的影响
2021-03-19张艺蝶朱雯喆何莹莹
谢 丽,张艺蝶,朱雯喆,何莹莹
(1.同济大学长江水环境教育部重点实验室,上海 200092;2.同济大学环境科学与工程学院,上海 200092)
当前中国抗生素产量总体规模已达世界第一,同时也是抗生素使用大国。据统计,我国抗生素年使用量约为15~20万吨,在医疗、畜禽和水产养殖等行业中发挥了重要作用[1]。红霉素、阿奇霉素、螺旋霉素属于大环内酯类抗生素,被公认为是具有高毒性、高持久性以及生物累积潜力的抗生素[2]。林可霉素是除了头孢菌素以外在中国消耗量最大的抗生素,与大环内酯类是一类结构不同但功能相近的药物[3]。4 种抗生素在养殖废水和地表水环境中的残留水平和被检出频率较高。在贵阳南阳河及广东东莞地表水水库检出较高浓度的红霉素和林可霉素,养殖废水中检出的螺旋霉素在环境中也具有高风险生态等级[4-6]。在合成阿奇霉素的制药废水中,阿奇霉素和红霉素浓度均较高[7]。环境中4 种抗生素残留已成为普遍现象,导致环境中的抗生素耐药基因增长,从而对生态环境造成潜在的风险[8]。
制药废水及养殖废水中有机物浓度较高,厌氧生物处理技术作为一种高效的有机废水处理工艺,近年来在抗生素制药废水处理等方面应用广泛[9]。厌氧消化中微生物菌群对环境敏感,一定量的抗生素对水解产酸、产氢产乙酸和产甲烷阶段的特性及微生物群体有着不同程度的影响,从而扰动厌氧消化的效率和稳定性[10-11]。因此,针对环境样本中常检出的3 种大环内脂类抗生素(红霉素、螺旋霉素、阿奇霉素)以及林可霉素,从其理化特性出发,阐述了上述抗生素对厌氧消化产酸、产甲烷代谢过程和微生物群落结构的影响以及4种抗生素厌氧生物降解的机理,期望为后续进一步提升厌氧消化对废水中林可霉素和大环内脂类抗生素污染防治工艺研究提供理论依据和实际支撑。
1 大环内酯类抗生素及林可霉素的理化特性
表1总结了4种抗生素的物理及化学特性,数据信息来源于MSDS(Material Safty Data Sheet)。

表1 3种大环内酯类抗生素(红霉素、螺旋霉素、阿奇霉素)和林可霉素的物理及化学特性Tab.1 Physical and chemical properties of three macrolide antibiotics(erythromycin,spiramycin,azithromycin)and lincomycin
大环内酯类抗生素是一类分子结构中具有12~16个碳内酯环的抗菌药物的总称,属于广谱抗生素。通过阻断50S核糖体中肽酰转移酶的活性来抑制细菌蛋白质的合成,广泛应用于需氧革兰氏阳性菌和阴性菌、某些厌氧菌以及军团菌、支原体、衣原体等感染的治疗[12]。林可霉素的作用机制与大环内酯类抗生素相似[13],也能不可逆地结合到细菌核糖体50S 亚基上,通过阻断转肽作用和mRNA 位移抑制细菌蛋白质合成[14]。4 种抗生素的化学结构式如图1所示。
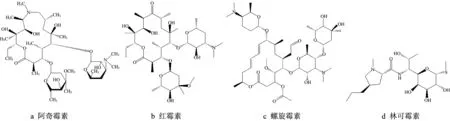
图1 化学结构式Fig.1 Chemical structural formulae
3 种大环内酯类抗生素和林可霉素的物理及化学特性如表1所示。4种抗生素存在不同的辛醇-水分配系数(logKow)。螺旋霉素、阿奇霉素和林可霉素的logKow为0.53~1.46,具有较高的水溶性,而红霉素的logKow最大,为3.06,较易被有机相或污泥吸附。也有学者采用抗生素在污泥固液相中的分配系数Kd来表征抗生素在污泥相-污水相之间的迁移,红霉素和阿奇霉素在城市污水处理中的Kd值分别为48.1~124.1 L·kg-1和265.1~1 584.9 L·kg-1,阿奇霉素比红霉素更容易吸附在污泥中[15-16]。4种抗生素在水相和固相中的吸附平衡和转化,在一定程度上影响抗生素的去除,因此未来可以进一步结合上述抗生素在污泥-污水中的Kow和Kd值,探究抗生素在厌氧消化系统中的去除机理。
2 典型废水中林可霉素及3 种大环内酯类抗生素的浓度分布
2.1 典型废水中浓度分布
3 种大环内酯类抗生素和林可霉素涉及的废水主要包括制药废水、养殖废水、医疗废水和市政废水。表2 总结了典型废水中4 种抗生素的质量浓度分布,其中制药废水的抗生素质量浓度最高。如表2所示,林可霉素和3 种大环内脂类抗生素质量浓度高达41~87 mg·L-1。养殖废水中4 种抗生素的质量浓度存在较大差异,林可霉素质量浓度最高达到3 mg·L-1,是其余3 种质量抗生素质量浓度的100~200倍,这可能与林可霉素在养殖业中的使用频率高有关。另一方面,红霉素、螺旋霉素和林可霉素化学结构稳定,传统污水处理工艺难以降解,城市污水厂对其总体去除率低[2]。城市污水处理厂是抗生素流入环境的“热点”[2,17],不同城市污水处理厂进水中也检出4 种抗生素,并且发现出水中红霉素、螺旋霉素、林可霉素检出浓度均有升高。上述抗生素在不同来源废水中质量浓度差异较大,达μg·L-1或ng·L-1水平,属于广泛的环境污染物。
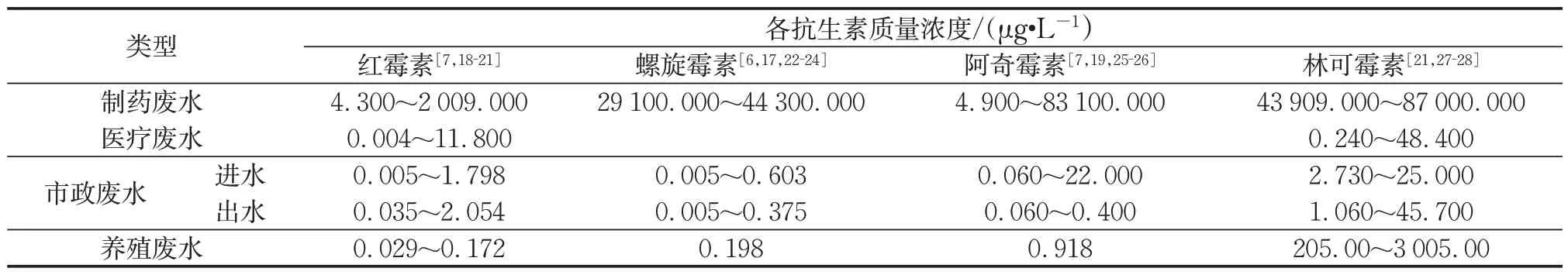
表2 典型废水中3种大环内酯类抗生素(红霉素、螺旋霉素、阿奇霉素)和林可霉素的质量浓度分布Tab.2 Mass concentration distribution of three macrolide antibiotics(erythromycin,spiramycin,azithromycin)and lincomycin in typical wastewater
2.2 典型废水中抗性基因分布
典型废水中上述抗生素的高残留浓度也会促进环境中抗性基因的累积,导致微生物抗药性增强。研究人员在城市污水处理厂活性污泥中筛选出红霉素抗性基因ermA,但是该基因并未在进水中检出[29]。大量的阿奇霉素抗性基因mphA、mphE、ermB和ermE在克罗地亚污水处理厂出水中检出[19]。此外,在医疗废水出水受纳地表水中也检测到大环内酯类抗性基因ermB和mefA[30]。同时,抗性基因ermA和ermB在林可霉素好氧堆肥菌渣中也有检出[27]。抗性基因的累积也伴随着微生物耐药性的大幅度上升,从而增加了微生物产生抗药性的机率。研究发现,城市污水二级处理工艺出水、阿奇霉素制药废水均检出高频率耐抗生素细菌,如肠球菌等[7,31]。因此,针对典型废水中的4种抗生素的削减十分必要。
3 林可霉素和3 种大环内酯类抗生素对厌氧消化的影响
3.1 厌氧消化产沼气
表3 总结了上述抗生素对污水-污泥厌氧消化产沼气性能的影响。由于厌氧消化体系中基质、污泥来源、温度等条件的不同,同一种抗生素对体系产甲烷的抑制浓度存在差异[32-33]。如表3所示,50 mg·L-1的红霉素对中温厌氧产甲烷的抑制率(IMP)为11.6%,质量浓度进一步提升至250 mg·L-1,几乎停止产甲烷[34-36]。然而,在高温厌氧消化体系中,红霉素质量浓度25 mg·L-1时即可抑制甲烷产生[37]。也有研究者发现,15 mg·L-1的红霉素可以促进甲烷产量提高33.3%[38-39]。阿奇霉素对厌氧产甲烷作用的影响与红霉素相似。0.02~0.60 mg·L-1的阿奇霉素对中温厌氧消化产甲烷无影响,提高质量浓度至5~15 mg·L-1时阿奇霉素促进体系产甲烷提高97.8%~200.0%;然而,进一步提高质量浓度至50 mg·L-1时阿奇霉素强烈抑制厌氧消化产甲烷,抑制率为71.4%[38-40]。可见,红霉素和阿奇霉素对厌氧消化产甲烷在低浓度时具有一定的促进作用,在高浓度时有制约作用,并且在高浓度时对厌氧消化产甲烷的抑制程度随着浓度的增加而加剧。
厌氧消化基质不同时,低浓度的林可霉素对厌氧消化产甲烷表现出不同的影响。10 mg·L-1时对含高蛋白质和抗生素的林可霉素生产残渣为基质的厌氧消化产甲烷有抑制作用,然而15 mg·L-1时对以市政污水处理厂的污泥为基质的厌氧消化产甲烷有促进作用[38,41]。对于林可霉素生产的残渣中含有的高蛋白物质,厌氧消化过程中会被分解成氨氮,造成复合污染,从而抑制产甲烷。
文献调研进一步发现,厌氧微生物驯化后对上述抗生素具有适应性。中温厌氧连续流反应器,在第104~167 d 连续运行的63 d 期间,红霉素质量浓度从1 mg·L-1提高至200 mg·L-1时,生物气产量仅由6.8 L·d-1变化为6.2 L·d-1[33]。红霉素质量浓度为20 mg·L-1下连续运行60 d后,中温厌氧产甲烷抑制率降低了22.1%[34]。这可能与长期连续实验中抗生素厌氧降解毒性削减,或者厌氧微生物获得了抗生素抗药性有关[42]。聂宇等[1]的综述指出,短期实验能够体现抗生素初次暴露对厌氧消化系统的影响,而长期连续实验则可以评估厌氧消化体系对抗生素的适应能力,2 种方法相辅相成,都可以被用于抗生素在厌氧消化体系中行为的研究。因此,有必要继续探究4种抗生素对厌氧消化的短期冲击负荷和长期毒性影响,阐明其对厌氧微生物种群的影响机制。
3.2 挥发性脂肪酸(VFAs)厌氧代谢
红霉素、阿奇霉素、螺旋霉素和林可霉素通过刺激厌氧消化过程中VFAs的生成,或者阻碍VFAs被进一步利用,从而造成厌氧消化过程中不同类型VFAs的累积。如表3所示,抗生素抑制厌氧消化的VFAs 代谢,并且抑制程度随着抗生素浓度的增加而加强。在采用厌氧序批式反应器处理葡萄糖、淀粉及挥发性脂肪酸合成废水的研究中发现:红霉素质量浓度为1 mg·L-1时,不影响VFAs 被产甲烷菌利用,乙酸消耗达98%;红霉素质量浓度提高至25 mg·L-1时导致VFAs 累积,乙酸消耗下降至78%;提高红霉素至500 mg·L-1,乙酸消耗仅7%,甚至完全停止[35-36]。其他研究人员也发现,红霉素(25 mg·L-1)、螺旋霉素(25 mg·L-1)和阿奇霉素(5~15 mg·L-1)各自单独存在时,厌氧消化体系中乙酸、丙酸和丁酸明显累积[37,39-40]。然而,林可霉素抑制厌氧水解酸化产VFAs,尤其是减少甲酸和丙酸的产生,减少量分别是对照组的80.0%和33.1%[37,43-44]。
3.3 厌氧微生物菌群
3.3.1 厌氧水解酸化菌
采用qRT-PCR 以及16S rRNA 高通量测序等生物学技术协助分析抗生素胁迫条件下厌氧消化微生物菌群的变化[45]。研究发现,水解酸化菌受抗生素影响较小,甚至可以耐受高浓度的抗生素[46]。阿奇霉素和林可霉素能够使水解酸化菌Clostridium(梭菌)和Bacteroidetes(拟杆菌)菌株相对丰度分别增加0.86%和7.07%[38,40,47]。与之相悖的是,谢钟林等[44]的研究发现,林可霉素(2 g·L-1)对以葡萄糖为底物的水解酸化菌群有抑制作用,导致葡萄糖的降解速率下降23.16%。上述结果不一致可能与厌氧消化的基质种类相关,分别是富含高蛋白(制药厂废水和市政污水处理厂污泥)和富含碳水化合物(葡萄糖)的基质,从而导致差异性。
3.3.2 VFAs氧化菌
VFAs 氧化菌的活性一方面与抗生素的直接抑制作用有关,另一方面可能与甲烷菌的活性受抗生素抑制导致的乙酸和氢气的累积间接相关[48]。如图2所示,不同的抗生素对VFAs氧化菌的影响不尽相同。红霉素、螺旋霉素和林可霉素在25 mg·L-1和50 mg·L-1质量浓度下均可抑制丁酸互营氧化菌的活性,并且抑制强度与其质量浓度正相关[37]。厌氧消化体系中阿奇霉素的存在可以促进和乙酸氧化利用相关的互营乙酸氧化菌Clostridium、芽孢梭菌属细菌Caloramator以及同型产乙酸菌Treponema(密螺旋体菌)增加或保持较高的相对丰度,这与体系中乙酸和丁酸盐浓度显著升高的累积结果一致[38-40]。然而,Liu等[47]的研究发现,阿奇霉素(69 mg·L-1)抑制互营丙酸氧化菌的活性,导致相对丰度减少。4种抗生素对VFAs 氧化菌影响不尽相同,可能是与VFAs氧化菌和古菌形成的互营关系有关[1],但是目前关于VFAs氧化菌对此类抗生素响应的报道仍然有限。
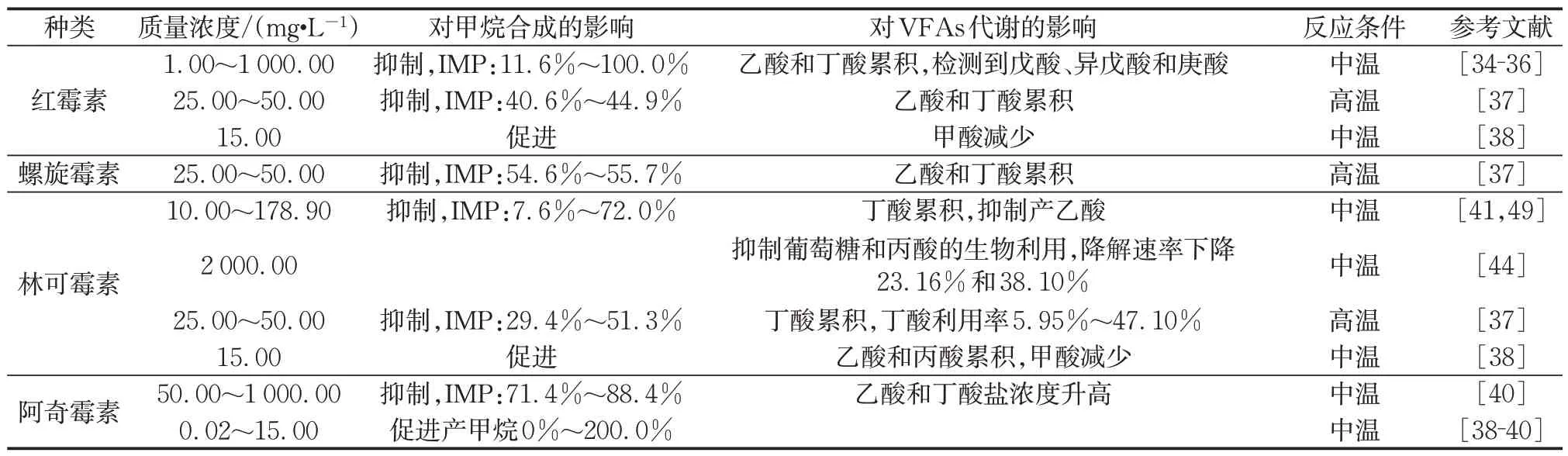
表3 3种大环内酯类抗生素(红霉素、螺旋霉素、阿奇霉素)和林可霉素对厌氧消化产沼气或VFAs代谢的影响Tab.3 Effects of three macrolide antibiotics(erythromycin,spiramycin,azithromycin)and lincomycin on biogas production or VFAs metabolism during anaerobic digestion

图2 3种大环内酯类抗生素(红霉素、螺旋霉素、阿奇霉)和林可霉素对厌氧消化影响机制的推测Fig.2 Influencing mechanism deduction of three macrolide antibiotics(erythromycin,spiramycin,azithromycin)and lincomycin on anaerobic digestion
3.3.3 厌氧产甲烷古菌
不同抗生素对厌氧产甲烷古菌的影响存在差异。厌氧消化过程中,林可霉素和阿奇霉素对优势属耗乙酸产甲烷古菌Methanosaeta(甲烷丝状菌)影响小[44,47]。抗生素对产甲烷古菌的影响程度也与抗生素的浓度相关,抑制程度随抗生素浓度的增加而进一步提高。红霉素和螺旋霉素在25~250 mg·L-1质量浓度下抑制产甲烷菌活性,并且红霉素质量浓度为250 mg·L-1时产甲烷菌活性被完全抑制[34,37]。厌氧消化体系中质量浓度15 mg·L-1的红霉素、阿奇霉素和林可霉素促进产甲烷古菌Methanomicrobia(甲烷微菌)和Methanobacteria(甲烷杆菌)丰度增加,但在微生物群落剖面中很难聚焦到产甲烷菌群(相对丰度<0.2%)[38-39]。未来需要对产甲烷古菌的微生物群落组成和抗药机制进行深入研究。
4 削减林可霉素和3 种大环内酯类抗生素对厌氧消化的抑制
林可霉素和3种大环内酯类抗生素(阿奇霉素、红霉素、螺旋霉素)的存在会影响厌氧消化微生物群。如图2所示,林可霉素和阿奇霉素存在时,以蛋白质为底物的水解酸化菌相对丰度增加,但是林可霉素的存在会抑制以葡萄糖为底物的水解酸化菌活性,甲酸和丙酸的产量减少。4种抗生素存在条件下均会降低互营丙酸氧化菌、互营丁酸氧化菌的活性,抑制厌氧消化体系利用VFAs(丙酸、丁酸)产乙酸的代谢途径,导致体系丙酸和丁酸的累积;不同的是,阿奇霉素可以增加互营乙酸氧化菌的相对丰度,促进体系利用乙酸产氢气和CO2。阿奇霉素存在时,同型产乙酸菌相对丰度增加,促进体系内的氢气转化为乙酸,也能促进体系将甲基化合物(甲酸、甲醇)转化为乙酸。不同浓度的抗生素对于产甲烷菌的影响存在差别,高浓度抑制产甲烷菌群活性,低浓度提高产甲烷菌活性。随着对抗生素影响厌氧消化机制研究的不断深入,研究人员发现通过预处理、添加外源介质、生物强化等方法,可缓解抗生素对厌氧消化的抑制。预处理或添加外源介质能够降解废水和污泥中的抗生素,降低废水中抗生素的浓度和抗菌活性,实现高浓度抗生素对厌氧消化抑制作用的消减;另一方面,添加外源介质或生物强化可以增强细菌和古菌的活性,尤其是提高了VFAs 氧化菌和产甲烷菌的活性,从而解除抗生素对厌氧消化微生物的抑制,提高厌氧消化速率。此外,适当延长消化时间也会增强消化效果,同时可以有效控制和削减抗生素的污染[50]。
4.1 预处理
目前,常用的预处理技术包括热水解、超声、微波、电絮凝、碱性热预处理及不同的组合处理。大环内酯类抗生素在较低的温度和相对中性的pH 条件下水解缓慢[51],对于热稳定性差的抗生素,热水解和强化水解工艺能够促进抗生素的降解,从而降低抗生素对厌氧消化微生物的毒性,有效地破坏实际生产废水的抗菌活性。热水解促进厌氧消化污泥中阿奇霉素浓度下降57.9%;在85 ℃条件下的强化水解下,1 h 内红霉素和螺旋霉素的去除率大于90%[52-53]。不同的是,超声和碱性预处理后,阿奇霉素和红霉素的总浓度没有明显变化,主要促进了抗生素从吸附态向液相的迁移[53]。国内外研究者也对电絮凝去除抗生素进行了探讨,以往研究主要集中于对四环素的降解[54],也有少数研究报道了电絮凝对大环内酯类抗生素(罗红霉素,logKow=2.75)的高去除率[55]。对同样拥有较高辛醇-水分配系数的红霉素(logKow=3.06)和螺旋霉素(logKow=1.46),在未来可以采用预处理方法进行研究。
通过硅钨酸水解和微波联合预处理、酸和碱催化水解等组合方法,可以移除大环内酯类抗生素(螺旋霉素)中的内酯键和糖苷键抗菌官能团或破坏其骨架结构,显著降低抗菌效果[56]。这可能是因为内酯水合反应在酸性条件下是可逆的[51],酸和碱催化水解组合可以调节pH值,提高大环内酯类抗生素的水解速率并消除脱水反应途径。通过预处理去除或破坏抗生素的结构键或官能团,可降低抗生素的抗菌活性,从而消减上述抗生素对厌氧消化的抑制,在抗生素生产废水现场预处理中具有广阔的应用前景。
4.2 添加介质
在厌氧消化池中添加外源介质,如活性炭、铁材料、锰材料等,可以稳定消化条件,丰富和多样化厌氧消化微生物群落,从而减少上述抗生素对厌氧消化的抑制,提高厌氧消化的甲烷产量。Zhang 等[57]在厌氧消化池中添加活性炭以促进细菌和古菌富集,甲烷产率提高至少1 倍。向厌氧消化体系中添加富含锰和铁元素的硼铁矿能够提高林可霉素的去除速率,4 h 内可去除90%以上的林可霉素,促进厌氧微生物的活性,进而增强厌氧消化过程[58]。因此,活性炭、铁基等材料的加入,一方面通过吸附作用降低了抗生素的浓度,另一方面铁基材料释放电子加强了厌氧消化微生物群落之间直接或间接的电子传递作用[1,59-60],消减了抗生素对厌氧消化的抑制,厌氧消化过程的稳定性增强。目前关于在上述抗生素废水的厌氧消化过程中添加外源介质的应用较少,对采用活性炭、铁基等材料缓解抗生素对厌氧消化抑制的机制,未来需要更多的研究证实。
4.3 生物强化
前文探讨了抗生素的存在导致体系乙酸、丙酸、丁酸和氢气的累积,进而影响体系产甲烷。生物强化可以改变厌氧消化微生物群落结构,消减VFAs累积对厌氧消化的抑制,提高系统产甲烷,增强体系稳定性。在厌氧消化反应器中添加耐酸产甲烷菌群和丙酸盐降解菌群,可促进厌氧消化产甲烷提高9%~12%;通过增加强化微生物如甲烷杆菌属Methanobacterium、甲烷丝状菌属Methanothrix和甲烷营绳菌属Methanolinea等的相对丰度来重建产甲烷菌群,提高甲烷产量[61-62]。当VFAs 浓度较高时,甲烷八叠球菌Methanosarcina活性的增强有利于维持乙酸盐向甲烷的更快转化[61]。此外,利用氢分压控制驯化互营丁酸氧化菌和氢营养型产甲烷菌成为优势菌属,解除VFAs的累积,提高厌氧消化的甲烷产量[63]。生物强化加速厌氧消化降解累积的VFAs,特别是乙酸、丁酸的累积,因此未来可将该方法应用于缓解受抗生素抑制的厌氧消化体系。
5 螺旋霉素和林可霉素的厌氧生物降解
核磁共振、高效液相色谱质谱连用法可以鉴定和表征抗生素及其中间体,得出形成和消失的时间分布,从而阐明其厌氧生物代谢机理[64-65]。Zhu等[66]发现厌氧消化3 周后,螺旋霉素Ⅰ、Ⅱ、Ⅲ可降解95%以上,其中螺旋霉素Ⅰ主要发生厌氧羟基化和水解反应。Yao 等[65]进一步检测发现,螺旋霉素Ⅰ厌氧降解存在大环内酯开环反应,并伴有C6-醛基的氧化或还原。
目前,关于林可霉素降解的研究热点主要集中在水解、光催化等代谢途径,包含了羟基化、氧化、甲硫基的丢失或替代、异丙基侧链不饱和还原等路线[67-68],而厌氧生物降解的报道较少。已有研究结果表明,无乳链球菌和编码核苷酸InuB基因参与了林可霉素的代谢,能够将林可霉素转化为磷酸化林可霉素[68-69]。未来对林可霉素、红霉素、阿奇霉素等抗生素在厌氧生物降解途径和机制等方面还有待进一步研究。
6 展望
红霉素、阿奇霉素、螺旋霉素和林可霉素在环境中高浓度、高频次的检出,严重危害生态环境,利用厌氧消化工艺消减高浓度废水中的抗生素迫在眉睫。当前研究多为4种抗生素单独对厌氧消化的作用,低浓度抗生素会促进厌氧消化产甲烷,高浓度抗生素会抑制产甲烷,并且产甲烷过程的效果与厌氧消化的基质有关。关于上述抗生素对厌氧消化影响的相关研究多为批次实验或者长期运行结果,主要集中于抗生素对厌氧消化抑制效果的考察,而对厌氧消化在急性和长期实验中影响的报道不尽相同,抗生素对厌氧消化的影响有促进也有抑制作用,未来有必要进一步开展关于上述抗生素对厌氧消化系统的短期冲击负荷和长期毒性的影响研究,以明确关键因子。另一方面,制药或者养殖废水中的抗生素一般不是单独存在的,因此有必要进一步考察多种抗生素共存时的相互作用及其对不同基质厌氧消化特性的影响。
厌氧消化是处理抗生素废水的常用工艺,上述抗生素能够影响厌氧消化的VFAs氧化菌和产甲烷古菌的活性。多数情况下,4种抗生素能够抑制丙酸互营氧化菌和丁酸互营氧化菌的活性,致使其相对丰度的减少。然而,不同浓度的抗生素对于产甲烷菌的影响存在差别,低浓度时能够促进产甲烷古菌丰度的增加,高浓度时却抑制产甲烷菌活性。近年来,较多的研究通过核磁共振和串级质谱分析技术探究4 种抗生素在水解、光解以及厌氧消化中的开环、厌氧羟基化、异丙基侧链不饱和还原等氧化还原反应的代谢行为,而针对在厌氧生物代谢方面的研究较少。此外,通过预处理、外加介质、生物强化等方式对受抑制的消化器进行持续、稳定的改善,能够有效提高厌氧消化效率,但是对上述抗生素存在条件下,对厌氧消化抑制的缓解效果以及机理有待进一步验证和研究。因此,未来可以借助16S rRNA高通量测序、宏基因组学、蛋白组学等技术手段进一步考察4 种抗生素作用下厌氧微生物菌群的演化特征,同时结合抗生素的厌氧生物降解特性,阐明厌氧消化中抗生素的代谢机制,以实现废水中抗生素的有效消减,降低环境中抗生素的残留浓度。
作者贡献声明:
谢 丽:负责论文的选题与设计,修改论文中关键性理论和其他主要内容。
张艺蝶:负责论文的选题与设计,论文的起草、撰写和最终版本的修订。
朱雯喆:参与论文的选题与设计,修改论文中关键性理论和主要内容。
何莹莹:参与论文中关键性理论和主要内容的修改。
