青鱼肉活性肽的制备及其抗肿瘤活性研究
2021-03-18张耀张露刘俊涂宗财
张耀,张露,刘俊,涂宗财,2*
1(江西师范大学 国家淡水鱼加工技术研发专业中心和江西省淡水鱼高值化利用工程技术研究中心,江西 南昌,330022)2(食品科学与技术国家重点实验室(南昌大学),江西 南昌,330047)
抗肿瘤肽因具有低毒性、多样性、低免疫原性和不易产生耐药性等特点而被人们广泛关注,制备方法主要有酶解法[1]、发酵法[2]和人工合成法[3]。由于发酵法技术不够成熟且效果难以达到预期,人工合成法因技术要求高、工艺复杂、成本高等原因,均难以广泛应用。酶解法因具有反应条件温和、易控制、无有害化学物质产生、酶解产物安全性较高等特点成为制备抗癌肽的首选方法。目前,已有许多从水生资源中酶解制备抗肿瘤肽的研究报道,但其原料主要来源于海洋产品,如藻类、深水鱼类、软体动物、甲壳类和其他海洋副产品[4],利用淡水鱼制备抗肿瘤肽的相关研究较少。由于淡水鱼的生长环境与海洋生物的生长环境有很大的区别,因此淡水鱼蛋白质的氨基酸序列、结构和功能与海洋生物的蛋白质有较大的区别,有可能开发出具有抗肿瘤活性的肽。目前仅在少数几种淡水鱼生物中有所提取,还有很大一部分淡水鱼生物活性肽未被发现或开发出来,因此淡水鱼生物活性肽具有非常广阔的研究前景。研究表明青鱼(Mylopharyngodonpiceus)具有丰富的营养价值,同时还养气健胃,长期食用青鱼可有效缓解气虚乏力、脚气湿痹、头晕无力等症状,且青鱼肉的粗蛋白、总氨基酸和必需氨基酸含量为四大家鱼中排行最高,而粗脂肪含量排第三,符合人们对高蛋白低脂肪食物的需求,是一种优质的蛋白质资源[5]。
肽的抗肿瘤活性与多肽链长度[6]、总体电荷/疏水性[7]、螺旋结构[8]、氨基酸组成[9]和序列[10]等有关。已分离鉴定的抗肿瘤肽大多数是由3~25个氨基酸残基连接而成的短肽。CHALAMAIAH等[11]对食源性抗肿瘤肽进行了统计分析,发现其抗肿瘤肽活性主要与疏水氨基酸组成有关。DO等[12]发现,序列中的带正电氨基酸(Lys、Arg和His)可增强抗肿瘤肽与带负电的肿瘤细胞膜的有效结合。另外,自由基与癌症的产生和发展密不可分[13],具有抗氧化活性的物质因其能够清除自由基,避免活性氧损伤DNA等生物大分子等,可降低细胞突变率。如毛楷林[14]从皱瘤海鞘中提取了4种分子量的多肽组分,证实了多肽的抗肿瘤活性随着抗氧化活性增强而增强。再者,疏水氨基酸含量高的多肽,通常也具有较好的抗氧化活性[15],进一步说明活性肽的抗肿瘤活性与抗氧化性具有一定的构效关系。
相比其他淡水鱼类,青鱼肉中疏水氨基酸和带电氨基酸含量相对较高[5],具有制备抗肿瘤肽的研发潜力,然而从青鱼肉中提取抗肿瘤肽的研究尚未见报道。本文以青鱼肉为原材料,采用单因素试验、正交优化试验确定制备青鱼肉活性肽的最佳工艺,采用凝胶色谱对二步酶解物进行初步分离,得到5个分子质量不一的活性肽组分,检测其氨基酸组成、抗氧化活性和抗肿瘤活性。本研究可丰富抗肿瘤肽的来源,为淡水鱼资源的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
新鲜青鱼购买于江西省南昌市南昌县长胜市场。
胰蛋白酶、中性蛋白酶、风味蛋白酶、碱性蛋白酶,北京索莱宝科技有限公司;复合蛋白酶、木瓜蛋白酶,江苏锐阳生物科技有限公司;羟脯氨酸(131.13 Da)、抑肽酶(6 511.51 Da)、细胞色素C(12 384 Da)均为色谱纯,北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(分析纯),北京索莱宝科技有限公司;L-氧化型谷胱甘肽(612.63 Da)、三氟乙酸(trifluoroacetic acid,TFA)(色谱纯)、三氯乙酸(trichloroacetic acid,TCA)(分析纯),上海阿拉丁生化科技股份有限公司;HepG2细胞,武汉普诺赛生命科技有限公司;CCK细胞计数试剂盒(ZP328-3),北京庄盟国际生物基因科技有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS)、DMEM高糖培养基(RNBJ1457),美国Sigma公司;胎牛血清(10091-148)、胰蛋白酶消化液(15140-122),美国Gibco公司。
1.2 仪器与设备
HH-6型数显恒温水浴锅,国华电器有限公司;5430R型冷冻离心机,德国艾本德公司;SR-AON-50型冷冻干燥机、SR160 W型二氧化碳培养箱,上海舍岩仪器有限公司;SKD-800型自动凯氏定氮仪,上海沛欧分析仪器有限公司;Acclaim PepMap 100型纳流预柱、Acclaim PepMap RSLC型纳流分析柱、EASY-nLC 1000型超高效液相,赛默飞世尔科技(中国)有限公司;Synergy H1酶标仪,美国Bio Tek公司;L-8900型氨基酸分析仪,日本Hitachi公司;BHC-1300IIB2型生物安全柜,苏州安泰空气技术有限公司;N2000+色谱工作站,赛智科技(杭州)有限公司。
1.3 实验方法
1.3.1 青鱼肉采集
青鱼肉糜制备工艺:
鲜活青鱼→刮除鱼鳞→宰杀(去头去尾去鳍)→开膛去内脏→剥皮去骨采鱼肉→粉碎打成肉糜(常温下,用粉碎机粉碎3次,粉碎时间7 s,间隔时间30 s)→-80 ℃冰箱中保存待用
1.3.2 碱性蛋白酶一步酶解
制备一步酶解物:
肉糜→加入纯水混匀[料液比1∶10(g∶mL)]→调节初始pH值为8.00→添加碱性蛋白酶→水浴酶解(50 ℃,3 h)→灭酶(100 ℃,15 min)→离心(7 000 r/min,30 min)→取上清液冷冻干燥→青鱼肉一步酶解物
1.3.3 蛋白酶的筛选
分别选用胰蛋白酶、木瓜蛋白酶、中性蛋白酶、复合蛋白酶和风味蛋白酶对制备的青鱼肉一步酶解物进行酶解,各蛋白酶的适宜酶解条件如表1所示。以清除DPPH自由基的半数抑制质量浓度(half maximal inhibitory concentration,IC50)结合水解度(degree of hydrolysis,DH)为评价指标,筛选最优蛋白酶用于二步酶解。
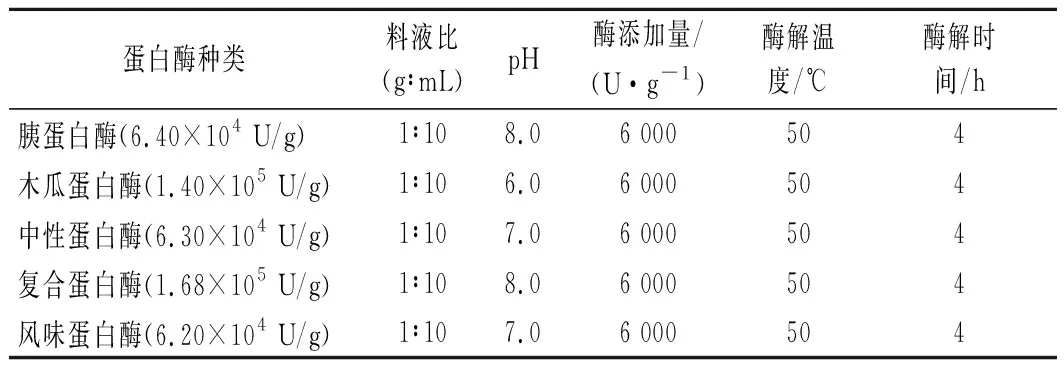
表1 五种蛋白酶的酶解条件Table 1 Enzymatic hydrolysis conditions of five proteases
1.3.4 青鱼肉活性肽二步酶解工艺优化
1.3.4.1 单因素试验
采用复合蛋白酶酶解一步酶解物制备高抗氧化活性的青鱼肉活性肽,以清除DPPH自由基的IC50值和DH为评价指标进行单因素试验。依次评价pH值(6.0、7.0、7.5、8.0、8.5、9.0)、酶解温度(40、45、50、55、60、65 ℃)、料液比(1∶10、2∶10、3∶10、4∶10、5∶10,g∶mL)、酶添加量(2 000、4 000、6 000、8 000、10 000 U/g)、酶解时间(1、2、3、4、5 h)对青鱼肉一步酶解物的酶解效果。
1.3.4.2 正交试验
选取pH值(A)、酶解温度(B)、酶解时间(C)对青鱼肉一步酶解物酶解效果较强的3个因素为自变量,以IC50值为响应值(Y),设计3因素3水平的正交试验,探索从青鱼肉一步酶解物中制备具有高抗氧化活性肽的最佳工艺条件。
1.3.5 评价指标的测定
1.3.5.1 DPPH自由基清除能力的测定
参照涂宗财等[17]方法采用DPPH自由基清除实验比较青鱼肉活性肽及其组分之间的抗氧化能力,采用Origin 8.6软件中的多项拟合计算样品清除50%的DPPH自由基所需质量浓度(IC50,mg/mL)。
1.3.5.2 DH的测定
参照罗艳华等[18]方法测定二步酶解物中游离氨基氮和总氮含量。按公式(1)计算样品的DH:
(1)
1.3.6 二步酶解物中多肽分子质量分布的测定
参照李军等[16]方法测定样品中多肽的分布情况。将样品配制成2.0 mg/mL的溶液,过0.22 μm水系滤膜后使用HPLC进行分析。条件为:色谱柱,XBridge BEH 125Å SEC;进样量,10 μL;柱温,30 ℃;流动相,V(乙腈):V(水0.1%TFA)=40∶60;流速,0.5 mL/min。以2.0 mg/mL不同分子质量的标准品及其出峰时间绘制相对分子质量校正曲线,通过相对分子质量校正曲线计算青鱼肉活性肽的分子质量。
1.3.7 Sephadex G-15分子筛层析
参照CAI等[19]方法采用Sephadex G-15分子筛层析对二步酶解物进行初步分离。称量40 g Sephadex G-15凝胶填料于干净的烧杯中,加入超纯水于室温下浸泡24 h,使凝胶填料充分溶胀后装入层析柱(16 mm×80 cm)中。待凝胶填料沉降至高度不再发生变化后,将活性肽粉末用超纯水配成100 mg/mL的水溶液,滤膜过滤去除不溶物后取2 mL上样。用恒流泵将超纯水的流速调整为0.4 mL/min,紫外检测器的波长设定为220 nm,自动收集器每5 min收集一管。
1.3.8 不同分子质量多肽氨基酸组成分析
采用氨基酸分析仪对样品的氨基酸含量进行测定。
1.3.9 体外抗肿瘤活性的测定
将样品用培养基配制成质量浓度为10 mg/mL的溶液,过0.22 μm水系滤膜后备用。取对数生长期的HepG2细胞接种于96孔细胞培养板中,外部加入PBS溶液防止细胞失水。加入细胞培养板时每孔细胞数约为5 000个,于37 ℃,5% CO2培养24 h后,移去残余培养基,PBS溶液清洗2次。其中,实验孔中加入100 μL样品(AS),对照孔中加入100 μL的培养基(AC),于37 ℃,5% CO2条件下孵育24 h。移去板内样品和培养基,PBS溶液清洗3次,加100 μL 体积分数为5%的CCK-8溶液,于37 ℃培养3 h后在450 nm波长处测定各孔中细胞的吸光值。以CCK-8溶液在相同培养条件下的吸光值(Ab)作为底色对照[20]。按公式(2)计算细胞活力:
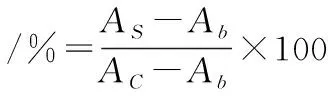
(2)
1.4 数据处理
所有实验均重复3次,实验数据均以平均值±标准偏差表示。采用Excel 2010记录数据,SSPS 22.0软件对数据进行单因素方差分析(ANOVA),使用Tukey HSD程序进行差异显著性分析,Origin 8.6软件作图。
2 结果与分析
2.1 最优酶的筛选
鱼肉中的蛋白质在蛋白酶的作用下会酶解成不同分子质量的多肽,二步酶解不仅可以提高酶解效率和活性肽含量,还会进一步将多肽水解成小分子质量的短肽,提高肽的抗氧化、抗肿瘤、降血压、降血糖等多种功能特性[21]。5 种蛋白酶的酶解效果如图1所示,经复合蛋白酶酶解之后,二步酶解物的DPPH自由基清除能力最强,其IC50值为10.16 mg/mL,风味蛋白酶和胰蛋白酶的DH虽然较高,但其IC50值分别为16.87和27.17 mg/mL,抗氧化活性低于复合蛋白酶制备的活性肽,可能是由于酶切位点不同,部分具有抗氧化活性的结构未被暴露或者被酶解破坏,导致抗氧化能力减弱。而中性蛋白酶和木瓜蛋白酶的DH较低,水解物中具有抗氧化活性的肽较少,导致抗氧化活性较弱。由此可见,复合蛋白酶制备的二步酶解物具有更强的抗氧化活性。本实验使用的复合蛋白酶主要是由碱性蛋白酶和风味蛋白酶复配而成,其酶解位点是疏水氨基酸[22],通过碱性蛋白酶从中间切断蛋白质内部的肽链释放出具有抗氧化活性的肽段;其次,风味蛋白酶将多肽链的末端切断释放单个氨基酸,酶解过程中与还原糖发生美拉德反应,产生具有独特风味的天然香气,从而改善食品的风味[23]。与其他蛋白酶相比,复合蛋白酶更适用于肉类蛋白质的水解和活性肽的制备。为了更好地制备高抗氧化活性的活性肽。因此,选择复合蛋白酶用于后续实验的工艺优化。
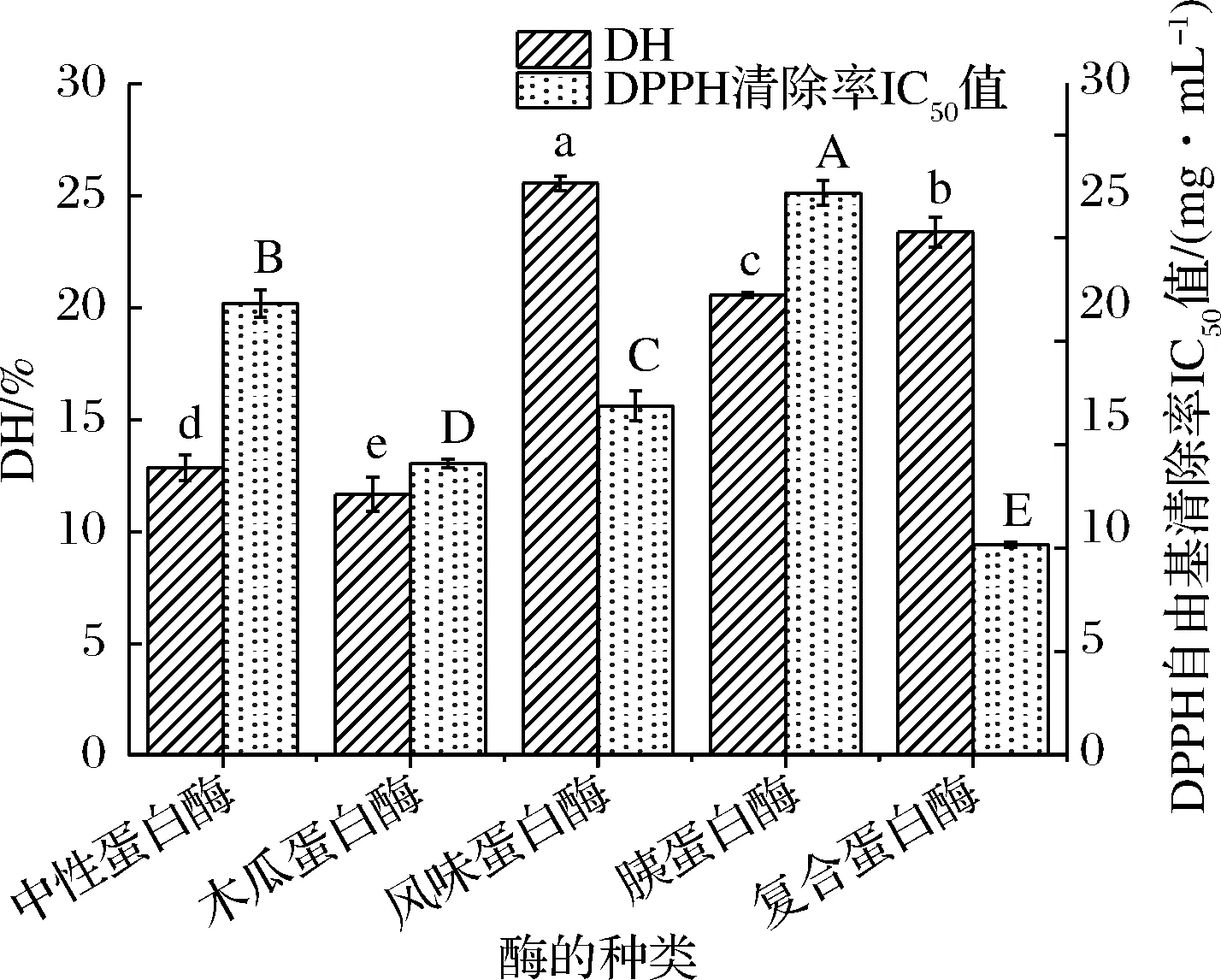
图1 五种蛋白酶的酶解效果Fig.1 Enzymatic hydrolysis effect of five proteases注:不同字母表示具有显著性差异(P<0.05)(下同)
2.2 单因素试验结果
单因素试验结果如图2所示。由图2-a可知,二步酶解物的IC50值随着pH值增加呈现先上升后下降的趋势,当pH为8.5时,二步酶解物的清除能力最强,IC50为6.42 mg/mL(P<0.05),这是因为复合蛋白酶中含有碱性蛋白酶的成分,在碱性环境中的酶活力高于酸性环境。pH低于或高于复合蛋白酶的最适pH范围,都会使其酶解能力下降。由图2-b可知,随着酶解温度的升高,二步酶解物的IC50值呈现先下降后上升的趋势,当酶解温度为50 ℃时,清除能力最强, IC50值为11.18 mg/mL。当酶解温度超过50 ℃时,IC50值逐渐增大,这是因为温度过高会导致复合蛋白酶的酶活力下降甚至失活,最终使蛋白水解效率降低。由图2-c可知,随料液比的增大,二步酶解物的IC50值呈先下降再上升后逐渐平稳的趋势,在料液比为2∶10(g∶mL)时,抗氧化活性达到最强(IC50=10.96 mg/mL),此时的DH也较高。当料液比继续增大,IC50值呈上升的趋势,原因在于底物浓度随着料液比的增大而增大,底物过饱和,导致DH逐渐在下降,具有抗氧化活性的肽段含量也随之降低。
由图2-d可知,随着酶添加量的增加,青鱼肉的DH呈现上升趋势,IC50值显著下降并趋于平稳,当酶添加量为6 000 U/g时, IC50值为12.06 mg/mL,这可能是因为N-端或C端的疏水氨基酸含量增多,使其抗氧化活性增强[24];如继续增大酶添加量,IC50值下降不显著(P>0.05),可能是由于酶在水解多肽或者鱼肉产生抗氧化肽的同时,也在水解具有抗氧化活性的小分子肽或多肽,导致产物活性并没有显著提高。由图2-e可知,随着酶解时间的增加,二步酶解物的IC50值呈现先下降后上升的趋势,在当酶解时间为3 h时,IC50值达到最小值(11.45 mg/mL)。酶与底物结合后迅速发生反应,使得酶解液中DH和活性肽含量均上升,随着酶解时间的延长,部分活性肽会被水解成游离氨基酸,使得具有抗氧化活性的多肽含量降低,其自由基清除能力下降。
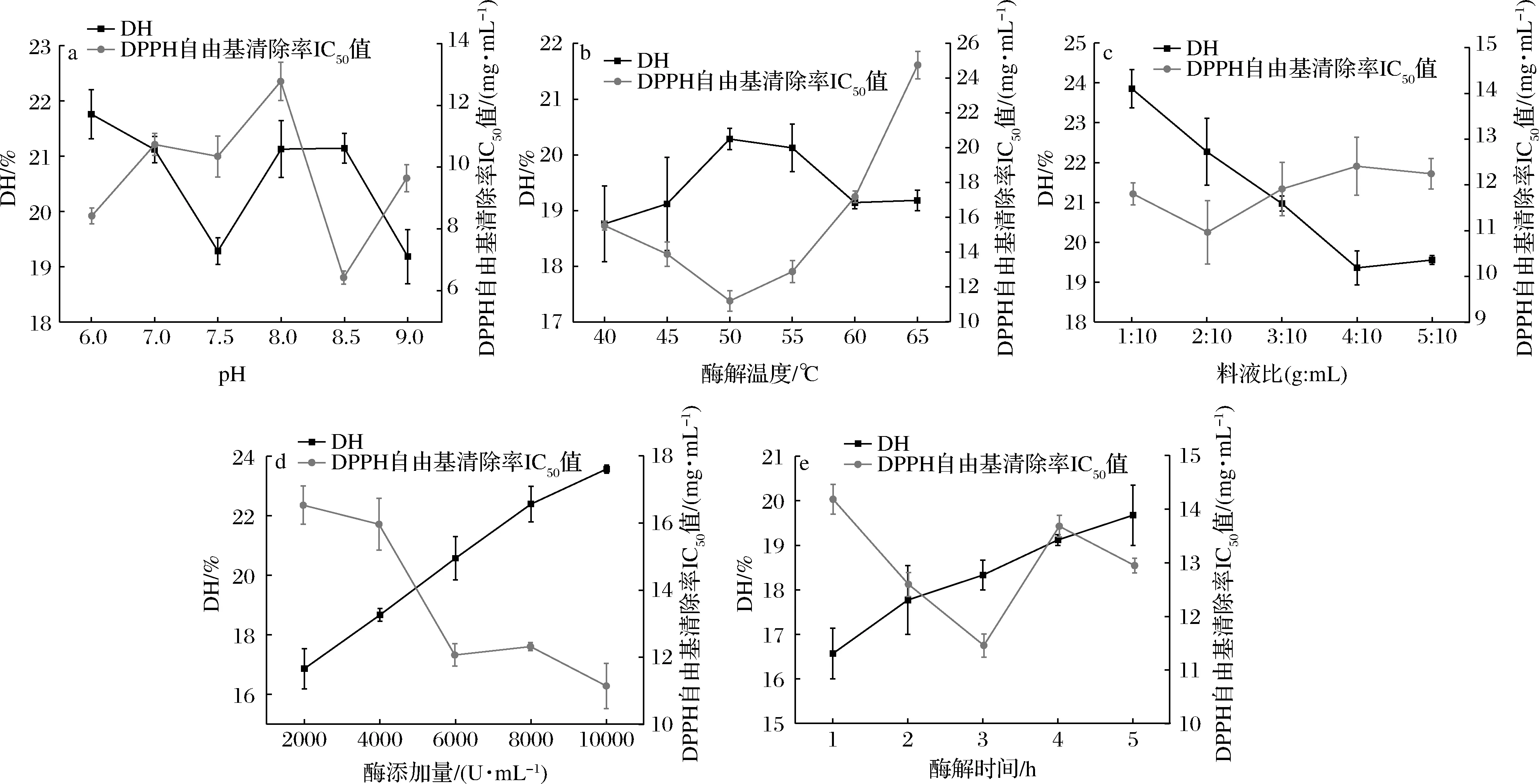
a-pH;b-酶解温度;c-料液比;d-酶添加量;e-酶解时间图2 提取条件对二步酶解物的DH和DPPH自由基清除能力影响Fig.2 Effects of extraction conditions on DH and DPPH radical scavenging capacity of two-step enzymatic hydrolysate
2.3 二步酶解条件的正交试验结果及分析
2.3.1 正交试验优化结果
依据单因素结果,选取pH值(A)、酶解温度(B)、酶解时间(C)影响酶解效果较大的3因素,设计3因素3水平的正交试验,试验结果见表2。
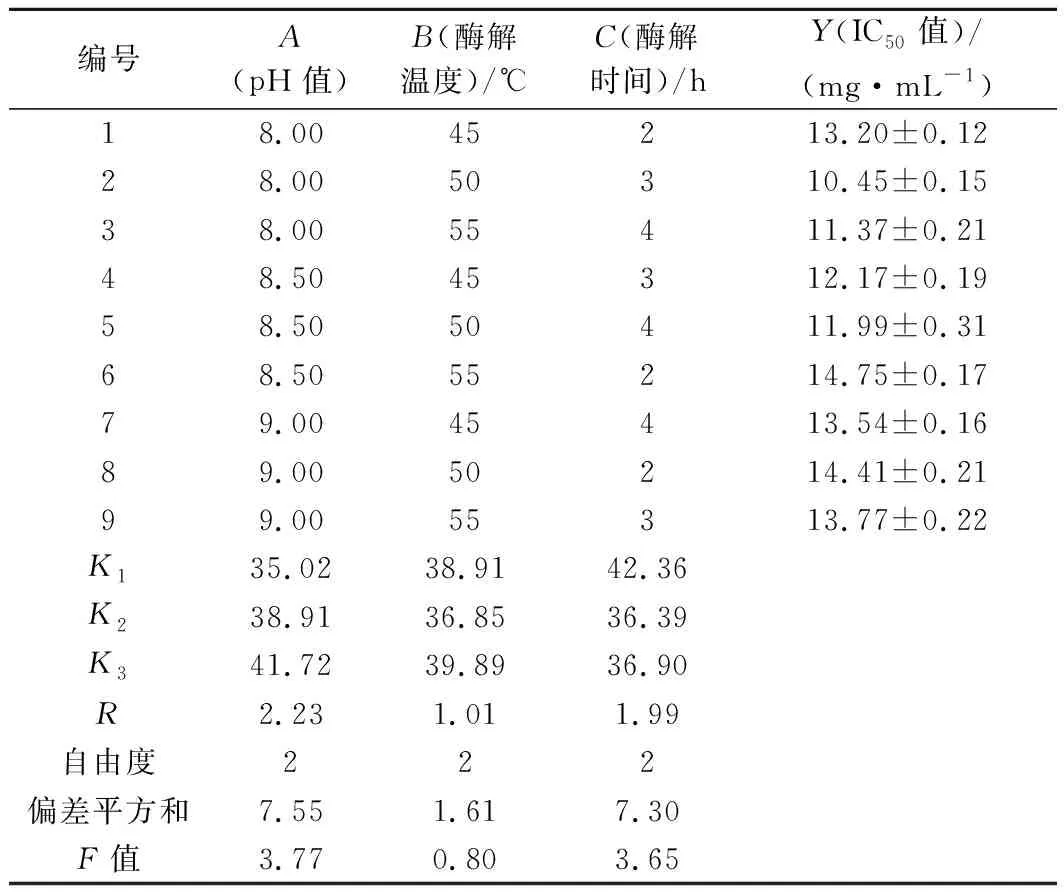
表2 正交试验方案及清除DPPH自由基的IC50值结果Table 2 Orthogonal array design and IC50value result of scavenging DPPH radical
以清除DPPH自由基的IC50值为评价指标,采用正交试验对青鱼肉活性肽的制备工艺进行优化。由表2可知,根据极差分析,各因素影响青鱼肉水解物的DPPH自由基清除能力的大小顺序为pH值(A)>酶解时间(C)>酶解温度(B)。二步酶解制备青鱼肉活性肽的最优组合为A1B2C2,即pH值为8.00,酶解温度50 ℃,酶解时间3 h。
2.3.2 最优条件的验证
根据正交试验得出的最佳工艺条件进行酶解,即pH 8.00,酶解温度50 ℃,酶解时间3 h,进行5次平行试验,取平均值得到的清除DPPH自由基的IC50值为9.52 mg/mL,优于未优化之前的结果,故A1B2C2为最佳酶解工艺条件。
2.4 活性肽分子质量分布情况
不同分子质量标准品的HPLC图如图3所示,各标准品分离效果较好。通过线性回归方程拟合发现标准品相对分子质量的对数(lgMW)和保留时间(T)呈良好的线性关系,其相对分子质量校正曲线方程:lgMW=6.6 102-0.187 3T(R2=0.994 5),依据相对分子质量校正曲线方程和活性肽的出峰时间,可计算出酶解物中活性肽的分子质量范围。
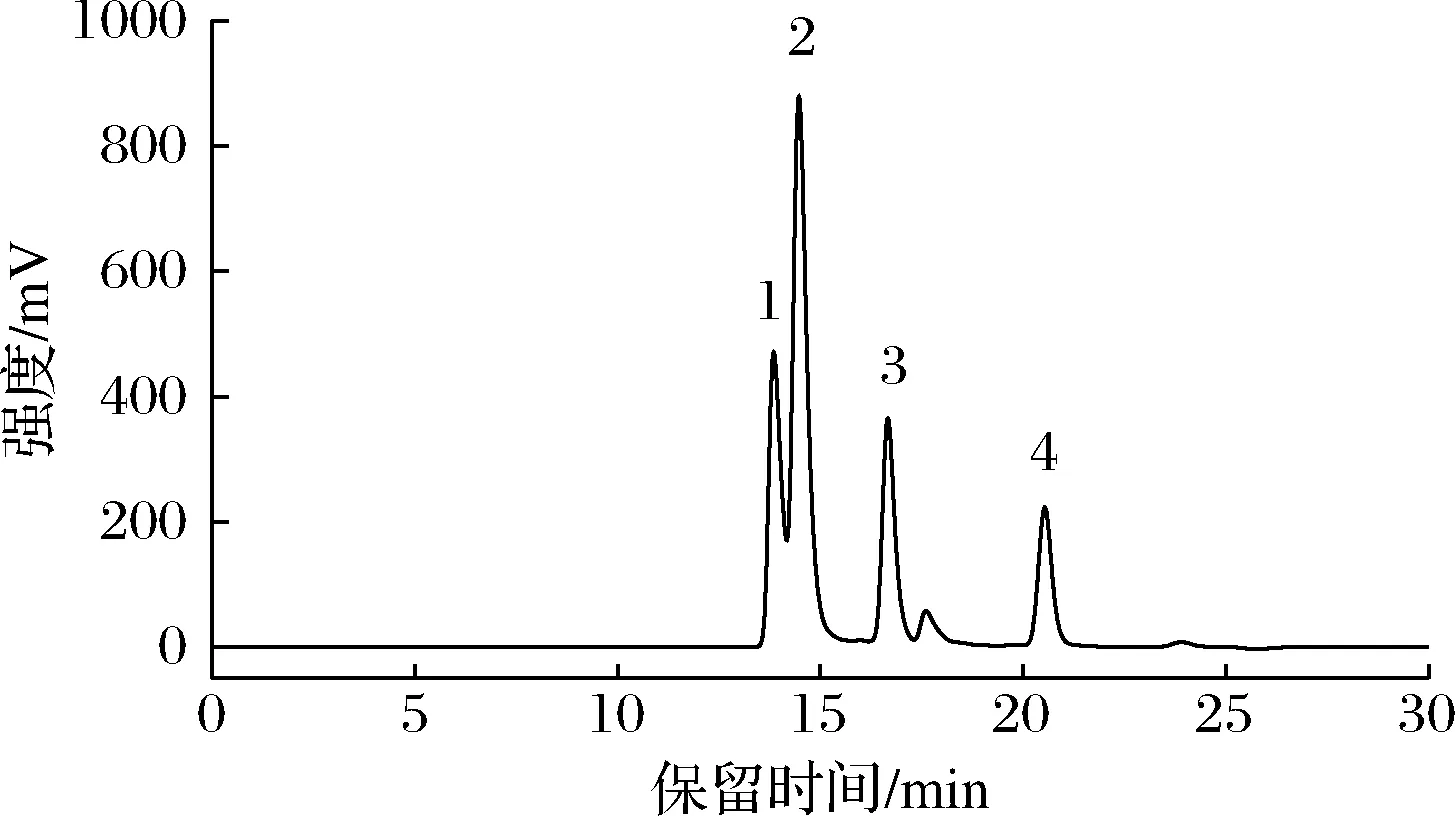
1-细胞色素C;2-抑肽酶;3-L-氧化型谷胱甘肽;4-羟脯氨酸图3 不同分子质量标准品的HPLC图Fig.3 HPLC chromatogram for different molecular weight standards
二步酶解物中活性肽的HPLC图和分子质量分布如图4和表3所示,其中组分Ⅴ的分子质量分布明显小于单个氨基酸分子质量且无法构成多肽结构,故不再对其进行分析,因此青鱼肉活性肽主要是由4种不同分子质量多肽组分所组成。青鱼肉活性肽分子质量主要集中在组分Ⅱ、Ⅲ和Ⅳ,分子质量在100~600 Da,均为小分子量肽。且组分Ⅳ含量最高,约占40.38%。根据二步酶解物中活性肽的分布情况,采用Sephadex G-15分子筛层析进行分离纯化。
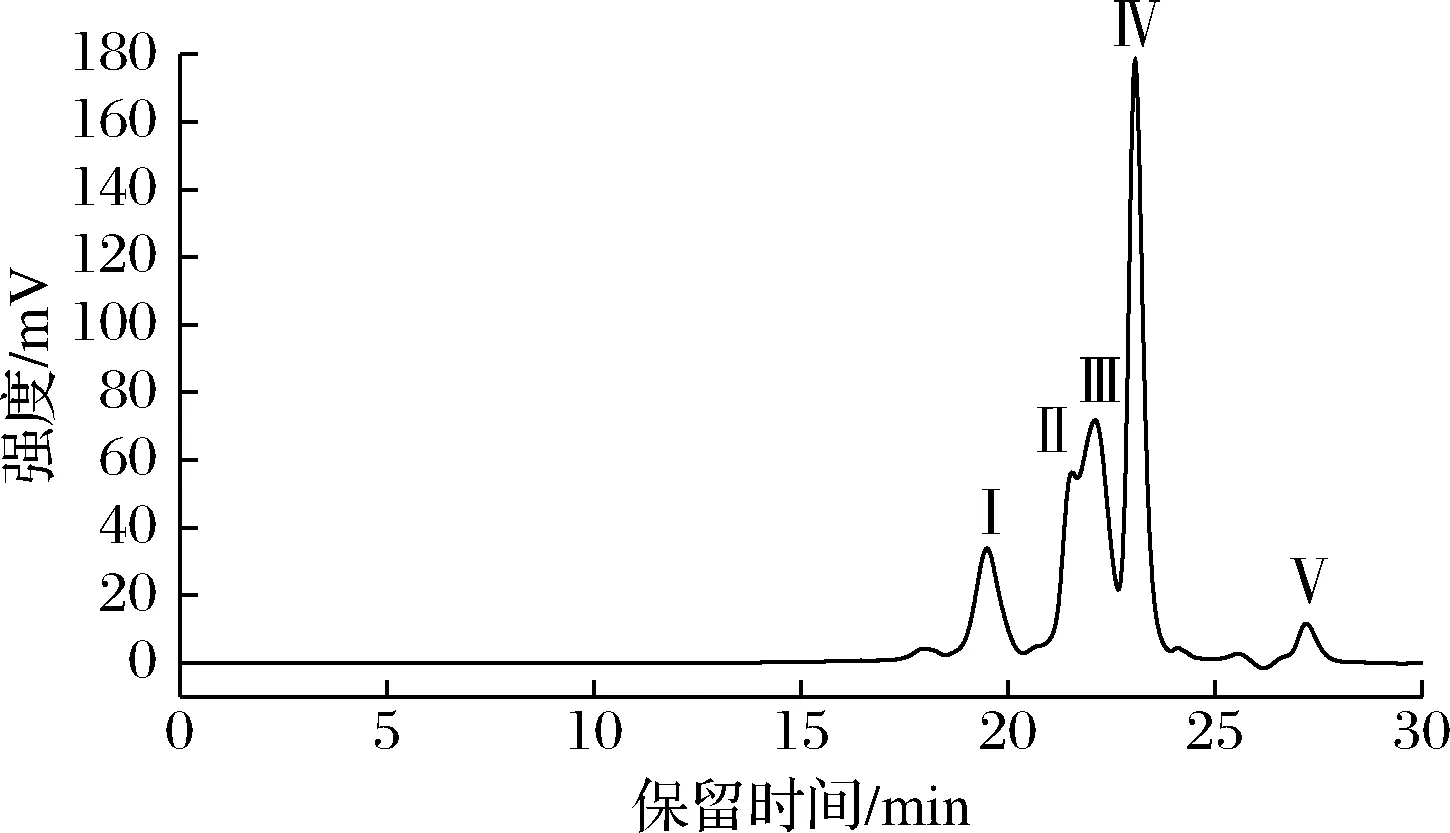
图4 二步酶解物的HPLC色谱图Fig.4 HPLC chromatogram of two-step enzymatic hydrolysate
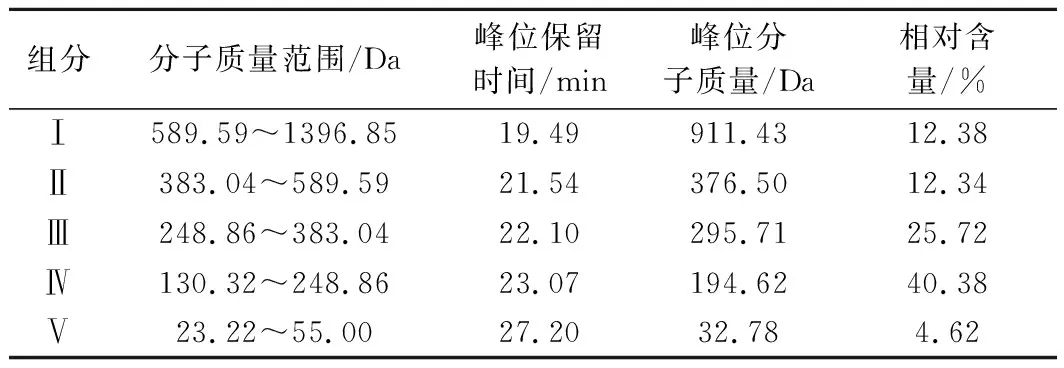
表3 二步酶解物各组分的分子质量和相对含量Table 3 Molecular weight and relative content of two-step enzymatic hydrolysate
2.5 Sephadex G-15分子筛层析
凝胶过滤主要是根据多肽的分子质量进行初步分离的一种技术,已被广泛用于多肽的分离纯化。二步酶解物洗脱后的图谱及各组分含量如图5和表4所示。从二步酶解物分离出5个组分,冻干后组分Ⅰ~Ⅴ分别占活性肽粉末的21.10%、14.86%、14.16%、28.11%和6.72%。组分Ⅳ含量最高(56.22 mg),组分Ⅴ的含量较低,故综合考虑时间、经济等因素,收集前面4个组分作为后续的研究对象。

图5 二步酶解物的Sephadex G-15柱洗脱图谱Fig.5 Elution chromatography of Sephadex G-15 column of two-step enzymatic hydrolysate

表4 各多肽组分的含量Table 4 Content of each peptide
2.6 氨基酸组成分析
二步酶解物及组分Ⅰ~Ⅳ含量如表5所示。二步酶解物中Glu含量最高,Asp、Leu、Gly的含量也相对较高,符合青鱼鱼肉的氨基酸组成特征[25]。二步酶解物的疏水氨基酸含量为32.92%,经凝胶分离后,组分Ⅲ和组分Ⅳ的疏水氨基酸含量分别增加到35.07%和35.38%。

表5 二步酶解物及其各组分的氨基酸含量 单位:mol/kg
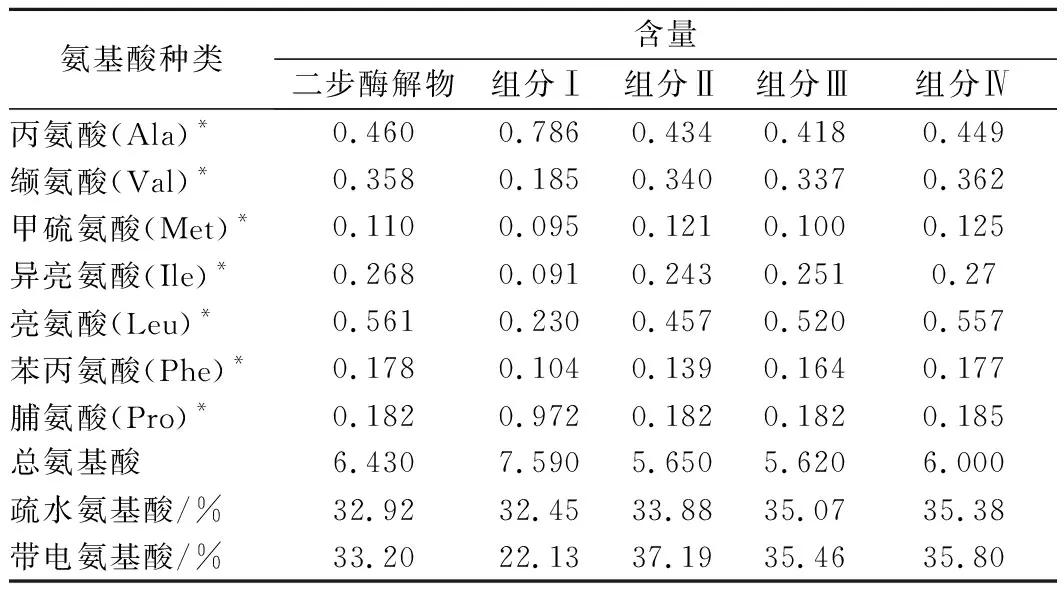
续表5
2.7 体外抗氧化及抗肿瘤实验结果
2.7.1 DPPH自由基清除能力
二步酶解物及其各组分的DPPH自由基清除能力如图6所示。在1.25~20 mg/mL的质量浓度范围内,所有样品都具有较好的DPPH自由基清除能力,且其抗氧化活性均随样品的质量浓度增加而增加。由图6可知,组分Ⅳ清除DPPH自由基的能力最强(P<0.05),IC50值为3.17 mg/mL,其抗氧化活性高于组分Ⅲ(IC50=3.43 mg/mL)、组分Ⅱ(IC50=4.86 mg/mL)、二步酶解物(IC50=9.57 mg/mL)和组分Ⅰ(IC50=12.90 mg/mL)。由表5可知,组分Ⅳ的疏水氨基酸含量最高,为其抗氧化活性提供保障;而二步酶解物的抗氧化能力强于组分Ⅰ,这是因为一些带电氨基酸,其含量的高低也与抗氧化活性有关,如Asp、Lys和His可以充当电子供体并与自由基反应,使其成为更稳定的物质,可阻止氧化反应[26]。

图6 二步酶解物及其不同组分的DPPH自由基清除能力Fig.6 DPPH radical scavenging a capacity of two-step enzymatic hydrolysates and their components
2.7.2 细胞增殖抑制实验
二步酶解物及其组分对HepG2的抑制能力如图7所示,二步酶解物对HepG2细胞有较好的抑制,其抑制率为80.97%;经过Sephadex G-15过滤色谱法分离纯化后,组分Ⅳ对HepG2的抑制率大大提升,其抑制率达到92.54%(P<0.05),由图6可知,组分Ⅳ的DPPH自由基清除能力最强,表明活性肽的抗氧化活性和抗肿瘤活性存在一定的构效关系,其细胞抑制率与抗氧化活性呈相似的趋势,即抗氧化活性越好其细胞抑制率越高。有研究表明,活性肽的抗肿瘤活性和带正电氨基酸(Lys、Arg和His)[19]有关,其含量越高,抗肿瘤活性越强。这可能是组分Ⅳ的带正电氨基酸和抗氧化活性共同所致。而组分Ⅰ和组分Ⅱ对HepG2的抑制率却下降,可能是由于其疏水氨基酸或带电氨基酸少于其他组分,活性肽不能很好地与癌细胞的细胞膜结合并激发细胞内通路,导致抗肿瘤活性下降。胡小军等[27]从鱿鱼中筛选的抗氧化肽不仅具有较好的抗氧化活性,对胃癌细胞的增殖也有明显的抑制活性(IC50值为21.10 mg/mL),表明抗氧化肽也具有一定的抗肿瘤活性。

图7 二步酶解物及其不同组分对HepG2的抑制能力Fig.7 Anti-tumor activity of two-step enzymatic hydrolysate and their components on HepG2 cells
3 结论
以青鱼肉为原材料,以清除DPPH自由基的IC50和DH为评价指标,筛选出碱性蛋白酶-复合蛋白酶为制备青鱼肉多肽的最优酶解组合。通过优化确定制备青鱼肉活性肽的最佳工艺条件为:pH为8.00、酶解温度为50 ℃、料液比为2∶10(g∶mL)、酶添加量为6 000 U/g、酶解时间为3 h。此时,酶解物的清除DPPH自由基的IC50值为9.52 mg/mL,主要由分子质量范围集中在130~1 397 Da的4个肽组分组成。肽组分I-Ⅳ都具有一定的抗氧化能力,其中组分Ⅳ的DPPH自由基清除能力最强,IC50为3.17 mg/mL,当组分Ⅳ质量浓度为10 mg/mL时,对HepG2细胞的抑制率为92.54%,表明制备的青鱼肉多肽同时具有抗氧化和抗肿瘤活性。
