苦参素对肿瘤源性内皮细胞生物学行为的作用及其分子机制
2021-03-18张彩灵黄赞松13
张彩灵黄赞松13
(1. 右江民族医学院附属医院消化内科,广西 百色 533000;2. 右江民族医学院研究生学院,广西 百色 533000;3. 广西肝胆疾病临床医学研究中心,广西 百色 533000)
在全球范围内,原发性肝癌(简称肝癌) 在肿瘤死亡率中排名第3位[1],而在我国,肝癌死亡率在主要恶性肿瘤中排名第2位,仅次于肺癌[2]。尽管近几年来肝癌的预防、检测和治疗方面取得了显著进展,但由于肝癌早期无明显症状,导致诊断时已处于晚期,治疗效果差,预后欠佳[3-4]。肝癌作为一种高度异质性的恶性肿瘤,其组织血供丰富,因此抗肝癌血管生成的治疗具有重大意义。
苦参素是从豆科植物苦参、苦豆子、山豆根中提取的一种生物活性成分,以氧化苦参碱为主,具有抑制肿瘤细胞增殖、抑制肿瘤细胞侵袭迁移、抑制肿瘤血管生成等抗肿瘤特性,通过多种不同作用机制它也可以发挥一定的抗肝癌作用[5-6]。转录因子E26转化特异性序列1(E26 transformation-specific sequence 1,Ets-1)是一种54 kDa的核蛋白,是内皮细胞基因转录的主要调控因子,研究表明[7]VEGF可以通过刺激Ets-1的乙酰化来刺激RNA聚合酶Ⅱ暂停释放以驱动内皮细胞的血管生成反应。有研究发现[8]通过上调人脐静脉内皮细胞(HUVEC)中的Ets-1转录来提高 VEGFR1表达,可能抑制 VEGFR2介导的促血管生成反应,但大量证据表明[9]Ets-1在肿瘤细胞及肿瘤相关基质细胞中表达增高。肿瘤血管生成历经血管内皮基底膜降解、内皮细胞增殖及迁移等过程,是肿瘤发生发展的关键步骤,目前对于苦参素如何抑制肿瘤血管生成的作用及机制仍不十分明确。本研究通过肝癌细胞条件培养基将HUVEC诱导形成肿瘤源性内皮细胞(tumor-derived endothelial cells,Td-EC),观察苦参素对Td-EC增殖、迁移及血管形成等肿瘤细胞生物学行为及Ets-1表达的影响,探讨其作用的可能分子机制。
1 材料与方法
1.1 材料 HUVEC购自中国科学院昆明细胞库,人肝癌HepG2细胞由右江民族医学院廖长秀博士惠赠,苦参素注射液购自郑州卓峰制药有限公司(批号:国号准字H20033744,规格:2 ml,0.2 g×10支/盒),胎牛血清购自Gemini公司(批号:A24G00J),DMEM高糖培养基购自Gibco公司(批号:8119272),内皮细胞培养基ECM(包含500ml基础培养基、25 ml胎牛血清、5 ml内皮细胞生长补充剂、5 ml青霉素/链霉素溶液)购自Sciencell公司(批号:No.28094),CCK-8试剂盒购自MCE公司(批号:No.42830),Matrigel Basement Membrane Matrix(基质胶)购自BD公司(货号:356234,批号:9246010),0.25%胰蛋白酶-EDTA消化液、二甲基亚砜购自北京索莱宝科技有限公司,RNAiso Plus、逆转录试剂盒、TB Green○RPremix Ex TaqTM试剂盒及引物购自宝生物工程(大连)有限公司。
1.2 方法
1.2.1 细胞培养 HUVEC采用含5%胎牛血清、内皮细胞生长补充剂(ECGS)的ECM培养,置于37℃、含5% CO2培养箱中贴壁培养,细胞密度达70%~80%时可进行传代,每2~3 d传代1次,所有实验均采用对数生长期细胞。HepG2细胞在含有10%胎牛血清的DMEM培养基中培养,置于37℃、含5% CO2培养箱中贴壁培养,所有实验均采用对数生长期细胞。当细胞密度达70%时,更换为无血清的DMEM培养基继续培养48 h后收集细胞上清液,1000 r/min离心5 min,用0.22 μm过滤器过滤,并在-80℃下储存作为条件培养基。将HUVEC与含有50%HepG2细胞条件培养基的内皮细胞培养基一起培养48 h,以变成Td-EC,检测肿瘤内皮标志物1(TEM1)和肿瘤内皮标志物8(TEM8)来验证Td-EC的身份,可以有助于与HUVEC区分[10]。通过检测TEM1、TEM8的表达升高确认HUVEC已向Td-EC转变,表明Td-EC细胞模型成功,应用于后续实验。
1.2.2 CCK-8法检测苦参素对Td-EC的抑制作用 收集Td-EC,胰酶消化重悬成单细胞悬液,计数,调整细胞密度为5×104个/毫升,100微升/孔接种于96孔板中。设实验组(苦参素组)、阴性对照组(含等量完全培养基)、空白对照组(只含完全培养基,不含苦参素、细胞),每组设4个复孔。预培养24 h后,弃旧培养基,分别向实验组加入含苦参素浓度为0.375 mg/ml、0.75 mg/ml、1.5 mg/ml、3 mg/ml、6 mg/ml的完全培养基,100微升/孔;向阴性对照组及空白对照组加入等量完全培养基。继续培养24 h后,每组分别加入10微升/孔CCK-8溶液,继续孵育3 h,用酶标仪测定在450 nm波长处各组吸光度值(A值),计算苦参素对细胞作用24 h后的抑制率。实验非同日重复3次。计算公式:抑制率(%)=[1-(实验组A值-空白对照组A值)-(阴性对照组A值-空白对照组A值)]×100%。选择半数抑制率(50% inhibitory concentration,IC50)的药物浓度作为后续实验干预条件。
1.2.3 细胞划痕实验检测苦参素对Td-EC迁移的影响 在6孔板孔底部背面画5条平行的直线做标记。胰酶消化HUVEC重悬成单细胞悬液,计数,调整细胞密度为 5×104个/毫升,2毫升/孔接种到6孔板中,诱导HUVEC变成Td-EC后当细胞密度至80%~90%时,用无菌的10 μl枪头垂直所画标记直线方向在每孔内划2条痕。用无血清的ECM基础培养基轻洗2遍。实验分为2组,实验组加入含IC50浓度(经计算为3.5 mg/ml)苦参素的低血清浓度培养基(含0.5%胎牛血清、含50%HepG2细胞条件培养基),阴性对照组加入等量低血清浓度培养基,于不同时间点(0 h、24 h)在划痕的同一位置观察拍照,每孔随机4个拍照点,每组细胞设3个复孔。实验非同日重复3次。用Image J软件统计划痕面积,计算各组细胞划痕愈合率。计算公式:划痕愈合率(%)=(0 h的划痕面积-24 h的划痕面积)/0 h的划痕面积×100%。
1.2.4 体外血管形成实验检测苦参素对Td-EC管形成的影响 取预冷的融解基质胶50微升/孔均匀涂布96孔板,置于37℃培养箱中1 h。实验组分为2组,实验组加入含IC50浓度(经计算为3.5 mg/ml)苦参素的ECM,阴性对照组加入等量培养基,胰酶消化Td-EC后用对应组别的培养基重悬成单细胞悬液,计数,调整细胞密度为 2×105个/毫升,100微升/孔接种于基质胶表面。于不同时间点(3 h、24 h)用倒置显微镜观察每孔管形成变化,每孔随机4个拍照点,每组细胞设3个复孔。实验非同日重复3次。用Image J软件统计管形成的数量。
1.2.5 实时定量逆转录PCR(real-time quantitative reverse transcription PCR,real-time qRT-PCR)检测Ets-1 mRNA的表达 设HUVEC组、Td-EC组,同时将Td-EC作为实验对象分为2组,实验组加入含IC50浓度(经计算为3.5mg/ml)苦参素的ECM,阴性对照组加入等量培养基。药物干预24 h后,采用RNAiso Plus提取细胞总RNA,按PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒说明书制备cDNA。以cDNA为模板,GAPDH为内参进行实时荧光定量PCR。Ets-1引物序列:上游引物5′-GTCATTCCTGCTGCTGCCCTA-3′,下游引物 5′-AGTTTGAATTCCCAGCCATCTCC-3′,产物长度137 bp,TEM1引物序列:上游引物 5′-GTGGACACAGATGAGTGCCAGA-3′,下游引物 5′-CCCTCGCTACAATAACACTCGAAG-3′,产物长度89 bp,TEM8引物序列:上游引物 5′-CAAGATGCCGGAGCAGGAATA-3′,下游引物 5′-AGGACCCACAAGGCATCGAG-3′,产物长度126 bp,GAPDH引物序列:上游引物 5′-GCACCGTCAAGGCTGAGAAC-3′,下游引物 5′-TGGTGAAGACGCCAGTGGA-3′,产物长度138 bp。反应条件:预变性95℃ 30 s;PCR反应 95℃ 5 s,60℃ 30 s,共40个循环。采用2-ΔΔCt方法计算目的基因的相对表达量,其中ΔΔCt=(实验组目的基因Ct值-实验组内参基因Ct值)-(对照组目的基因Ct值-对照组内参基因Ct值)。

2 结果
2.1 不同浓度苦参素对Td-EC增殖的影响 苦参素作用Td-EC 24 h后,各组A值总体比较差异有统计学意义(F=152.49,P<0.05),各浓度苦参素组对Td-EC增殖均有不同程度抑制作用,与阴性对照组相比差异有统计学意义(P<0.05),见表1。作用24 h的IC50为(3.58±0.37) mg/ml,故选择3.5 mg/ml的苦参素浓度作为后续实验干预条件。

表1 不同浓度苦参素作用Td-EC 24 h后A值及细胞抑制率 (n=12)
2.2 苦参素对Td-EC迁移能力的影响 细胞划痕实验显示,3.5 mg/ml浓度的苦参素作用Td-EC 24 h后划痕愈合率明显下降,与阴性对照组相比差异有统计学意义(t=-12.656,P<0.001),见图1。
2.3 苦参素对Td-EC管形成的影响 体外血管形成实验显示,Td-EC在3 h后逐渐出现管形成,3.5 mg/ml浓度的苦参素作用Td-EC 3 h后管形成数量与阴性对照组相比差异无统计学意义(t=0.781,P=0.479),3.5 mg/ml浓度的苦参素作用Td-EC 24 h后的管形成数量明显减少,与阴性对照组相比差异有统计学意义(t=-5.276,P<0.05),见图2。

图1 苦参素对Td-EC迁移能力的影响 (×40)

注:与阴性对照组比较,b:P<0.05。
2.4 Ets-1、TEM1、TEM8在Td-EC中的表达水平及苦参素对Td-EC中Ets-1 mRNA表达的影响 实时定量逆转录PCR显示,Ets-1在Td-EC中的相对表达量增高,与HUVEC相比,Ets-1 mRNA表达量差异有统计学意义(t=-5.556,P<0.05),见图3A。同时3.5 mg/ml浓度的苦参素对Td-EC中Ets-1 mRNA的表达有抑制作用,与阴性对照组相比差异有统计学意义(t=28.960,P=0.001),见图3B。与HUVEC相比,TEM1、TEM8在Td-EC中的相对表达量均增高,差异有统计学意义(P<0.05),见图3C、3D。
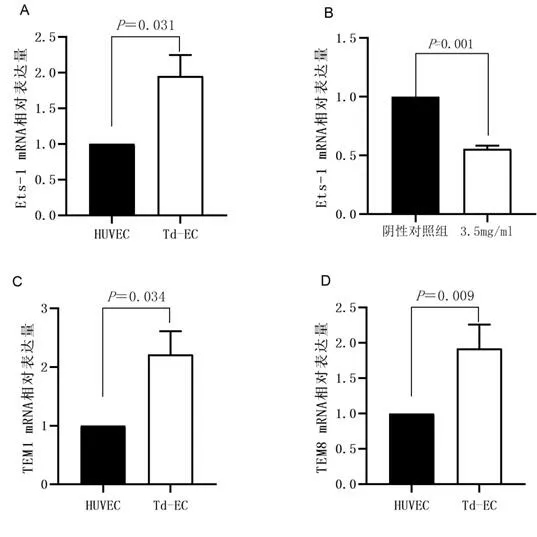
图3 各组细胞Ets-1、TEM1、TEM8 mRNA相对表达量比较
3 讨论
肿瘤可以诱导血管生成,肿瘤血管可以为肿瘤组织输送氧气及营养、促进代谢等,以利于肿瘤生长、转移,Td-EC是肿瘤血管生成的重要参与者,但Td-EC的分离应用研究仍存在困难[11]。大量研究表明,通过条件培养基共培养、三维细胞共培养等体外共培养模式,可以构建与肝癌[10]、肺癌[12]、乳腺癌[13]等多种肿瘤相关的Td-EC。肝癌是一种血管高度异质性的实体肿瘤,血管生成模式多样,机制复杂,使得抗肝癌血管生成治疗效果欠佳[14]。目前苦参素作用肝癌血管内皮细胞方面的研究少有报道,本研究通过构建肝癌细胞条件培养基共培养体系以了解苦参素有无抗肝癌血管生成作用奠定基础。Croix BS等[15]采用基因序列分析表达技术比较来源正常和恶性结直肠组织的血管内皮细胞的基因表达模式,发现了9个在肿瘤血管内皮细胞特异性表达的基因(TEM1-TEM9),并命名为肿瘤内皮标志物(tumor endothelial markers,TEM)。其中肿瘤内皮标志物1(TEM1,又称内皮唾液酸蛋白)是由757个氨基酸组成的Ⅰ型跨膜糖蛋白,肿瘤内皮标志物8(TEM8,又称炭疽毒素受体-1)是由564个氨基酸组成的Ⅰ型跨膜糖蛋白,已有研究表明,它们在正常组织及其血管中不表达或少量表达,但在肿瘤血管内皮细胞中表达明显增高,TEM1、TEM8高表达的血管内皮细胞具有肿瘤特异性[10,16-17]。本实验qRT-PCR结果显示,与HUVEC相比,Td-EC中TEM1及TEM8 mRNA表达量明显增高,从基因表达水平上验证了在HepG2细胞条件培养基作用下HUVEC向Td-EC的转变。
苦参素能影响肿瘤的血管生成,有研究发现,苦参素可抑制人肝癌SMMC-7721细胞条件培养基诱导的血管内皮细胞增殖,可能通过抑制MAPK/ERK信号传导通路来抑制肺腺癌A549细胞条件培养基诱导的HUVECs增殖与迁移,同时其联合化疗药物对肝癌、胃癌等移植瘤的血管生成有协同抗血管生成作用[12,18-20]。本研究结果显示,Td-EC增殖的抑制作用随着苦参素作用浓度增加而增强,同时,经IC50浓度苦参素作用24 h后的Td-EC与对照组相比,细胞迁移能力及小管形成能力明显下降,说明苦参素能抑制Td-EC的细胞增殖、细胞迁移及成管能力,这些数据表明苦参素可能有抗肝癌血管生成的作用,与前述文献[12,18-20]中的研究结果是一致的。Ets转录因子家族是一类含有高度保守DNA结合结构域的转录因子,调控着机体许多正常发育及病理过程,在实体肿瘤中通过驱动癌细胞自我更新、调节染色质表观遗传学等方式调控肿瘤生长,Ets-1是最早被发现的Ets转录因子,主要作为转录激活因子调节生理和病理条件下的血管生成[21]。有研究表明[22]Ets-1在非小细胞肺癌癌组织中过表达并且与肿瘤组织中的微血管密度呈正相关,它可以诱导非小细胞肺癌细胞向内皮样细胞分化以促进肿瘤肝转移。Furlan A等[13]研究发现乳腺癌细胞中过表达的Ets-1促进肿瘤细胞对内皮细胞黏附而利于肿瘤毛细血管形成,并且内皮细胞也通过募集肿瘤细胞分泌的基质金属蛋白酶-9(MMP-9)而诱发血管生成。本研究通过qRT-PCR检测结果发现,经HepG2细胞条件培养基诱导获得的Td-EC中Ets-1 mRNA表达高于HUVEC,经过苦参素作用后,Td-EC中Ets-1 mRNA表达降低,提示苦参素可能通过抑制Td-EC中Ets-1 mRNA的表达,从而抑制Td-EC的细胞增殖、细胞迁移及成管能力。
综上所述,本实验研究证实,HepG2细胞条件培养基能促使HUVEC向Td-EC转变,苦参素能抑制Td-EC增殖、迁移及成管能力,其分子机制可能与抑制Ets-1 mRNA表达有关。
