苦参素通过上调miR-204对人肝癌HepG2细胞的上皮间质转化及细胞生物学特性的影响
2021-03-182黄赞松2
2黄赞松2
(1. 右江民族医学院研究生学院,广西 百色 533000;2. 右江民族医学院附属医院,广西肝胆疾病临床医学研究中心,广西 百色 533000)
肝细胞癌(Hepatocellular carcinoma,HCC)是最常见的原发性肝癌,也是世界范围内最常见的癌症相关死亡原因之一[1]。肝癌的主要治疗方法包括肝移植、手术切除和化疗,然而,肝癌易发生转移,多数患者确诊时已错过手术治疗的时机。即使是分子靶向治疗,一线化疗药应答率也很低[1],而化疗具有化疗耐药性[2],而部分肝癌患者甚至术后亦可能发生转移,因此,HCC的治疗已成为目前全世界面临的难题。研究表明上皮间质转化(Epithelial-mesenchymal transition,EMT)与恶性肿瘤的转移与侵袭密切相关[3],还有研究表明[4],miR-204在肿瘤细胞EMT过程中发挥了重要的作用。因此,探究能够有效抑制EMT过程的药物是控制细胞侵袭和转移的前提。苦参素 (oxymatrine,OM),是传统中药苦参的主要生物活性成分,具有抗炎、抗过敏、抗纤维化、免疫调节及抗肿瘤等多种药理活性,我们实验组前期实验证明,其在抑制HCC的EMT作用中有明显作用[5],然而OM抑制肝癌细胞EMT作用的机制尚未完全明确,因此本文将探究OM抑制肝癌细胞EMT作用的可能机制。
1 材料与方法
1.1 材料
1.1.1 细胞株 人肝癌HepG2细胞由右江民族医学院基础医学院廖长秀博士惠赠。
1.1.2 主要试剂 胎牛血清、高糖DMEM培养基购自Gibco公司;OM购自郑州卓峰制药有限公司(批号:国药准字H20033744,规格2ml:0.2g);CCK8购自美国MCE公司;6孔板、96孔板购于美国Thermo公司,25 cm2细胞培养瓶购于美国Corning公司,上皮转化因子-β1(TGF-β1)购于美国PEPROTECH公司,总RNA提取试剂盒RNAiso Plus(Code No.9108)、逆转录试剂盒miR-X TMII(Code No.RR820A)、氯仿、异丙醇、国产分析纯75%的乙醇,其中用0.1%DEPC水配制75%乙醇,将其放入4℃冰箱保存;提取RNA、逆转录及扩增过程中所用的枪头、EP 管等均购自Axygen公司,以防RNA降解使用前均去RNA酶处理。兔抗E-Cadherin、Vimentin、GAPDH购自美国Cell Signal Technology公司,辣根过氧化物酶标记羊抗兔免疫球蛋白G购自Affinity公司;高效RIPA裂解液、蛋白标准品、蛋白marker、BCA法蛋白定量试剂盒、SDS-PAGE凝胶配制试剂盒、P-ECL化学发光检测试剂盒购自雅酶公司;SDS-PAGE蛋白上样缓冲液购自上海碧云天公司。
1.2 人肝癌细胞HepG2 EMT模型建立与实验分组
1.2.1 HepG2细胞株的培养 人肝癌HepG2细胞株需在含10%胎牛血清的高糖DMEM细胞培养液中,并在37℃、5%CO2饱和湿度的培养箱中培养;细胞贴壁生长于25 cm2corning培养瓶中,取对数生长期细胞用于实验。
1.2.2 人肝癌细胞HepG2 EMT模型建立 收集对数期HepG2细胞接种于6孔细胞培养板(100微升/孔,每孔含2×105个细胞),根据文献[6]的方法构建人肝癌细胞EMT模型,在细胞培养板中加入TGF-β1使其终浓度为10 ng/ml,以未用TGF-β1培养的细胞作为对照组,将细胞培养板置于37℃、5% CO2的潮湿培养箱中培养24 h,取出细胞培养板,在光学显微镜下观察对照组和模型组细胞的形态变化。
1.2.3 实验分组 处理实验分为6个组,空白组、模型组、OM 1 mg/ml组、OM 2 mg/ml组、OM 4 mg/ml组、OM 8 mg/ml组,每组细胞均在6孔板中培养48 h。
1.3 实验检测
1.3.1 CCK8检测各组OM对已发生EMT作用的HepG2细胞的增殖抑制情况 取对数生长期细胞,胰酶消化成单细胞悬液,调整至合适的细胞密度,接种至96孔板,使每孔含1×104个细胞,实验分为:空白组、模型组、OM 1 mg/ml组、OM 2 mg/ml组、OM 4 mg/ml组,OM 8 mg/ml组。次日,在模型组、OM 1 mg/ml组、OM 2 mg/ml组、OM 4 mg/ml组、OM 8 mg/ml组中各加入浓度为10 ng/ml的TGF-β1,对照组加等量培养基,作用24 h。第3天,OM 1 mg/ml组、OM 2 mg/ml组、OM 4 mg/ml组,OM 8 mg/ml组各加入含OM浓度为1 mg/ml、2 mg/ml、4 mg/ml、8 mg/ml的完全培养基,作用12 h、24 h、48 h、72 h后,于450 nm波长检测各组吸光度值(A值),实验重复3次取均值。抑制率计算公式:抑制率=[1-(实验组A值-空白对照组A值)/(阴性对照组A值-空白对照组A值)]×100%。
1.3.2 实时定量聚合酶链反应(qRT-PCR) 检测HepG2细胞中miR-204表达水平 将对数期HepG2细胞接种于6孔板中,除空白组外,OM 1 mg/ml组、OM 2 mg/ml组、OM 4 mg/ml组均使用TGF-β1诱导24 h,再使用1 mg/ml、2 mg/ml、4 mg/ml OM作用48 h。采用RNAiso Plus提取HepG2细胞总RNA,并用紫外分光光度计检测总RNA浓度;随后采用Takara公司5×PrimeScript RT Master Mix反转录试剂盒进行反转录获得总cDNA,以Takara公司2×SYBR Premix Ex Taq II试剂盒实时定量PCR检测上述不同组细胞样本中miR-204,miR-204引物由上海宝生物公司合成,引物序列为:TCCCTTTGTCATCCTATGCCTAA。反应体系:ddH2O 9.5 μl,SYBR Premix Ex TaqTMⅡ12.5 μl,上下游引物各0.5 μl,cDNA模板2 μl。PCR反应条件为:95℃ 30 s, 95℃ 5 s,60℃ 30 s,共扩增40个循环。溶解曲线分析:95℃ 5 s,60℃ 60 s,95℃ 30 s。U6作为miRNA表达的内参照,使用2-△△法分析结果。实验重复3次取均值。
1.3.3 划痕实验检测HepG2细胞迁移能力 将对数期HepG2细胞接种于6孔板中,除空白组外,OM 1 mg/ml组、OM 2 mg/ml组、OM 4 mg/ml组均使用TGF-β1诱导24 h,再使用1 mg/ml、2 mg/ml、4 mg/ml OM作用48 h。将各组HepG2细胞,制备单细胞悬液并调整细胞数目(1×106/ml),接种至96孔板,细胞培养板每孔加入1 ml单细胞悬液,培养24 h,细胞密度达80%时,用灭菌过的10μl枪头划线,用PBS洗去划痕中的细胞,加入空白培养基,培养24 h后,计算创面愈合率。创面愈合率计算:愈合率=(原始创面面积-未愈合创面面积)/原始创面面积×100%。实验重复3次取均值。
1.3.4 Western Blot检测HepG2细胞中钙黏附蛋白-E(E-cadherin)、波形蛋白(Vimentin)表达情况 将对数期HepG2细胞接种于6孔板中,除空白组外,OM 1 mg/ml组、OM 2 mg/ml组、OM 4 mg/ml组均使用TGF-β1诱导24 h,再使用1 mg/ml、2 mg/ml、4 mg/ml OM作用48 h。经OM作用48 h后,提取各组总蛋白,BCA法检测各组总蛋白浓度,100℃加热变性,取30 μg蛋白样品进行聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳反应,湿转法将蛋白质转移至PVDF膜,转膜时间根据各蛋白分子量设定,60~150 min不等,加入无蛋白快速封闭液于室温封闭10 min,洗膜3次,每次5 min,然后分别加入相应的一抗,4℃孵育过夜,TBST洗去膜上未结合的一抗,10分/次,洗3次,加入辣根过氧化物酶标记的羊抗兔免疫球蛋白G,室温孵育2 h,TBST 洗去未结合的二抗,10分/次,共洗3次,之后加入ECL发光液进行曝光显影,使用Image J软件分析各条带灰度值,计算各蛋白表达量(目的蛋白条带吸光度值/内参照条带吸光度值)。实验重复3次取均值。

2 结果
2.1 人肝癌HepG2细胞EMT模型建立 从图1可以看出,对照组人肝癌细胞HepG2多为抱团生长,细胞排列紧密,经TGF-β1 诱导后其形态发生变化; 模型组人肝癌细胞HepG2呈现梭形和纺锤形,且细胞间隙变大、排列松散。表明人肝癌细胞HepG2 EMT模型构建成功。

注:A:对照组;B:模型组。
2.2 CCK8实验检测OM对已发生EMT作用的人肝癌细胞HepG2的影响 图2结果显示,OM对已发生EMT作用的HepG2细胞增殖呈抑制作用,OM浓度分别为1 mg/ml、2 mg/ml、4 mg/ml、8 mg/ml,随着OM浓度的增加,其对已发生EMT作用的人肝癌细胞HepG2的增殖抑制率增加,且组间抑制率差异有统计学意义(P<0.05)。由于OM浓度为8 mg/ml时肝癌细胞存活较少,无法进行后续实验,故后面的实验将去掉OM 8 mg/ml组。
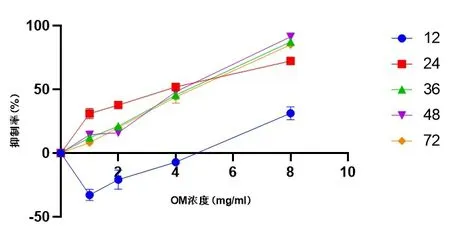
图2 OM对已发生EMT作用的人肝癌细胞HepG2抑制率的比较 (n=3)
2.3 qRT-PCR检测人肝癌细胞 HepG2中miR-204表达水平 图3结果显示,模型组和OM组HepG2细胞中miR-204表达水平高于空白组(P<0.05);与模型组相比,OM 1 mg/ml组、OM 2 mg/ml组、OM 4mg/ml组HepG2细胞中miR-204表达水平增高(P<0.05)。

注:与空白组比较,a:P<0.05;与模型组比较,b:P<0.05。
2.4 划痕实验检测人肝癌细胞HepG2迁移情况 图4结果显示,模型组HepG2细胞迁移能力高于空白组(P<0.05);与模型组相比,OM 4 mg/ml组HepG2细胞迁移能力降低(P<0.05)。

注:A:对照组;B:模型组;C:OM 1mg/ml组;D:OM 2mg/ml组;E:OM 4mg/ml组。
2.5 Western Blot 检测HepG2细胞中E-cadherin、Vimentin表达情况 图5结果显示,模型组HepG2细胞中E-cadherin 表达水平低于空白组(P<0.05),而Vimentin表达水平升高(P<0.05);OM 1 mg/ml组、OM 2 mg/ml组、OM 4 mg/ml组HepG2细胞中E-cadherin 表达水平高于模型组(P<0.05),而Vimentin表达水平降低(P<0.05)。
2.6 OM作用48 h后,HepG2细胞中miR-204的表达量与其增殖抑制率的相关性 经Spearman分析显示,OM作用48 h后,HepG2细胞中miR-204的表达量与其增殖抑制率呈正相关(r=0.965,P<0.05)。
2.7 OM作用48 h后,HepG2细胞中miR-204的表达量与E-cadherin、Vimentin表达量的相关性 经Spearman分析显示,OM作用48h后,HepG2细胞中miR-204的表达量与其E-cadherin的表达呈正相关(r=0.767,P<0.05),miR-204的表达量与其Vimentin的表达呈负相关(r=-0.765,P<0.05)。

图5 HepG2细胞中 E-cadherin、Vimentin相对表达量 (n=3)
3 讨论
我们的实验发现在建立EMT模型的基础上,使用不同浓度的OM处理HepG2 EMT模型,OM可抑制HepG2 EMT模型的增殖并可以减弱已发生EMT的HepG2细胞的的迁移能力;进一步的实验发现OM可以上调HepG2细胞中miR-204表达水平、提高HepG2细胞中E-cadherin 表达水平和下调Vimentin表达水平。
肝癌是最常见的消化道肿瘤,在中国,肝癌在癌症相关死亡率中排名第二[7]。肝癌易转移的特性给肝癌的治疗带来巨大的困难。EMT是指上皮细胞来源的恶性肿瘤细胞转化为更具迁移和侵袭能力的间质细胞的生物过程。有研究表明,EMT在原发性肿瘤的侵袭和转移过程中发挥了重要的作用[8-9],且EMT 与肝癌细胞转移密切相关[10-12],因而,抑制肝癌细胞的EMT过程对于肝癌的治疗和提高患者的生存率具有重要的意义。OM是传统中药苦参的主要生物活性成分,具有抗炎、抗过敏、抗纤维化、免疫调节及抗肿瘤等多种药理活性。近年来有关中西药治联合疗肝癌的研究取得较大进展,OM也成为临床实验研究热点之一。研究发现,氧化苦参碱具有抑制肿瘤细胞增殖[13]、诱导肿瘤细胞分化凋亡[14]、抑制肿瘤细胞黏性与浸润转移以及增强化疗药的作用[15]。本课题组前期实验发现,OM可抑制人肝HepG2细胞增殖,促进细胞凋亡[14]。在进一步研究中证明,OM可通过削弱人肝癌HepG2细胞的EMT作用,进而逆转肝癌细胞多药耐药[5],证明OM可以削弱肝癌细胞的EMT作用,但其作用的分子机制尚未完全明确。
本研究采用TGF-β1诱导人肝癌细胞HepG2后,模型组细胞呈现梭形和纺锤形,且细胞间隙变大、排列松散,表明人肝癌细胞EMT模型构建成功;在建立EMT模型的基础上,使用不同浓度的OM处理HepG2 EMT模型,发现OM可抑制HepG2 EMT模型的增殖,且呈现剂量效应。除此之外,为了进一步了解OM作用于已发生EMT的HepG2细胞后,其迁移能力的变化,我们做了划痕检测,发现模型组的细胞迁移能力高于空白组,而OM 1 mg/ml组、OM 2 mg/ml组、OM 4 mg/ml组HepG2细胞迁移能力低于模型组,且迁移能力随着OM浓度的升高呈降低趋势,结果表明,OM可以减弱已发生EMT的HepG2细胞的迁移能力。而为了在分子水平上进一步确认OM组的HepG2细胞是否发生EMT过程的减弱,本实验对E-cadherin、Vimentin这两个上皮间质转化的标志性蛋白进行检测,结果发现OM组HepG2细胞中E-cadherin 表达水平高于模型组,Vimentin表达水平低于模型组,表明OM能够逆转人肝癌细胞HepG2 EMT过程,且其作用与浓度呈正比。
文献报道[16-21],miR-204在其他肿瘤的发生发展中扮演着抑癌因子的角色,且其表达的变化可影响肿瘤细胞EMT作用。有研究发现[22],miR-204参与肝癌EMT过程,与肝癌的侵袭和迁移密切相关,为明确miR-204在肝癌中与HepG2细胞的增殖以及EMT过程的关系,我们使用qRT-PCR对miR-204进行检测,结果发现,OM作用48 h后,HepG2细胞中的miR-204表达量增高,且miR-204的表达量随OM浓度的增高而增高,且miR-204的表达量与HepG2细胞增殖抑制率呈正相关,miR-204的表达量与HepG2细胞中E-cadherin的表达呈正相关,miR-204的表达量与HepG2细胞中Vimentin的表达呈负相关,随着miR-204的表达量的增高,HepG2细胞的EMT作用呈削弱趋势,推测OM可上调HepG2细胞中miR-204的表达,并且OM可通过上调miR-204表达,减弱HepG2细胞的EMT作用,也可通过上调miR-204表达进而抑制HepG2细胞的增殖。
综上所述,我们的初步研究发现OM可上调HepG2细胞中miR-204表达,进而抑制TGF-β1诱导的人肝癌细胞HepG2的增殖、迁移及削弱其 EMT 过程,其实验发现为OM治疗HCC提供了新的实验依据。
