LXRβ调节海马突触可塑性改善APP/PS1小鼠认知功能的研究*
2021-03-17万腾飞
万腾飞,吕 彦,刘 亮△
(北部战区总医院:1.干一科;2.神经内科,沈阳 110016)
阿尔茨海默病(Alzheimer′s disease,AD)是一种起病隐匿、进行性发展的神经系统退行性疾病,主要表现为渐进性记忆和认知功能障碍及神经精神症状[1]。AD早期的病理改变主要表现为淀粉样蛋白的沉积(β-amyloid,Aβ)、神经纤维缠结和突触的丢失。既往研究表明,通过促进AD小鼠的突触形成可有效改善认知功能[2]。而成对免疫球蛋白样受体B(paired-immunoglobulin-like receptor B,PirB)能作为Aβ的受体,使丝切蛋白去磷酸化并活化,导致突触的丢失和可塑性的降低[3]。肝X 受体(liver X receptor,LXR)包括 LXRα和 LXRβ两型,属于配体激活的核转录因子,研究表明中枢神经系统中的内源性LXRβ活化能够有效调节脂代谢、神经炎症及突触可塑性[4]。然而,LXRβ能否通过PirB调节海马突触可塑性来改善AD小鼠的认知功能障碍目前尚缺乏报道。本研究采用经典的APP/PS1转基因AD模型小鼠,通过给予LXRβ激动剂,检测对APP/PS1转基因小鼠学习记忆功能的改善作用,并探讨LXRβ对PirB的影响和对海马组织突触形成的调节作用与机制,旨在为治疗AD引起的学习认知障碍提供治疗靶点,现报道如下。
1 材料与方法
1.1 材料
1.1.1试剂
LXRβ激动剂T0901317(美国Sigma公司)、PirB抗体(美国R&D公司)、β-actin抗体(英国Abcam公司)、Synapsin抗体(英国Abcam公司)、PSD-95抗体(英国Abcam公司)、生物素二抗(美国Life Technologies公司)等。
1.1.2实验动物
20只APP/PS1转基因AD模型小鼠及10只同窝野生(wild-type,WT)小鼠购于南京模式动物中心,9个月龄,雄性,所有实验小鼠饲养在温度与湿度适宜的洁净环境中,自由摄食,分笼饲养。所有动物实验按照实验动物管理及保护的有关规定进行。
1.2 方法
1.2.1实验分组与药物处理
WT小鼠作为对照组(WT组,n=10),APP/PS1双转基因小鼠分为AD组(AD组,n=10)和T0901317处理组(AD+T0组,n=10)。其中AD+T0组小鼠采用灌胃给予50 mg/kg的T0901317,连续处理14 d,WT组和AD组给予同等剂量的二甲基亚砜(DMSO)溶剂。
1.2.2新物体识别实验
参考文献[5]的方法,对小鼠进行新物体识别行为学检测。具体操作如下:先将两个完全相同的圆柱形物体(A物体)分别放在测试箱的两侧,放入小鼠让其在箱内适应3 min,再让小鼠休息15 min,进行测试阶段,将一侧的圆柱形物体换为立方体盒(B物体),立方体盒底面边长与之前的圆柱体盒直径一样,然后将待测试小鼠放入测试箱中,让其自由探索3 min,采用Ethovision XT软件记录并分析小鼠探索新物体及旧物体的时间,即鼻尖距离物体边缘小于2 cm,探索偏爱指数=小鼠探索新物体的时间(B)/小鼠探索所有物体的总时间(A+B)×100%。
1.2.3水迷宫行为学实验
参考文献[6]的方法,对小鼠进行Morris水迷宫行为学检测。具体操作如下:在正式进行行为学检测的前1 d,将所有小鼠进行适应性训练,消除不同实验组小鼠对各个象限的探索偏爱。接着对所有小鼠进行4 d正式的实验训练,将小鼠放入水中,让小鼠游泳找到隐藏的平台,总共限时60 s,若在60 s以内未能找到平台,则将小鼠放到平台上,小鼠每次在平台上停留20 s,记录小鼠每次找到平台的潜伏期。第5天将平台撤去,检测小鼠对平台象限的记忆水平。每次试验进行60 s,记录小鼠找到正确象限的潜伏期,并记录小鼠在60 s内进入正确象限的总次数。
1.2.4免疫组织化学检测
小鼠行为学检测结束后,对小鼠进行灌注,取材,将脑组织利用4%及30%蔗糖溶液进行脱水固定后,进行冰冻切片。用0.01 mol/L磷酸盐缓冲液(PBS)对小鼠脑切片进行漂洗,加入一抗兔抗-离子钙结合衔接分子-1(Iba-1),放入4 ℃冰箱中孵育12 h,再用0.01 mol/L PBS进行漂洗后,加入生物素二抗,在37 ℃孵箱中反应3 h,再用0.01 mol/L PBS进行漂洗,加入SABC溶液放入到37 ℃孵箱中反应1 h,漂洗后采用DAB溶液进行显色,贴片,采图。统计海马组织中Iba-1阳性细胞数,并计算出Iba-1阳性细胞数的密度,每组共采用4个标本进行检测,以此反映小胶质细胞数量。
1.2.5Western blot检测
取材后,将小鼠脑组织置于冰上分离出海马组织,加入组织裂解液,用组织破碎机对海马组织进行研磨,离心后取上清液。利用BCA试剂盒对各标本的蛋白浓度进行测定。按照说明书上的流程配制十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳凝胶,加入蛋白样品进行电泳,接着采用湿转法转移到聚偏氟乙烯(PVDF)膜,用5%的脱脂奶粉溶液对PVDF膜进行封闭3 h,漂洗后分别加入对应的抗体,在4 ℃条件下孵育12 h,采用TBST清洗后,分别加入对应的二抗,在37 ℃条件下反应2 h,漂洗后加入发光液,用Bio-Rad ChemiDoc MP多功能成像系统显影采图。最后利用ImageJ软件对各条带上的灰度值进行分析,并以β-actin为内参计算出成对免疫球蛋白样受体B(PirB)、海马突触相关蛋白Synapsin和PSD-95相对表达水平。并以WT组为参考,分别算出各组目的蛋白的相对表达水平,每组共采用4个标本进行检测。
1.3 统计学处理
2 结 果
2.1 T0901317对AD小鼠认知功能的影响
新物体识别行为学检测发现,AD组存在短时记忆的障碍,表现为对新物体的探索偏爱指数明显低于WT组,而AD+T0组对新物体的探索偏爱指数明显提升(P<0.05)。Morris水迷宫行为学检测发现,在第5天测试阶段,AD组在目标象限停留时间百分比明显低于WT组(P<0.05),AD组同时进入目标象限的次数也明显低于WT组(P<0.05)。而AD+T0组在目标象限停留时间百分比及进入目标象限的次数明显增加(P<0.05),见图1。

A:小鼠进行新物体识别实验对新物体的探索偏爱指数;B:Morris水迷宫实验中小鼠在目标象限停留时间所占的百分比;C:Morris水迷宫实验中各组小鼠进入目标象限的次数;a:P<0.05,与WT组比较;b:P<0.05,与AD+T0组比较。
2.2 T0901317对AD小鼠海马组织Iba-1阳性细胞数的影响
免疫组织化学检测发现,AD组海马组织Iba-1阳性细胞数比WT组多(P<0.05),而AD+T0组海马组织Iba-1阳性细胞数明显降低(P<0.05),见图2。

A:WT组小鼠海马组织Iba-1免疫组织化学染色图;B:AD组小鼠海马组织Iba-1免疫组织化学染色图;C:AD+T0组小鼠海马组织Iba-1免疫组织化学染色图;D:3组小鼠海马组织Iba-1阳性细胞密度统计图;a:P<0.05,与WT组比较;b:P<0.05,与AD+T0组比较。
2.3 T0901317对AD小鼠海马组织PirB、Synapsin和PSD-95表达水平的影响
Western blot检测发现,与WT组比较,AD组海马组织PirB表达水平升高,Synapsin和PSD-95表达水平降低(P<0.05),而AD+T0组PirB表达水平降低,Synapsin和PSD-95表达水平明显升高(P<0.05),见图3。
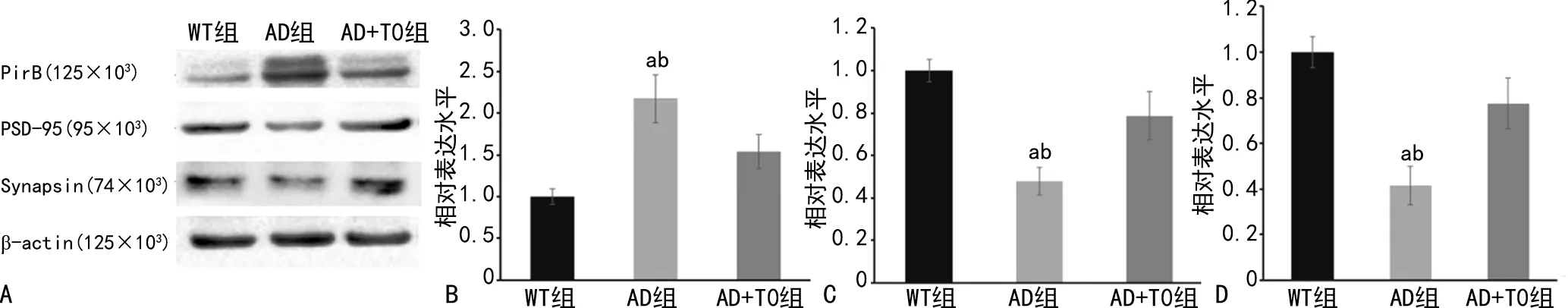
A:Western blot检测;B:小鼠海马组织PirB半定量分析 C:小鼠海马组织Synapsin半定量分析;D:小鼠海马组织PSD-95半定量分析,a:P<0.05,与WT组比较;b:P<0.05,与AD+T0组比较。
3 讨 论
AD是一种起病隐匿的进行性发展的神经系统退行性疾病。AD患者最早表现出的临床症状为海马相关的记忆丢失,是突触功能异常的结果。使用功能磁共振成像(fMRI)在体脑成像技术,发现与记忆相关的脑区往往形成异常的网络联系[7]。采用电子显微镜进行超微结构观察发现AD患者海马区域突触丢失明显,且这种突触丢失的严重程度与记忆减退的程度明显相关[8]。BERTONI-FREDDARI等[9]证实AD小鼠海马组织平均单个神经元的突触数较非AD对照组减少50%。AD患者脑组织内突触相关蛋白(Synapsin和PSD-95)的丢失与AD患者认知功能减退的程度密切相关[10]。采用免疫组织化学与免疫印迹分析表明AD患者脑组织中突触前蛋白与突触后蛋白较同龄非AD对照组明显降低,亦提示这些特异的突触蛋白参与AD病的进程[11]。同样,在AD动物模型中观察到AD早期的病理改变主要表现为淀粉样蛋白的沉积和突触的丢失。此外,通过将胚胎干细胞来源的神经前体细胞移植入AD模型大鼠内能分化为神经元并与靶区神经元建立了突触,并检测到学习记忆得到改善[12]。因此,对AD中突触功能调控机制研究为AD治疗提供重要途径。本研究结果提示,LXRβ激动剂T0901317可以通过调节AD小鼠海马组织的突触可塑性来改善认知功能。
LXR包括 LXRα和 LXRβ两型,属于配体激活的核转录因子。其中LXRα主要分布在与脂代谢相关的组织与细胞如肝脏、小肠、脂肪组织等,LXRβ在体内有更广泛的表达。研究资料显示LXR在中枢神经系统发育中亦有重要功能,其中LXRβ为主要的亚型表达受体。中枢神经系统中内源性LXRβ活化能够有效调节脂代谢与炎性反应[13]。当脑组织的炎症使疾病加重时,小胶质细胞会过多活化产生严重的神经毒性[14]。已有研究表明,LXRβ能通过核因子-κB(NF-κB)通路来减少AD小鼠中的星形胶质细胞形成,从而防止胆碱能神经元被损伤[15]。同时,LXRβ能够促进小胶质细胞对脑内的Aβ蛋白的清除[16]。在本研究中,也进一步证实了,LXRβ激动剂T0901317可以明显降低AD小鼠海马组织的Iba-1阳性细胞数,从而抑制脑内的过度炎性反应。
PirB是存在于小鼠体内和人类白细胞免疫球样蛋白受体B2(human leukocyte immunoglobulin-like receptor B2,LILRB2)同源的一类膜蛋白受体。起初发现,在免疫系统中PirB在B淋巴细胞、肥大细胞、巨噬细胞、粒细胞和树突细胞中表达,能作为主要组织相容性复合体Ⅰ(MHCⅠ)的受体来调节免疫反应[17]。近期研究发现,PirB表达在中枢神经系统的神经元和星形胶质细胞中,在中枢神经系统损伤后,PirB的表达水平增高,且能通过和轴突抑制生长因子Nogo、OMgp和MAG的相互作用来抑制轴突的生长和神经元的可塑性[18-19]。此外,PirB的突变鼠,在视神经损伤后对比对照组,表现出极强的视皮层的可塑性[20]。最新研究发现,在AD小鼠中,PirB能作为Aβ的受体,使蛋白磷酸酶PP2A和PP2B上调,从而使丝切蛋白去磷酸化并活化,活化的丝切蛋白使肌动蛋白丝解聚,最终导致突触的丢失和可塑性的丢失[3]。本研究也进一步发现,通过活化内源的LXRβ可以降低AD小鼠海马组织PirB的表达水平,同时上调突触相关蛋白的表达,进而改善AD小鼠的认知功能,提示LXRβ可能通过PirB调节AD小鼠海马的突触可塑性,进而改善记忆和认知功能障碍。
综上所述,本研究证实了LXRβ激动剂激活内源性LXRβ会对AD所致的突触损伤有一定的修复作用,并能改善AD小鼠的记忆和认知功能障碍。该研究可为治疗AD提供新的靶点,并提供干预的措施以缓解AD引起的记忆和认知功能障碍,为临床治疗AD患者提供新的药物可能。
