血府逐瘀汤诱导内皮祖细胞对心肌缺血模型大鼠缺血区血管新生的影响
2021-03-16李蕾何莉苏畅梁昊张秋雁杨漾谢辉谭精培
李蕾,何莉,苏畅,梁昊,张秋雁,杨漾,谢辉,谭精培
血府逐瘀汤诱导内皮祖细胞对心肌缺血模型大鼠缺血区血管新生的影响
李蕾,何莉,苏畅,梁昊,张秋雁,杨漾,谢辉,谭精培
湖南中医药大学,湖南 长沙 410208
观察血府逐瘀汤诱导内皮祖细胞(EPCs)对心肌缺血模型大鼠缺血区血管新生的影响,探讨其作用机制。采用结扎冠状动脉左前降支方法制备急性心肌缺血模型。实验大鼠随机分为正常组、假手术组、模型组、他汀组和血府逐瘀汤低、中、高剂量组。造模后将荧光标记的EPCs尾静脉注射植入模型大鼠体内,成模后灌胃给药,给药第3日和第7日分别采血,取材缺血坏死部位肉芽组织和肌肉组织,行冰冻切片分析荧光表达,HE染色观察样本坏死病变情况,免疫组化检测心肌组织CD106、CD146的表达,计数新生血管数量,硝酸还原酶法检测血清和心肌缺血区一氧化氮(NO)表达。与模型组比较,血府逐瘀汤各剂量组均能促进EPCs迁移至大鼠心肌缺血区,提高CD106、CD146的表达,促进心肌缺血区血管新生,明显升高血清和心肌组织NO含量,差异均有统计学意义(<0.01),血府逐瘀汤高剂量组效果最佳。血府逐瘀汤可诱导EPCs促进心肌缺血区血管新生,其作用机制与促进内皮细胞CD106、CD146表达及升高血清和心肌组织NO水平有关。
血府逐瘀汤;内皮祖细胞;血管新生;一氧化氮;大鼠
缺血性心脏病(ischemic heart disease,IHD)是由于冠状动脉循环改变引起的冠状动脉血流供应与心肌需求之间不能平衡所导致的心肌损害。在心肌缺血或梗死早期,毛细血管密度增加,坏死细胞释放一系列促血管生成因子生成新的旁路,改善心肌的缺血状态。内皮祖细胞(endothelial progenitor cells,EPCs)是血管内皮的前体细胞,在成体血管新生中发挥着重要作用[1]。在生理或病理因素等刺激下,EPCs从骨髓动员到外周血,在体内缺血组织中整合形成新生血管的前体细胞,外源EPCs治疗冠心病已从基础研究推广至临床,能明显改善心肌梗死和介入手术患者的预后[2-4]。血府逐瘀汤是治疗缺血性心脏病的代表方,近年来,大量临床和实验研究表明,其具有较好的抗心肌缺血的作用[5]。中医祛瘀生新理论是在活血化瘀基础上的进一步认识和深化。其中,抗血小板、扩张冠状动脉、改善血液流变等作用属“祛瘀”之功,而促进血管新生则为“生新”之效。EPCs在冠心病的发生、发展中扮演着重要角色[6]。本实验通过将荧光标记的EPCs尾静脉注射植入急性心肌缺血模型大鼠体内,探讨血府逐瘀汤诱导EPCs参与心肌缺血区血管新生的作用机制。
1 实验材料
1.1 动物
SPF级雄性SD大鼠70只,体质量220~240 g,湖南斯莱克景达实验动物有限公司提供,动物质量合格证号43004700048705,动物许可证号SYXK(湘)2013-0005。饲养于湖南中医药大学实验动物中心清洁级动物房,温度20~25 ℃,相对湿度55%~60%,自由摄食饮水。
1.2 药物及制备
血府逐瘀汤(当归9 g,生地黄9 g,桃仁12 g,红花9 g,枳壳6 g,牛膝9 g,川芎4.5 g,柴胡3 g,赤芍6 g,甘草6 g,桔梗4.5 g),饮片购于湖南中医药大学第一附属医院,加10倍量水浸泡0.5 h,加热回流提取1 h,过滤,第2次加8倍量水,再煮1 h,合并2次煎液,浓缩至含原药材0.78 g/mL。阿托伐他汀钙片,浙江新东港药业股份有限公司,批号20180605,配制成0.5 mg/mL混悬液。
1.3 主要试剂与仪器
Rat骨髓细胞分离液(天津灏洋生物科技有限公司,货号VE2012TARK),EGM-2培养基(瑞士LONZA公司,货号CC-3162),NO试剂盒(南京建成生物科技有限公司,货号A031-2),CD106一抗(英国Abcam公司,货号ab134047),CD146一抗(美国Proteintech公司,货号1756-1-AP)。台式高速冷冻离心机(湘仪H1650R),全自动酶标洗板机(深圳汇松PW-812),多功能酶标分析仪(深圳汇松MB-530)。
2 实验方法
2.1 骨髓源内皮祖细胞原代分离及培养
大鼠脱颈处死后,分离四肢,剔除周围肌肉组织,75%酒精浸泡5 min,无菌平皿中剪开骨两端,2 mL无菌注射器吸取10%FBS DMEM高糖培养基,反复冲洗骨髓腔。将所得细胞悬液过200目细胞滤网,400×离心5 min收集细胞。取新的离心管,依次加入分离液1、分离液2,制成梯度界面,吸管吸取细胞悬液加于分离液液面上,2000 r/min离心30 min。离心后,离心管中由上至下分为6层,吸管吸取第2层到另一15 mL离心管中,向该离心管中加入5 mL洗涤液,混匀细胞,1000 r/min离心10 min,弃上清液,吸管吸取培养基轻轻吹打混匀,制成细胞悬液,37 ℃、5%CO2培养箱培养24 h,收集未贴壁细胞,换用EGM-2培养基接种于纤维连接蛋白(FN)包被的培养皿中。每3 d换液1次[7]。
2.2 免疫荧光鉴定内皮祖细胞
细胞培养2周后,用胰酶消化细胞,接种于FN包被的爬片上,培养过夜后收集爬片,PBS洗2次;弃PBS后加入4%多聚甲醛,室温固定20 min;PBS冲洗3次,每次5 min;0.3%TritonX-100通透30 min,再用PBS冲洗3次,每次5 min;用5%BSA 37 ℃封闭1 h;滴加适当稀释的一抗(CD34),4 ℃过夜,PBS冲洗3次,每次5 min;滴加100 μL抗兔-IgG标记荧光抗体,37 ℃孵育90 min,PBS冲洗3次,每次5 min;90%甘油封片;置于荧光显微镜下观察。
2.3 荧光标记内皮祖细胞
胰酶消化EPCs,无血清EGM-2培养基重悬细胞,制备细胞悬液,调整细胞密度为5×106/管;取2 μL PKH26溶液,用试剂盒自带稀释液稀释至500 μL,重悬细胞,混匀,37 ℃孵育5 min;加入100 μL血清终止,完全培养基洗细胞2次。
2.4 心肌缺血模型建立
大鼠腹腔注射10%水合氯醛麻醉,行气管插管,连接小动物呼吸机,观察并记录心电图变化。于左前第4/5肋间开胸,逐层钝性分离,置入2个小型拉钩,向两边拉开肋骨,暴露心脏,撕开心包膜,轻提左心耳,充分暴露肺动脉圆锥,以左心耳和肺动脉圆锥交界处的左冠状动脉主干为标志,用6/0无创缝合丝线穿过心耳下缘的心肌浅层,结扎冠状动脉左前降支。结扎后心室壁颜色变暗,心电图可见ST段抬高伴肢导联R波高尖为结扎成功的标志。术后青霉素肌注连续3 d,预防感染。
2.5 分组及给药
心肌缺血大鼠模型制备后,将“2.3”项下荧光标记的EPCs以5×106/mL,尾静脉注射1 mL细胞悬液入模型鼠体内,并于造模后第2日给药。大鼠随机分为正常组、假手术组、模型组、他汀组和血府逐瘀汤高、中、低剂量组(中药高、中、低剂量组)。正常组不施加任何干预,假手术组只在左前降支穿线不打结,模型组给予生理盐水20 mL/(kg•d)灌胃,他汀组腹腔注射阿托伐他汀混悬液0.3 mg/(kg•d),中药低、中、高剂量组分别给予血府逐瘀汤药液3.9、7.8、15.6 g/(kg•d)灌胃,给药体积20 mL/kg,连续7 d。
2.6 标本采集
给药第3日和第7日采血,分离血清,置于-20 ℃保存,第7日处死大鼠,开胸后取出心脏,取一等份缺血坏死部位肉芽组织和肌肉组织,OCT包埋,冰冻切片,一等份心肌组织,4%多聚甲醛固定液固定,石蜡包埋,制成厚约5 μm组织切片。
2.7 指标检测
2.7.1 内皮祖细胞迁移分布检测
将样本用OCT包埋,冰冻切片;将切片置于冰丙酮中固定15 min,蒸馏水水洗;切片置蒸馏水中脱胶30 min;DAPI工作液37 ℃染核10 min,PBS冲洗3次,每次5 min;缓冲甘油封片,荧光显微镜下观察并拍照,每个样本随机选取6个视野,分析各视野荧光强度,取其均数作为该样本的荧光强度。
2.7.2 心肌组织病理观察
60 ℃烤片1~2 h;将切片置于二甲苯中10 min×2次,然后依次置于100%、 95%、85%、75%梯度乙醇,每级5 min,再用蒸馏水浸洗5 min;苏木素染色约30 s,蒸馏水冲洗,PBS返蓝;伊红染色约30 s,蒸馏水冲洗;梯度乙醇(95%~100%)脱水,每级5 min。取出后置于二甲苯中10 min×2次,中性树胶封片,显微镜下观察并拍照。
2.7.3 免疫组化检测心肌组织CD106、CD146的表达和血管计数
60 ℃烤片30 min;置于二甲苯中10 min×2次,再依次置于100%、95%、85%、75%乙醇,每级放置5 min,再用蒸馏水浸洗5 min;将切片浸入0.01 mol/L枸橼酸盐缓冲液(pH 6.0),微波炉加热至沸腾后断电,连续煮15 min后,冷却15 min取出,冷却至室温,0.01 mol/L PBS(pH 7.2~7.6)洗涤3次,每次3 min;加入3%H2O2,室温10 min,以灭活内源性酶,PBS冲洗3次,每次3 min;滴加适当稀释的一抗(CD106,CD146),4 ℃过夜,PBS冲洗3次,每次5 min;滴加50~100 μL抗兔-IgG抗体-HRP多聚体,37 ℃孵育30 min,PBS冲洗3次,每次5 min;滴加预制好的显色剂工作液50~100 μL,室温孵育1~5 min,镜下控制反应时间,蒸馏水洗涤;苏木素复染10 s左右,蒸馏水冲洗,PBS返蓝;各级乙醇(60%~100%)脱水,每级5 min。取出后置于二甲苯10 min,2次,中性树胶封片,显微镜下观察。阳性染色为黄色或棕黄色(深可至褐色)。每张组织切片400倍下摄取6个视野,运用Image-Pro Plus专业图像分析软件对图片进行分析,计算相同面积内相关指标阳性表达的积分光密度(IOD值)。每个样本在400倍镜下随机选取6个视野计数血管,以均值作为该样本的新生血管数量。
2.7.4 血清和心肌缺血区一氧化氮含量测定
腹主动脉取血,离心,取上清液,硝酸还原酶法测定血清和心肌缺血区NO含量,严格按照试剂盒说明书进行操作。
3 统计学方法
4 结果
4.1 血府逐瘀汤对模型大鼠内皮祖细胞迁移的影响
荧光显微镜下观察结果显示,蓝色是DAPI染核信号,红色荧光是EPCs阳性染色信号。与模型组比较,他汀组和中药低、中、高剂量组红色荧光信号明显增强,差异有统计学意义(<0.01,<0.05);他汀组荧光信号较中药各剂量组明显增强,差异有统计学意义(<0.01,<0.05);与中药低剂量组比较,中药中、高剂量组荧光信号明显增强,差异有统计学意义(<0.05,<0.01);与中药中剂量组比较,中药高剂量组红色荧光信号明显增强,差异有统计学意义(<0.01)。表明血府逐瘀汤能促进EPCs迁移至大鼠心肌缺血区,与药物浓度呈正相关。结果见表1、图1。
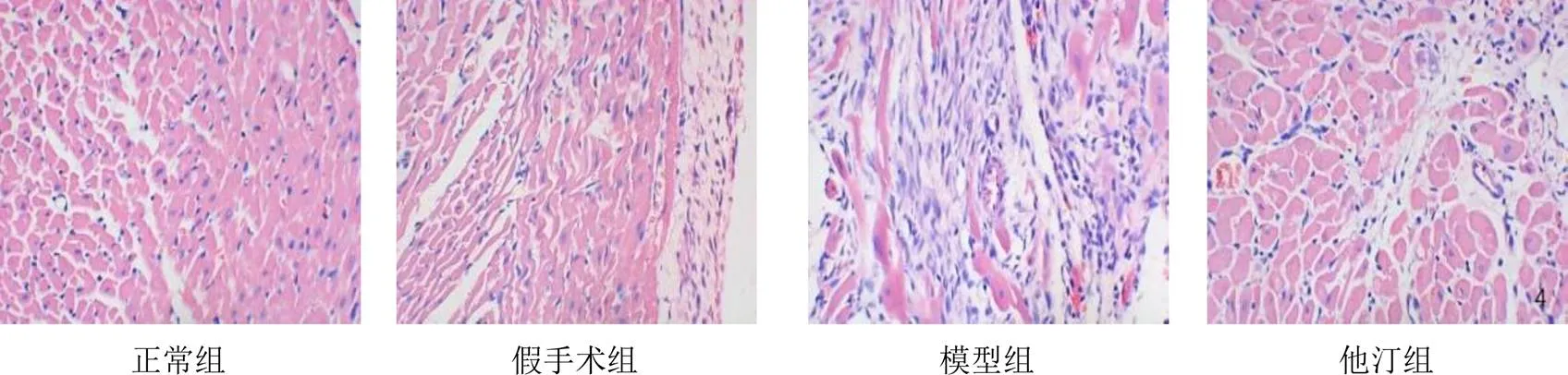
4.2 病理观察结果
正常组和假手术组大鼠心肌细胞排列整齐,可见横纹,细胞间隙均匀;模型组大鼠可见梗死灶,心肌细胞排列紊乱,细胞水肿变性,间质变宽,心肌细胞纤维化,大量炎性细胞浸润;中药低剂量组大鼠心肌细胞排列紊乱,细胞水肿,可见炎性细胞;中药中、高剂量组和他汀组大鼠心肌细胞排列较为规则,部分细胞轻度水肿,变性明显减轻,中药高剂量组大鼠心肌细胞变性坏死程度最轻。结果见图2。

表1 各组大鼠心肌组织EPCs荧光表达比较(±s)
注:与正常组比较,##<0.01;与模型组比较,△<0.05,△△<0.01;与他汀组比较,▲<0.05,▲▲<0.01;与中药低剂量组比较,◇<0.05,◇◇<0.01;与中药中剂量组比较,◆◆<0.01

4.3 血府逐瘀汤对模型大鼠心肌组织CD106、CD146表达的影响
镜下观察显示,新生血管阳性信号为黄色或棕色染色(深可至褐色)。正常组和假手术组大鼠心肌组织CD106呈弱阳性表达;模型组可见中等量CD106阳性染色,染色稍深;中药低剂量组和中药中剂量组大鼠心肌组织CD106阳性染色进一步加深,可见棕色颗粒;中药高剂量组和他汀组大鼠心肌组织CD106呈强阳性染色,可见大量棕褐色颗粒,见图3。CD146在正常组和假手术组表达量较少;模型组呈弱阳性表达,散在分布,染色较浅;中药低剂量组和中药中剂量组大鼠心肌组织可见中等量CD146阳性染色,染色变深,可见很多深棕色颗粒;他汀组可见CD146阳性染色,染色进一步加深;中药高剂量组CD146呈强阳性染色,阳性表达量明显高于模型组、中药低剂量组和中药中剂量组。见图4。与正常组比较,模型组大鼠心肌组织CD106、CD146蛋白表达显著升高(<0.01);与模型组比较,他汀组和中药中、高剂量组大鼠心肌组织CD106、CD146蛋白表达显著升高(<0.01);与他汀组比较,中药各剂量组大鼠心肌组织CD106、CD146蛋白表达明显下降(<0.01,<0.05);与中药低剂量组比较,中药中、高剂量组大鼠心肌组织CD106、CD146蛋白表达明显升高(<0.01);与中药中剂量组比较,中药高剂量组大鼠心肌组织CD106、CD146蛋白表达明显升高(<0.05)。结果见表2。
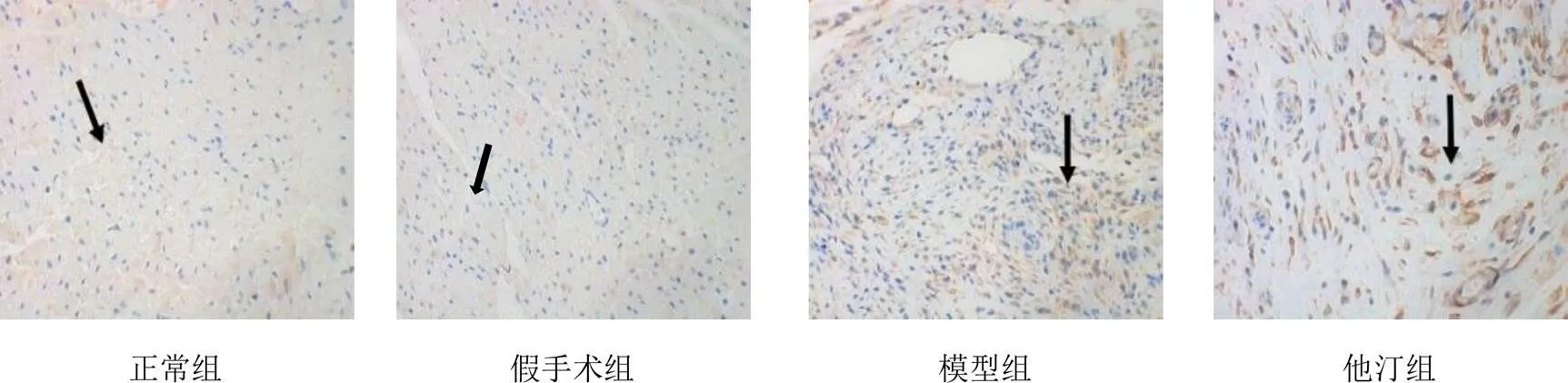

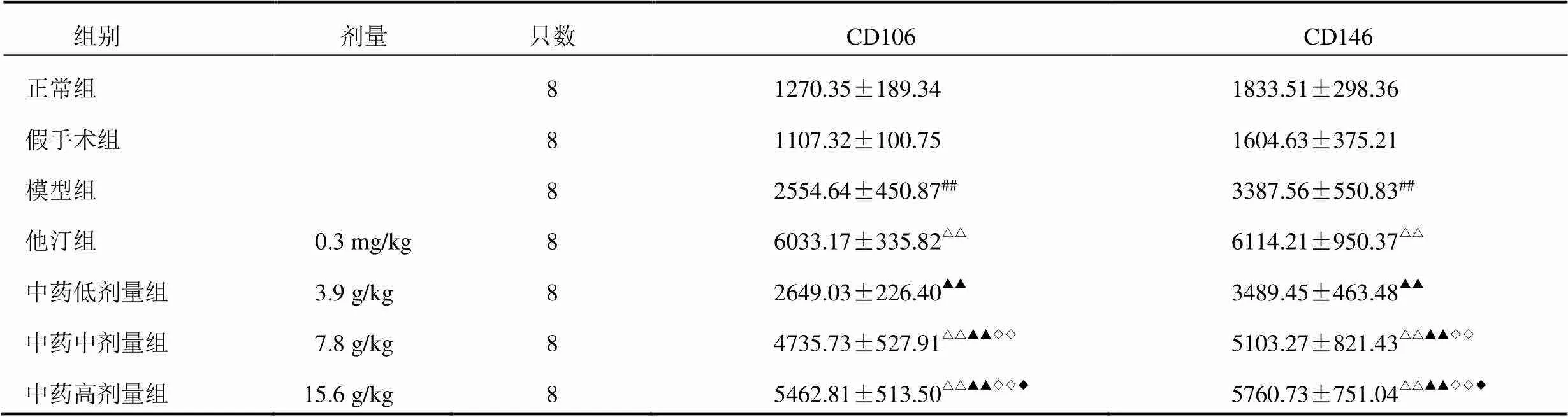
表2 各组大鼠心肌组织CD106、CD146蛋白表达比较(±s,IOD值)
注:与正常组比较,##<0.01;与模型组比较,△△<0.01;与他汀组比较,▲▲<0.01;与中药低剂量组比较,◇◇<0.01;与中药中剂量组比较,◆<0.05
4.4 血府逐瘀汤对模型大鼠新生血管数量的影响
正常组与假手术组大鼠新生血管数量比较差异无统计学意义(>0.05);与正常组比较,模型组大鼠新生血管数量明显增加,差异有统计学意义(<0.01);与模型组比较,他汀组和中药中、高剂量组大鼠新生血管数量明显增加,差异有统计学意义(<0.01);与他汀组比较,中药各剂量组大鼠血管数量明显减少,差异有统计学意义(<0.01);与中药低剂量组比较,中药中、高剂量组大鼠新生血管数量明显增加(<0.01);与中药中剂量组比较,中药高剂量组大鼠血管数量明显增加(<0.05)。结果见表3。
4.5 血府逐瘀汤对模型大鼠血清和心肌组织一氧化氮含量的影响
正常组与假手术组大鼠NO含量比较差异无统计学意义(>0.05);与正常组比较,模型组大鼠血清和心肌组织NO含量均明显降低,差异有统计学意义(<0.01);与模型组比较,他汀组和中药中、高剂量组大鼠血清和心肌组织NO含量明显升高,差异有统计学意义(<0.01);与他汀组比较,中药低、中剂量组大鼠血清和心肌组织NO含量明显降低,差异有统计学意义(<0.01,<0.05),中药高剂量组NO含量差异无统计学意义(>0.05);与中药低剂量组比较,中药高剂量组NO含量明显升高,差异有统计学意义(<0.01,<0.05),中药中剂量组NO含量差异无统计学意义(>0.05);与中药中剂量组比较,中药高剂量组大鼠血清和心肌组织NO含量差异无统计学意义(>0.05)。结果见表4。

表3 各组大鼠新生血管数量比较(±s,个)
注:与正常组比较,##<0.01;与模型组比较,△△<0.01;与他汀组比较,▲▲<0.01;与中药低剂量组比较,◇◇<0.01;与中药中剂量组比较,◆<0.05

表4 各组大鼠血清和心肌组织NO含量比较(±s,μmol/L)
注:与正常组比较,##<0.01;与模型组比较,△△<0.01;与他汀组比较,▲<0.05,▲▲<0.01;与中药低剂量组比较,◆<0.05,◆◆<0.01
5 讨论
IHD属中医学“胸痹”范畴。血府逐瘀汤是活血化瘀经典方。方中桃仁破血行滞而润燥,红花活血祛瘀以止痛,共为君药;赤芍、川芎助君药活血化瘀,牛膝引瘀血下行,使血不郁于胸中,痰热不上扰。该方配伍严谨,既能行血分瘀滞,又能解气分郁结;活血不耗血,行气不伤阴;能够升达清阳,降泄下行,使气血调和。
心肌缺血后会激发自身血管新生机制,毛细血管密度增加,释放多种促血管生成因子,形成新的旁路循环,但仍不足以代偿缺血造成的血流损失和使血管恢复到正常生理功能。因此,尽早恢复供血,促进新的血管生成是修复损伤的关键所在。
EPCs能增殖和分化成为血管内皮的前体细胞,修复受损伤的内皮。通过对缺血区的新生血管数量进行测定、分析比较发现,与正常组和模型组比较,中药各剂量组新生血管数量明显增多,中药高剂量组新生血管数量最多。对缺血心肌组织进行病理观察发现,与正常组比较,模型组可见大面积梗死灶,心肌细胞纤维化,间质增宽;与模型组比较,中药高剂量组心肌细胞结构清晰,细胞排列较规则,少量炎性细胞浸润,中药高剂量组变性程度最轻。提示高剂量血府逐瘀汤能促进新的血管生成,保护和修复缺血损伤的心肌。本实验免疫组化结果显示,内皮细胞CD106和CD146呈阳性表达,表明其参与了受损内皮的修复,且随着给药浓度的增加,阳性表达率增高,进一步证实其在生理和病理性血管生成中的作用。
血管新生受到众多信号调控,其中NO在调控体系中发挥极大作用。NO能动员骨髓EPCs释放进入外周血。为进一步了解血府逐瘀汤诱导迁移的机制,本实验选择在动员EPCs和提高循环EPCs数量方面发挥重要作用的血管舒张因子NO作为切入点,结果显示,血府逐瘀汤能提高血清和心肌组织NO含量,结合相应的荧光表达情况,表明在血府逐瘀汤诱导EPCs迁移至心肌缺血区,促进血管新生,修复缺血损伤的过程中,NO可能是发挥关键作用的因素之一。
综上,血府逐瘀汤可诱导EPCs促进心肌缺血区血管新生,其作用机制与促进内皮细胞CD106、CD146表达及血清、心肌组织NO水平有关。
[1] HUR J, YANG H M, YOON C H, et al. Identification of a novel role of T cells inpostnatal vasculogenesis:Characterization of endothelial progenitor cell colonies[J]. Circulation,2007, 116(15):1671-1682.
[2]CHONG E, POH K K, LIANG S, et al. Two-year clinical registry follow-up of endothelial progenitor cell capture stent versus sirolimus-eluting bioabsorbable polymer-coated stent versus bare metal stents in patients undergoing primary percutaneous coronary intervention for ST elevation myocardial infarction[J]. Journal of Interventional Cardiology,2010,23(2):101-108.
[3] PEARSON J D. Endothelial progenitor cells-hype or hope?[J]. J Thromb Haemost,2009,7(2):255-262.
[4] ABDEL-LATIF A, BOLLI R, TLEYJEH I M, et al. Adult bone marrow–derived cells for cardiac repair:A systematic review and meta-analysis[J]. Archives of Internal Medicine,2007,167(10):989-997.
[5] 王菲,施红,夏韵.血府逐瘀汤治疗心脑血管疾病研究进展[J].中医学报,2013,28(11):1732-1734.
[6] 顾钰霞,刘乃丰.内皮祖细胞在冠状动脉粥样硬化性心脏病中的作用研究进展[J].东南大学学报(医学版),2014,33(3):354-358.
[7] 陆耀良,康涛,李晓强,等.大鼠骨髓源性内皮祖细胞的分离培养及鉴定[J].江苏大学学报(医学版),2013,23(6):465-469.
Effects of Endothelial Progenitor Cells Induced byDecoction on Angiogenesis of Ischemic Region in Rats with Myocardial Ischemia
LI Lei, HE Li, SU Chang, LIANG Hao, ZHANG Qiuyan, YANGYang, XIE Hui, TAN Jingpei
To observe the effects of endothelial progenitor cells (EPCs) induced byDecoction on angiogenesis in ischemic region of rats with myocardial ischemia; To explore its mechanism.Acute myocardial ischemia model was prepared by ligating the left anterior descending coronary artery. Experimental rats were randomly divided into normal group, sham-operation group, model group, atorvastatin group,Decoction low-, medium-, and high-dosage groups. After successful modeling, fluorescently labeled EPCs were injected into the model mice by tail vein injection. After modeling, the rats received gavage. On the 3rd and 7th day after administration, blood was collected and the granulation tissue and muscle tissue of the ischemic necrosis were taken. The fluorescence expression was analyzed by frozen section. HE staining was used to observe the necrotic lesions of each group and count the number of local blood vessels. Immunohistochemistry was used to detect the expressions of CD106 and CD146 in neovascularization. NO expression levels in serum and myocardial ischemic areas were determined by nitrate reductase assay.Compared with model group,Decoction groups could promote the migration of EPCs to myocardial ischemia area in rats, increase the expressions of CD106 and CD146, promote angiogenesis in myocardial ischemic area, and significantly increase the NO content in serum and ischemic tissue, with statistical significance (<0.01), and the high-dosage group achieved the best efficacy.Decoction can induce EPCs to promote angiogenesis in myocardial ischemic area. The mechanism of action is related to the promotion of endothelial cell CD106 and CD146, as well as the expression of NO in serum and myocardial tissue.
Decoction; endothelial progenitor cells; angiogenesis; NO; rats
R285.5
A
1005-5304(2021)02-0069-07
10.19879/j.cnki.1005-5304.202006290

国家自然科学基金(81574039、81503627)
张秋雁,E-mail:1746821852@qq.com
(收稿日期:2020-06-15)
(修回日期:2020-07-13;编辑:华强)
