冬凌草甲素减轻大鼠脑外伤的作用及机制
2021-03-16王松林李东波李从进宋锦宁
王松林,李东波,杨 涛,李从进,宋锦宁,金 涛*
(1陕西省安康市中心医院神经外科,安康 725000;2西安交通大学第一附属医院神经外科;*通讯作者,E-mail:20782635@qq.com)
炎症反应在脑外伤后的继发性损伤中起重要作用[1]。多种炎性因子的释放可加重脑损害,特异性的炎性因子拮抗剂可减轻脑外伤后的继发性脑损害[2,3]。冬凌草甲素是中草药冬凌草的主要成分,属贝壳杉烷型四环二萜类天然有机化合物,研究发现冬凌草甲素可共价结合Nod样受体蛋白3(NLRP3)炎性小体,从而抑制炎症小体活化,且对NLRP3相关的一些疾病有较好的预防和治疗效果[4]。而冬凌草甲素对脑外伤是否有保护作用尚不明确。
本研究拟探讨冬凌草甲素对大鼠脑外伤后胶质细胞活化、细胞凋亡、炎性因子水平的影响,并探索其潜在的分子机制,为冬凌草甲素治疗脑外伤提供一定的实验依据。
1 材料与方法
1.1 实验动物、试剂及仪器
36只遗传背景相同的SPF级成年雄性SD大鼠(8周龄)购自西安交通大学医学部实验动物中心(许可证号:SCXK(陕)08-018),合格证号:2007-001,体质量250-280 g。大鼠饲养于(22±2)℃、12 h照明/12 h黑暗的环境中,食水自由,实验前24 h禁食。该实验伦理经西安交通大学医学部生物医学伦理委员会批准。冬凌草甲素(佰世凯化学科技有限公司,28957-04-2);p38 MAPK抗体(CST,8690);Phospho-p38 MAPK(Thr180/Tyr182)抗体(CST,4631);TUNEL试剂盒(Promega,G3250);TNF-α、IL-1β、IL-6(R&D Systems,RTA00,RLB00,R6000B);免疫组化试剂盒(中山金桥,SPN-9001);GFAG抗体(CST,80788);Iba-1抗体(Wako,019-19741)。凝胶成像系统(JS-380A,上海培清科技有限公司);荧光显微镜(BX63,OLYMPUS)。
1.2 实验分组
按照随机数字法对大鼠进行编号(1-36),将大鼠分为对照组、TBI 3 d组、TBI 3 d+冬凌草甲素(Ori)组,每组12只。对照组仅接受麻醉,TBI 3 d+Ori组在造模后立刻腹腔注射冬凌草甲素(1 mg/100 g)[5],每12 h后再次给药,连续3 d。TBI 3 d组在造模后注射DMSO。
1.3 Feeney法制作TBI模型
采用Feeney法自由落体颅脑损伤装置制作大鼠TBI模型[6]:大鼠麻醉后固定于脑立体定向仪上。切开皮肤,前囟后1.5 mm、右旁开2.5 mm钻孔,开一直径5 mm骨窗,显露硬脑膜,撞击头移至硬脑膜上方,20 g打击锤于15 cm处沿导管坠落,打击后骨蜡封闭骨窗,对照组仅去骨瓣。
1.4 HE染色观察大鼠皮层损伤
各组大鼠于预定时间点灌注生理盐水及40 g/L多聚甲醛后取脑,标本置于多聚甲醛溶液中继续固定48 h。常规石蜡包埋,每个蜡块连续切片厚4 μm,切片脱蜡、梯度乙醇水化,经苏木精液及伊红液染色,常规脱水、透明、封固。图像采集与分析系统上采集、分析图片,观察大鼠受损皮层。
1.5 TUNEL检测大鼠皮层神经细胞凋亡
大鼠灌注取脑、固定、切片、脱蜡、水化如前,按照TUNEL凋亡试剂盒提供的步骤染色,DAPI染核。每张切片随机选取6个高倍视野(×400),计算TUNEL阳性细胞数。
1.6 免疫组化检测胶质细胞标志物的变化
大鼠灌注取脑、固定、切片、脱蜡、水化如前,高压修复切片抗原,封闭后分别加GFAG(1 ∶200)、Iba-1(1 ∶400)一抗,生物素化二抗孵育后,辣根酶标记链霉卵白素孵育,DAB显色、苏木素复染。每张切片随机选取6个视野(×200),Image-Pro Plus 6.0对切片进行半定量分析。
1.7 Western blot检测NF-κB及MAPK通路的变化
取损伤灶周围皮层,分别提取细胞核蛋白和细胞质蛋白。蛋白经电泳、转膜、封闭后,将细胞核蛋白加入NF-κB p65(1 ∶1 000)一抗4 ℃孵育过夜(Lamin B 1 ∶1 000为内参),将细胞质蛋白加入p38 MAPK(1 ∶1 000)及Phospho-p38 MAPK(1 ∶1 000)一抗4 ℃孵育过夜(β-actin(1 ∶1 000)为内参),二抗孵育,显影后用凝胶成像系统拍照,Image J软件作定量分析。
1.8 ELISA检测炎性因子水平的变化
取损伤灶周围皮层,ELISA检测脑组织匀浆中TNF-α、IL-1β、IL-6因子含量变化,具体操作步骤依照试剂盒列出的步骤进行。
1.9 统计学分析
应用SPSS 16.0进行数据分析,所有实验数据均以均数±标准差表示,在满足正态性和方差齐性的条件下,多组间比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 冬凌草甲素减轻脑损伤并抑制胶质反应
对照组大鼠脑皮层细胞结构完整,细胞核清晰、染色均匀。TBI 3 d组大鼠脑皮层神经细胞有变性坏死,部分胞核可见核体皱缩。与TBI 3 d组相比,TBI 3 d+Ori组神经元坏死变性、核体皱缩的数量减少(见图1)。
与对照组相比,TBI 3 d组GFAP、Iba-1的表达均明显升高;与TBI 3 d组相比,TBI 3 d+Ori组的皮层内GFAP、Iba-1的表达减少,差异有统计学意义(见图1)。
2.2 冬凌草甲素抑制大鼠TBI后皮层细胞凋亡
与对照组相比,TBI 3 d组凋亡细胞增加;与TBI 3 d组相比,TBI 3 d+Ori组的凋亡细胞减少,差异有统计学意义(见图2)。

TUNEL(绿色)与DAPI(蓝色)同时阳性的细胞为凋亡细胞
2.3 冬凌草甲素抑制促炎因子TNF-α、IL-6及IL-1β的释放
与对照组相比,TBI 3 d组皮层TNF-α、IL-6及IL-1β的水平升高(P均<0.05);与TBI 3 d组相比,TBI 3 d+Ori组TNF-α、IL-6及IL-1β的水平降低,差异均有统计学意义(P<0.05,见图3)。

与对照组相比,*P<0.05;与TBI 3 d组相比,#P<0.05
2.4 冬凌草甲素对NF-κB及MAPK信号通路的调控
与对照组相比,TBI 3 d组NF-κB的表达及p38 MAPK的磷酸化水平均升高(均P<0.05),与TBI 3 d组相比,TBI 3 d+Ori组NF-κB的表达及p38 MAPK的磷酸化水平下降,差异有统计学意义(均P<0.05,见图4)。
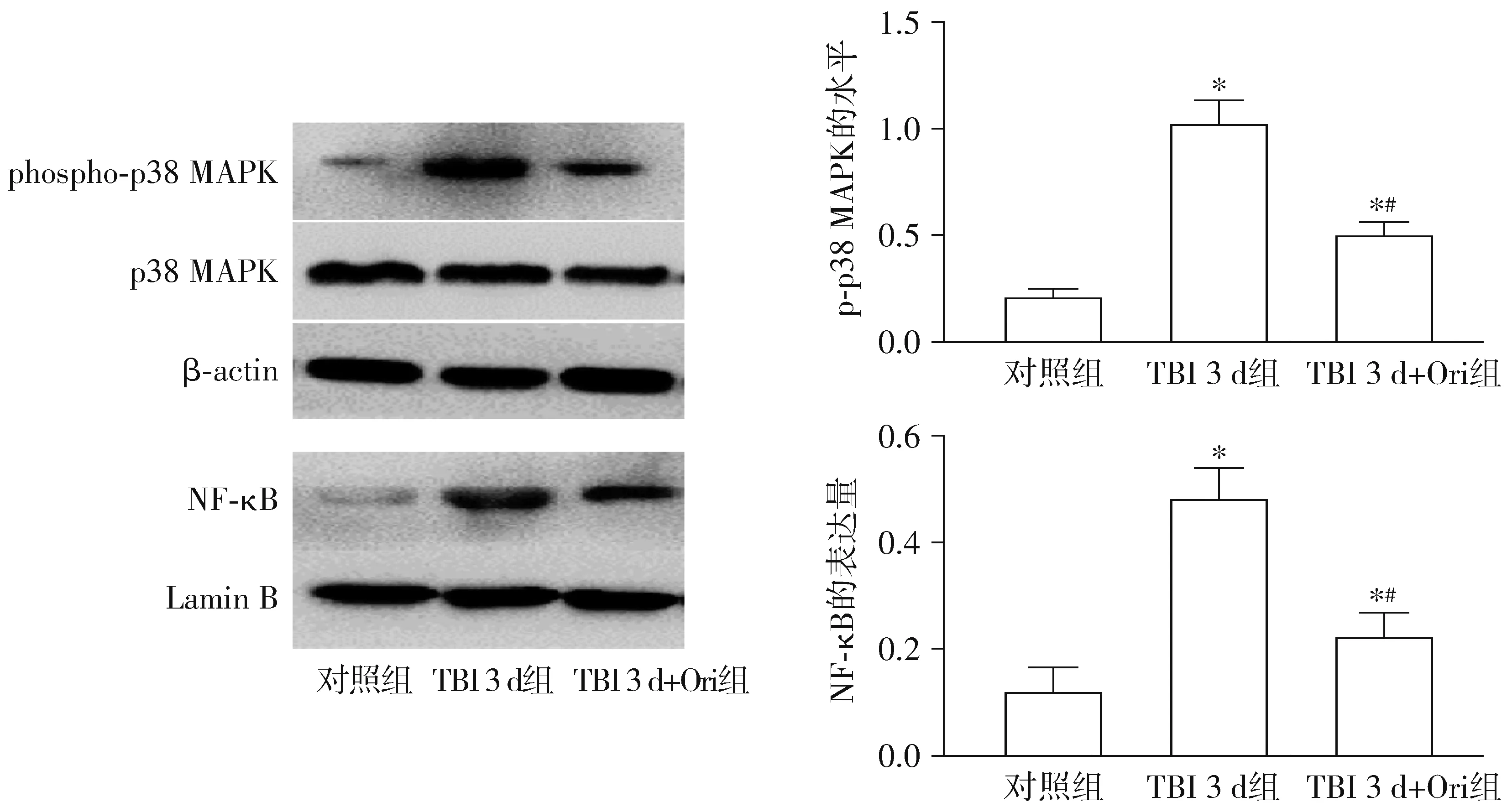
与对照组相比,*P<0.05;与TBI 3 d组相比,#P<0.05
3 讨论
本研究中HE染色发现,对照组脑皮层无明显病理改变,而TBI 3 d组脑皮层有明显的脑组织缺损,且损伤区域组织结构紊乱稀疏,染色浅淡,可见红细胞弥散分布,损伤灶周围神经细胞肿胀、排列紊乱,故本研究采用的TBI模型可有效地模拟临床脑挫裂伤。
冬凌草甲素具有抗肿瘤、降压、抗菌消炎、抗氧化、抗炎等多种作用。冬凌草甲素可抑制肾组织内CD68阳性炎性细胞的浸润,降低炎性因子的水平;减轻内毒素诱导的子宫内膜炎,降低过氧化物酶的活性[7,8]。冬凌草甲素还能通过抑制T细胞的活性,减轻实验性结肠炎的症状,并通过降低炎性因子水平治疗急性肺损伤[9-11]。在脑内,冬凌草甲素可以明显减少阿尔茨海默小鼠脑内Aβ的沉积,减少小胶质细胞的激活[12,13]。本研究发现TBI后连续3 d给予冬凌草甲素,可以减轻脑外伤后皮层神经细胞的损伤,并抑制小胶质细胞及星型胶质细胞的活化。TBI后由于病损的持续存在,胶质细胞均可能持续激活,释放炎性细胞因子,引起脑组织炎症反应和氧化应激反应,直接或间接诱发神经元死亡[14]。因此,本研究中,冬凌草甲素可能通过抑制胶质细胞反应降低炎性因子水平减轻TBI后的脑损伤。
TNF-α、IL-1β、IL-6是重要的促炎因子,可通过结合受体调节细胞凋亡;多种信号传导通路参与TNF-α、IL-1β、IL-6等炎性因子的释放,主要包括转录因子NF-κB和MAPK蛋白激酶的活化[15]。本研究发现TBI连续3 d给予冬凌草甲素,受损皮层周围组织细胞核内NF-κB的表达量减少,细胞质内MAPK的磷酸化水平降低。NF-κB可被外界的刺激激活,从细胞质转至细胞核,在核内与启动子区的相应因子相结合,调节广泛的基因表达谱[16,17]。异常的NF-κB活性可引起一系列炎症因子的表达,包括TNF-α、IL-6等。p38MAPK可磷酸化ATF2N端活化区域的苏氨酸,导致其转录活性升高,调节多种炎性因子的基因表达[18,19]。因此,冬凌草甲素抑制TNF-α、IL-1β、IL-6的产生可能与其抑制NF-κB活性和抑制MAPK磷酸化水平的能力有关。既往研究也发现冬凌草甲素能通过抑制NF-κB活性及MAPK的磷酸化降低炎性因子水平,进而缓解内毒素导致的急性肺损伤,并抑制血管内皮细胞的炎性反应[20,21]。除了作用于NF-κB和MAPK途径,冬凌草甲素还可以调控多种信号通路,具有治疗多种疾病的潜力,例如冬凌草甲素可通过激活PPAR-γ途径抑制IL-1β导致的骨关节病,也可抑制内毒素导致的牙龈成纤维细胞炎症,并通过TGF-β途径抑制肺纤维化[22-25]。
综上,冬凌草甲素可通过抑制TNF-α、IL-1β、IL-6的产生及其相关的NF-κB和MAPK信号通路,对TBI后的病理改变及细胞凋亡有保护作用。
