美藤果壳多酚物质的提纯及其抗氧化性
2021-03-15林锦铭蔡尤林李俊健钟淳菲杜冰黎攀
林锦铭,蔡尤林,李俊健,钟淳菲,杜冰,2*,黎攀,2*
(1.华南农业大学食品学院,广东广州510642;2.云南省杜冰专家工作站,云南普洱665008)
美藤果(Plukenetia volubilis Linneo)又称为印加果、南美油藤、印奇果、星油藤等,为大戟科藤本植物、多年生油料作物。美藤果原产于南美洲秘鲁亚马逊河流域雨林,2006 年,由中国科学院西双版纳热带植物园从秘鲁引种成功。2011 年7 月,由普洱联众生物资源开发有限公司申请,中国科学院昆明植物研究所标本馆组织专家鉴定,确认将其正式定名为“美藤果”[1]。2013年1 月4 日,卫生部2013 年第1 号公告批准美藤果油作为新资源食品[2],开启了开发美藤果新一轮热潮。美藤果种子富含油脂(35%~60%)和蛋白质(27%)及带有热不稳定苦味成分[3],其中不饱和脂肪酸含量达92%以上,对人体具有良好营养作用,具有预防心血管疾病、保养肌肤等作用[4]。
目前,国内外对美藤果油的研究较多[5-6],而美藤果壳作为美藤果提炼油后的废弃物,对其利用却少有报道。美藤果壳中多酚含量丰富,是良好的多酚来源,而植物多酚在食品、医药中应用广泛[7]。在食品中,植物多酚可作为一种天然的抗氧化添加剂,相对于人工合成的抗氧化添加剂更安全[8]。近代医学研究显示,氧化损伤是导致许多慢性病,如心血管病、癌症和衰老性疾病的重要原因,如何阻止氧化损伤、清除体内自由基是医学上预防和治疗这些慢性病的突破口,而多酚的抗氧化功能可以对这些慢性病起到预防作用[9-14]。本文开展了美藤果壳多酚的提取纯化工艺条件研究,并与商品化的抗氧化添加剂丁基羟基甲苯(butylated hydroxytoluene,BHT)、特丁基对苯二酚(tert-butylhydroquinone,TBHQ)、维生素C 的体外抗氧化性进行对比,确定美藤果壳多酚的主要成分,为美藤果壳多酚的深入开发及其作为抗氧化剂在食品加工业、临床医药中的应用提供一些科学数据支持,美藤果壳综合开发利用具有较好的发展前景。
1 材料与方法
1.1 试剂与仪器
美藤果壳:普洱联众生物资源开发有限公司;1,1-二苯基-2-三硝基苯肼(2,2-Diphenyl-1-picrylhydrazyl,DPPH)、三羟甲基氨基甲烷[tris(hydroxymethyl)aminomethane,Tris]:美国Sigma 公司;无水乙醇、碳酸钠、没食子酸标准品、福林酚试剂、2,6-二叔丁基对甲酚(BHT)、叔丁基对苯二酚(TBHQ)、维生素C、双氧水、三氯化铁等(均为分析纯):天津市大茂化学试剂厂。
HH-6 数显恒温水浴锅:常州奥华仪器有限公司;80 目国家标准检验筛:浙江上虞市道墟五四仪器纱筛厂;PL203 电子精密天平:梅特勒-托利多仪器(上海)有限公司;SHZ-III 型循环水真空泵:上海亚荣生化仪器厂;UV-5100 紫外分光光度计:上海元析仪器有限公司;LC1260 反相高效液色谱仪:Agilent 公司。
1.2 方法
1.2.1 原料的预处理
将美藤果壳用多功能粉碎机粉碎处理,过80 目筛得美藤果壳干粉,按GB 5009.3—2016《食品安全国家标准食品中水分的测定》,测得其含水量为2.95%。剩余粉末装入密封袋中并置于-18 ℃冰箱保存备用。
1.2.2 乙醇回流法提取美藤果壳多酚
准确称取1.000 g 美藤果壳干粉,按适当的料液比、合适比例的乙醇溶液为提取剂,于普通加热回流装置,80 ℃回流提取1 h,然后用布氏漏斗抽滤,上清液减压浓缩过滤后,用蒸馏水定容至250 mL。其中美藤果壳多酚得率计算公式如下:
多酚得率/%=(提取液浓度×体积)/样品质量×100
1.2.3 美藤果壳总多酚含量的测定
采用福林酚法[15-16]测定美藤果壳总多酚含量,以没食子酸标准溶液浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
1.2.4 最佳提取工艺条件优化
以美藤果壳多酚得率作为考察指标,分别固定A乙醇浓度、B 料液比、C 提取温度和D 提取时间进行单因素试验。试验重复3 次,试验结果取平均值。然后根据单因素试验结果各取3 个水平。按L9(34)正交设计表进行正交试验,因素水平见表1。
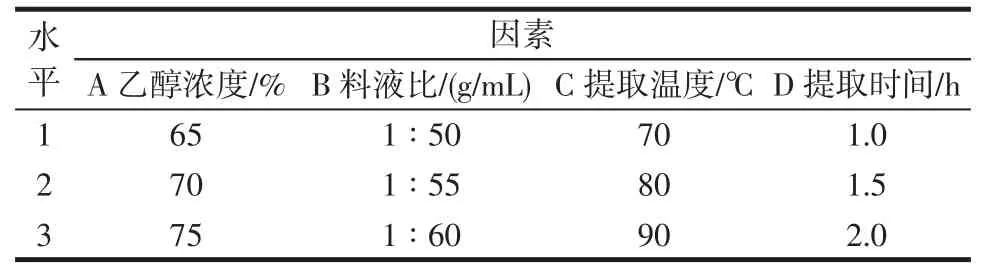
表1 正交试验因素水平Table 1 Factors and levels of orthogonal experiment
1.2.5 大孔吸附树脂法纯化美藤果壳多酚
1.2.5.1 样品浓度影响
称取20.0 g AB-8 树脂,分别加入浓度0.5 mg/mL~3.0 mg/mL 样品液。25 ℃条件下振荡吸附一定时间,取样品液测多酚含量。
1.2.5.2 洗脱剂浓度对解吸的影响
吸附后分别加入10%、30%、50%、70%、90%乙醇50 mL,置于恒温恒速振荡器中,在25 ℃条件下振荡解吸一定时间,取等量解吸液测定多酚含量。
1.2.5.3 上样液流速的选择
大孔树脂湿法装柱,分别以1.0、1.5、2.0、2.5、3.0 BV/h 的流速进行样品上柱,测定漏出液中多酚含量,研究上样液流速对动态吸附的影响。
1.2.5.4 洗脱流速对洗脱的影响
吸附后用3 倍柱体积蒸馏水冲洗树脂柱。相同体积洗脱液分别按照1.0、1.5、2.0、2.5、3.0 BV/h 的流速进行洗脱,测定其中多酚的含量,计算解吸率。
1.2.5.5 洗脱体积的影响
洗脱树脂上吸附的美藤果壳多酚,分部收集洗脱液并测定各管洗脱液中的美藤果壳多酚含量,以洗脱液体积为横坐标,洗脱液中多酚浓度为纵坐标,绘制洗脱曲线。
1.2.6 美藤果壳提取物成分分析
采用安捷伦1260 型高效液相色谱(high-performance liquid chromatography -diode array detection,HPLC-DAD)测定多酚成分。仪器条件为Zorbox SBC18 色谱柱;柱温:30 ℃;流速:1.0 mL/min;进样量:20 μL;检测器:二极管阵列检测器(diode array detection,DAD),280 nm 处进行检测。流动相组成:0.4%冰乙酸超纯水(A)和乙腈(B);以标准品在色谱柱上的保留时间为对照,判断各多酚成分。
1.2.7 美藤果壳提取物抗氧化特性
将提取液真空冷冻干燥后,制得美藤果壳提取物粉末,通过福林酚法测定提取物粉末中总多酚含量为26%。以该美藤果壳提取物粉末作为受试物并配制成一系列浓度,通过其对羟自由基、DPPH 自由基的清除作用研究美藤果壳提取物的抗氧化性。
1.2.7.1 清除羟自由基作用
通过Fenton 体系(甲基紫—Fe2+—H2O2)产生羟自由基,采用分光光度法测定上述提取物对羟自由基的清除作用[17]。在10 mL 具塞比色皿中依次加入1.0 mL(2.0×10-4mol/L)甲基紫溶液、1.0 mL(1.0×10-3mol/L)Fe2+溶液、1.0 mL(0.12%)H2O2溶液,并用Tris-HCl 缓冲液(pH 8.25)调节pH 4.5 后用水稀释到10 mL,摇匀放置30 min 后以水为空白参比在578 nm 处测定吸光值A0;测定样品时在上述体系中预加入1.0 mL 样品溶液,同上测定吸光值AS,同体积样品溶液、Tris-HCl 及水溶液作空白参比;甲基紫及Tris-HCl 缓冲液测定吸光值A,以水为空白参比。则清除率为:S/%=[(AS-A0)/(A-A0)]×100。
回归拟合样品浓度与清除率的量效关系曲线,算出提取物的的半数抑制浓度(IC50)值并与其他抗氧化剂进行对比。
1.2.7.2 DPPH 自由基清除作用
在3.0 mL 6 μmol/L DPPH-无水乙醇溶液中加入500 μL 样品溶液,摇匀放置30 min,测定其在517 nm下的吸光值(AS);以500 μL 无水乙醇代替样品为空白对照(A0);以500 μL 样品与3.0 mL 无水乙醇混合液为样品对照(AX)以消除样品本身颜色的影响,测定DPPH 自由基清除率[18]。清除率计算公式:S/%=(A0-A)/A0×100。
回归拟合样品浓度与清除率的量效关系曲线,计算出提取物的半数抑制浓度(IC50)数值并与其他抗氧化剂进行对比。
1.3 数据处理
试验数据采用Microsoft Excel 2016 进行处理,采用SPSS 19.0 进行统计学分析。
2 结果与分析
2.1 没食子酸标准曲线
试验得没食子酸标准曲线如图1 所示,回归方程为Y=100.4X+0.020 8,R2=0.997 2,线性较好。其中Y 为吸光值,X 为没食子酸浓度,mg/mL。

图1 没食子酸标准曲线Fig.1 Gallic acid standard curve
2.2 单因素试验
2.2.1 乙醇浓度对美藤果壳多酚得率的影响
乙醇浓度对多酚得率的影响见图2。

图2 乙醇浓度对多酚得率的影响Fig.2 Effect of ethanol concentration on polyphenol yield
由图2 可知,美藤果壳多酚得率随乙醇浓度提高而提高。乙醇浓度小于70%时,随乙醇浓度提高,多酚得率的提高速度较快,乙醇浓度大于70%后,多酚得率提高速度较缓慢。可能是因为随着乙醇浓度的增大,其他脂溶性物质和多酚竞争溶解致使多酚得率上升缓慢[19]。综合考虑选择70%乙醇提取多酚为宜。
2.2.2 料液比对美藤果壳多酚得率的影响
料液比对多酚得率的影响见图3。
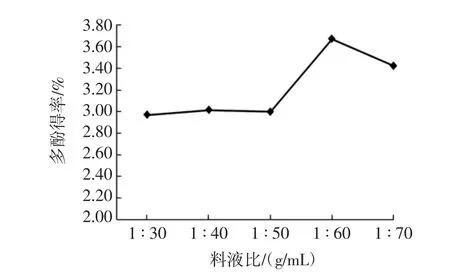
图3 料液比对多酚得率的影响Fig.3 Effect of material liquid ratio on polyphenol yield
由图3 可知,料液比为1 ∶30、1 ∶40、1 ∶50(g/mL)时,多酚得率相对较低,料液比为1 ∶60(g/mL)时,多酚得率有明显上升,料液比达1 ∶70(g/mL)时,多酚得率又随之下降。当溶剂比例较低时,溶剂不能将多酚完全提取,增加溶剂用量,未溶解的多酚向提取剂中转移,溶剂与原料的比值越大,浓度梯度越大,有效成分的扩散速率也越大[20]。当料液比1 ∶60(g/mL)时,多酚得率最高,再继续增大溶剂比例不利于多酚提取,所以应选择料液比为1 ∶60(g/mL)。
2.2.3 提取温度对美藤果壳多酚得率的影响
提取温度对多酚得率的影响见图4。
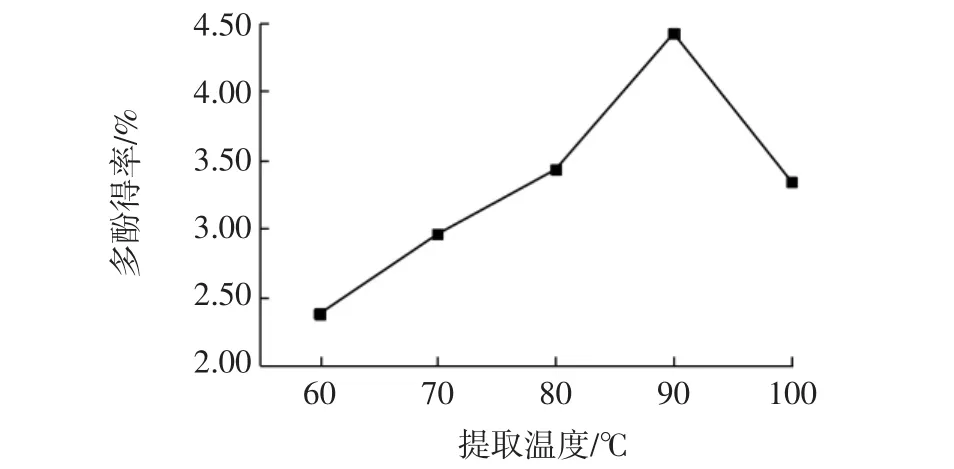
图4 提取温度对多酚得率的影响Fig.4 Effect of extraction temperature on polyphenol yield
由图4 看出,温度对美藤果壳多酚得率的影响比较明显。温度较低时,美藤果壳多酚得率较低,在一定范围内,随着温度的升高,多酚得率也随之升高。一方面可能是由于多酚在热水中的溶解度较大;另一方面可能温度的升高加速了分子的运动,氢键更容易断裂,多酚的渗透、溶解、扩散速度也加快,因而酚类物质更易于从原料中溶出,提高乙醇提取多酚的速度。但温度过高时一些热敏性多酚成分会发生氧化分解,故提取温度定在90 ℃为宜。
2.2.4 提取时间对美藤果壳多酚得率的影响
提取时间对多酚得率的影响见图5。

图5 提取时间对多酚得率的影响Fig.5 Effect of extraction time on polyphenol yield
由图5 看出,在一定范围内,随着提取时间的增加,美藤果壳多酚得率也随之增大,当提取时间大于2.0 h 后,多酚得率的增大趋于平缓。可见提取时间越长,美藤果壳多酚的提取量越高,这是因为随着回流时间的加长可以使得多酚更加充分地溶解于溶剂中[21]。当提取时间≥2.0 h,多酚得率增加趋势趋于平缓,提取时间的进一步延长对多酚得率没有显著影响,考虑到实际生产的提取效率,故提取时间定为2.0 h 为宜。
2.3 正交试验结果
根据单因素试验结果,按正交设计表L9(34)安排试验,用福林酚法测定多酚得率,结果如表2。
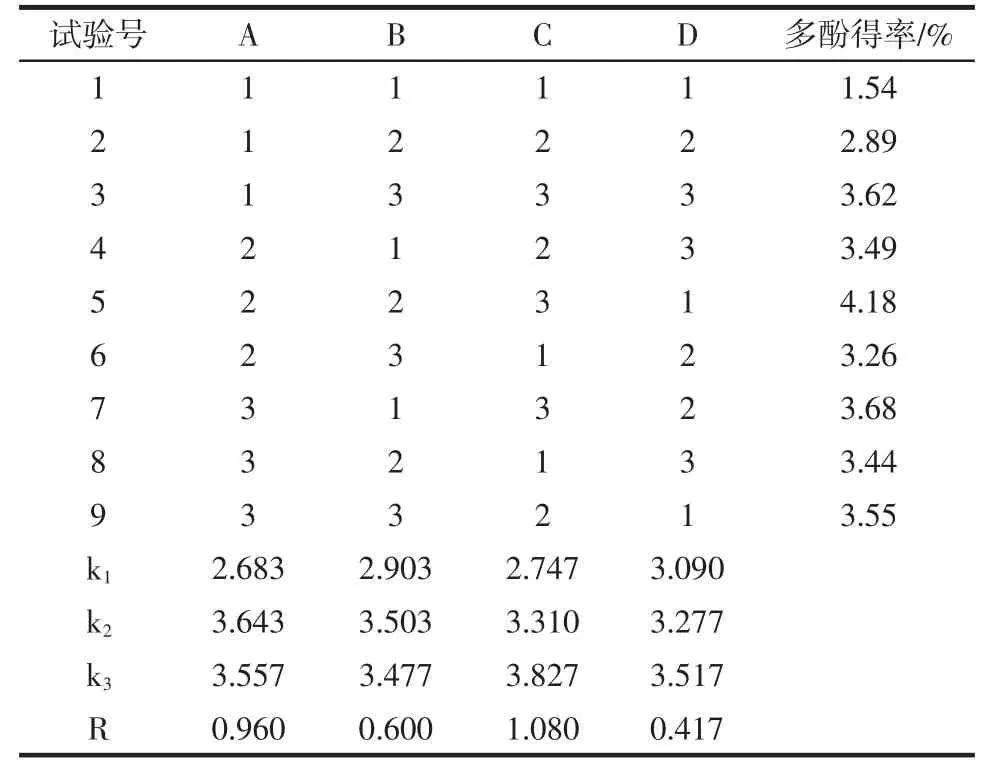
表2 正交试验结果及极差分析Table 2 Orthogonal experiment results and range analysis
表2 极差分析结果表明,各因素对多酚得率影响大小次序为C>A>B>D,即提取温度>乙醇浓度>料液比>提取时间,最优条件组合为C3A2B2D3,即提取温度90 ℃,乙醇浓度70%,料液比为1 ∶55(g/mL),提取时间2.0 h 为最优方案。对方案进行验证试验。准确称1.000 g 美藤果壳粉,按最佳工艺条件C3A2B2D3,进行3次平行试验,分别测定多酚得率,计算得多酚的平均得率为4.79%,高于正交试验中各试验的得率,说明最佳工艺合理。
2.4 大孔吸附树脂法纯化美藤果壳多酚试验结果
样品浓度对大孔树脂吸附效果的影响见图6,解吸剂浓度对美藤果壳多酚解吸的影响见图7,上柱液流速对大孔树脂吸附的影响见图8,洗脱流速对洗脱效果的影响见图9,AB-8 大孔树脂洗脱曲线见图10。

图6 样品浓度对大孔树脂吸附效果的影响Fig.6 Effect of sample concentration on adsorption of macroporous resin

图7 解吸剂浓度对美藤果壳多酚解吸的影响Fig.7 Effect of concentration of desorption agent on the desorption of polyphenols from sacha inchi shell
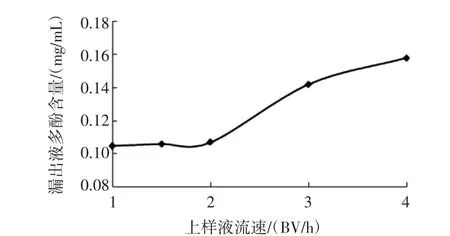
图8 上柱液流速对大孔树脂吸附的影响Fig.8 Effect of flow rate on adsorption of macroporous resin

图9 洗脱流速对洗脱效果的影响Fig.9 Effect of elution velocity on elution efficiency

图10 AB-8 大孔树脂洗脱曲线Fig.10 AB-8 macroporous resin
图6 表明,吸附率随样品浓度增加呈先升高后降低趋势,当样品浓度在1.5 mg/mL 时吸附率最大;图7表明,随着乙醇浓度的升高解吸率逐渐增加,乙醇浓度超过30%时,继续增加乙醇浓度,对洗脱效果的提升作用不大;图8 显示过高的上样流速不利于多酚的吸附,上柱流速为2.0 BV/h 左右多酚吸附率最高,因此选择上柱流速为2.0 BV/h;图9 显示洗脱流速1.5 BV/h左右洗脱效果较好,因此洗脱流速定为1.5 BV/h;图10显示当洗脱体积达到1.6 BV 左右时,洗脱液中的多酚含量达到最大值,洗脱效果最好,因此洗脱液体积为1.6 BV 比较适宜。
综上所述,AB-8 大孔树脂对美藤果壳多酚分离纯化的最佳工艺:以乙醇粗提物为原料,乙醇作为洗脱剂,上样速度为2.0 BV/h,采用30%乙醇溶液以1.5 BV/h 的洗脱速度洗脱4.0 BV,最终纯化液多酚纯度可达到68.3%
2.5 美藤果壳多酚纯化前后成分分析
大孔树脂AB-8 纯化前美藤果壳多酚提取物高效液相色谱(highperformanceliquidchromatography,HPLC)见图11,大孔树脂AB-8 纯化后美藤果壳多酚提取物HPLC 见图12。
如图11、图12 所示,对比发现美藤果壳多酚提取物经过大孔树脂AB-8 纯化后不会造成峰的丢失,即单体酚组成未减少,并且峰面积的下降程度较低,即单体酚经纯化后损失量较少(约5%左右)。美藤果壳多酚提取物纯化前保留时间3 min~4 min 之间有许多杂峰,可见这类杂质水溶性较好,可能是粗提后通过旋转蒸发无法除去的残留乙醇;而经大孔树脂AB-8 纯化后杂峰去除效果较好,且纯化前保留时间大于4 min的峰均被很好地保留,由此可见利用大孔树脂AB-8纯化美藤果壳多酚提取物是可行的。
结合标准品的HPLC 分析图谱及混合标准品的HPLC 分析图谱对纯化后多酚提取物HPLC 谱分析结果见表3。

图11 大孔树脂AB-8 纯化前美藤果壳多酚提取物HPLCFig.11 HPLC of polyphenol extract from the shell of sacha inchi before purification with macroporous resin AB-8

图12 大孔树脂AB-8 纯化后美藤果壳多酚提取物HPLCFig.12 HPLC of polyphenol extract from the shell of sacha inchi after purification with macroporous resin AB-8

表3 纯化后美藤果壳多酚提取物HPLC 分析结果Table 3 HPLC analysis results of polyphenol extract from the shell of sacha inchi after purification
由表3 可知,美藤果壳多酚经纯化主要成分为没食子酸、芦丁、儿茶素、单宁和异槲皮苷,含量分别为9.28、7.29、5.54、4.31、2.93 μg/mL。
2.6 抗氧化性测定结果
2.6.1 美藤果壳多酚对羟自由基的清除作用
BHT、TBHQ、维生素C、美藤果壳多酚等物质的浓度与羟自由基清除率的量效关系曲线如图13 所示。

图13 各样品质量浓度与羟自由基清除率量效关系Fig.13 Relationship between the mass concentration of each sample and the scavenging rate of hydroxyl radical
利用拟合曲线计算出美藤果壳多酚的IC50值,即清除率为50%时样品的浓度为IC50=0.586 mg/mL。
羟自由基是活性氧的一种,在体内的形成主要是由过氧化物负离子和过氧化氢反应生成,羟自由基能杀死红细胞,降解DNA、细胞膜和多糖化合物,对人体的健康产生巨大的危害[22-24]。研究美藤果壳多酚对羟自由基的清除效果既能评定其抗氧化能力,还能够评定其对人体健康的保护作用。
由图13 可知羟自由基的清除率随样品的质量浓度的升高而升高,并且在同等浓度下美藤果壳多酚的羟自由基清除率>TBHQ 的羟自由基清除率>VC的羟自由基清除率>BHT 的羟自由基清除率。在较低浓度下,美藤果壳多酚相对于TBHQ、VC、BHT,其对羟自由基清除效果的优势就比较明显,随着浓度的升高,清除率也不断升高。当质量浓度均为700 mg/L 时,其清除羟自由基的作用分别是TBHQ、VC、BHT 的3.19 倍、6.61 倍和41.30 倍,可见美藤果壳多酚对羟自由基的清除作用均要优于TBHQ、VC、BHT。
2.6.2 美藤果多酚对DPPH 自由基的清除作用
BHT、TBHQ、维生素C、美藤果壳多酚提取物的浓度与DPPH 自由基清除率的量效关系曲线如图14所示。
利用拟合曲线计算出提取物的IC50值,即清除率为50%时样品的浓度为IC50=7.51×10-3mg/mL。

图14 各样品质量浓度与DPPH 清除率量效关系Fig.14 relationship between mass concentration of each sample and DPPH clearance
由图14 可知,美藤果壳多酚的DPPH 自由基清除率>TBHQ 的DPPH 自由基清除率>VC的DPPH 自由基清除率>BHT 的DPPH 自由基清除率,美藤果壳多酚在较低浓度下就显示出其对DPPH 自由基良好的清除率,且清除效率随着质量浓度的升高而提升。当质量浓度均为20 mg/L 时,其清除DPPH 自由基的作用分别是TBHQ、VC、BHT 的1.24 倍、1.76 倍和7.02 倍,可见美藤果壳多酚对DPPH 自由基的清除作用均要优于TBHQ、VC、BHT。
3 结论
影响美藤果壳多酚得率的4 个因素中,影响程度为:提取温度>乙醇浓度>料液比>提取时间。最佳工艺为提取温度90 ℃,乙醇浓度为70%,料液比为1∶55(g/mL),反应时间为2.0 h 的条件下提取美藤果壳多酚。经验证试验多酚得率为4.79%。AB-8 大孔树脂对美藤果壳多酚分离纯化的最佳工艺为以乙醇为洗脱剂,上样速度为2.0 BV/h,采用30%乙醇溶液以1.5 BV/h 的洗脱速度洗脱4.0 BV。
美藤果壳多酚主要为:没食子酸、芦丁、儿茶素、单宁和异槲皮苷,浓度分别为9.28、7.29、5.54、4.31、2.93 μg/mL。美藤果壳多酚对羟自由基、DPPH 自由基的半数清除浓度IC50分别0.586、7.51×10-3mg/mL,且清除效果均显著优于TBHQ、VC、BHT。因此美藤果壳多酚是一种优质有效的抗氧化剂。
