熟地黄粗提物对光损伤小鼠视网膜的保护作用
2021-03-15刘莹刘垚杰李丽维周王谊徐阎王玥徐咏全王浩
刘莹,刘垚杰,李丽维,周王谊,徐阎,王玥,徐咏全,王浩*
(1.天津科技大学食品科学与工程学院,天津300457;2.天士力研究院,天津300410)
长时间暴露在强光下会加速视网膜氧化应激,导致视网膜损伤[1]。视网膜内过量自由基的产生,是诱导氧化应激发生的重要因素[2]。王晓英等研究发现,强光会导致视网膜组织中产生过量的活性氧自由基(reactive oxygen species,ROS)[3],导致体内氧化平衡体系失衡,从而导致视疲劳、白内障和年龄相关性黄斑变性等眼部疾病的发生[4-5]。此外,WANG 等研究发现,视网膜氧化受损会导致促炎细胞因子的过度表达,这也是导致视网膜损伤的重要因素[5]。
熟地黄,属玄参科,是加工炮制而成的一种中药材[6-7]。目前,已从熟地黄中分离出约70 种单体化合物,主要包括多糖、单糖、梓醇、水苏糖和5-羟甲基糠醛等活性成分[6,8]。研究表明,水溶性多糖为熟地黄的主要活性成分,具有提高机体抗氧化力[9]、增强免疫力[10]、降血糖[11]、抗突变[12]和促进内皮细胞增殖[13]等作用;熟地黄中水苏糖含量约为30%,具有较强的抗氧化能力[14]。梓醇是熟地黄中的一种功能活性成分,属于环烯醚萜单糖苷类,并且具有缓解糖尿病视网膜病变的作用[15]。除此以外,熟地黄中还包括甘露醇、维生素A 等其它抗氧化活性成分[16]。本研究以光损伤小鼠为模型,通过视网膜电图(electroretinogram,ERG)和光学相干断层成像(optical coherence tomography,OCT)以及抗氧化和炎症相关视网膜生理指标的检测,探究熟地黄对视网膜损伤的保护作用,以期为熟地黄开发缓解视疲劳保健产品提供理论依据。
1 材料和方法
1.1 材料及试剂
实验小鼠、基础饲料:斯贝福(北京)生物技术有限公司;超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒、过氧化氢酶(catalase,CAT)测定试剂盒、丙二醛(malondialdehyde,MDA)含量测定试剂盒、BCA 蛋白浓度测定试剂盒:南京建成生物工程研究所;复方托吡卡胺滴眼液:参天制药(中国)有限公司;氧氟沙星眼膏:沈阳兴齐眼药股份有限公司;SYBRGreen 试剂盒:宝生物工程(大连)有限公司;Trizol:天津市大茂化学试剂厂。
JS703C 分析天平:瑞士METTLER TOLEDO 公司;RETI-Port/Scan 21 型ERG 仪器:德国罗兰公司;micronIV 型OCT 仪器:美国phoenix 公司;LSI20d-Ⅱ型LED 灯:深圳市爱图仕影像器材有限公司;TES1330A数字照度计:台湾泰仕电子工业公司;MyCycler 聚合酶链式反应(polymerase chain reaction,PCR)仪、MyiQ2实时荧光定量PCR 仪:美国Bio-Rad 公司;U-3900Hitachi 紫外分光光度计:日立科学仪器有限公司。
1.2 熟地黄粗提物
称取熟地黄(符合2015 版《中华人民共和国药典》标准),加入6 倍体积的蒸馏水提取,提取3 次,合并提取液,提取液经浓缩得到水提物浸膏,再加入95%乙醇进行醇沉,收集沉淀物并进行干燥,制得熟地黄提取物棕色粉末(每克熟地黄提取物含熟地黄3.14 g)。
1.3 实验动物及分组
健康雄性C57BL/6J 小鼠,6 周龄,体重(18±1)g,许可证号为SCXK(京)2016-0002,饲养于天津科技大学实验动物中心[(23±2)℃,相对湿度55%,明暗循环为12 h/12 h]。实验期间小鼠摄食和饮水自由。本研究的所有实验程序均按照天津科技大学动物实验伦理委员会批准的方案进行。
实验前对小鼠眼球进行检查,排除眼部疾病。经过一周的适应期后,小鼠被随机分成4 组:正常(CON)组、模型(MOD)组、熟地黄低剂量(SDL)组、熟地黄高剂量(SDH)组,每组各12 只。其中,正常组和模型组给予0.2 mL 无菌生理盐水灌胃,根据前期预实验结果,熟地黄低、高剂量组分别给予360、450 mg/kg bw 的剂量灌胃,每日一次,连续8 周。除正常对照组外,各组小鼠均在第9 周放入光照箱中进行光照造模。
1.4 光损伤模型制备
采用自制光照箱造模,每只小鼠被单独放置在由亚克力透明板制成的10 cm×10 cm×8 cm 小方格中,将光照器悬挂于小鼠顶部50 cm 处,垂直照射,并在与小鼠同一高度处悬挂一温度计,实时监测温度,确保温度维持在(23±2)℃范围内,排除温度升高引起小鼠眼球光热损伤的可能。为避免长时间光照而引起眼球表面脱水,光照前30 min 对小鼠眼球进行涂抹眼药处理。根据前期预实验结果,利用照度计将光照强度调整为(9 000±500)Lux,持续照射4 h,连续照射7 d,光照期间正常进食与饮水。光照造模结束后,进行视网膜电图和光学相干断层成像等视网膜生理指标检测。
1.5 视网膜电图检测
小鼠暗适应12 h 后,用5%的水合氯醛溶液进行腹腔注射麻醉,注射剂量为0.01 mL/g bw,待小鼠四肢无反应并脊背无弓起现象后用0.1 mg/mL 硫酸阿托品滴眼液扩张瞳孔。小鼠固定在平台上,以与角膜表面接触的镀金丝环电极为活性电极,将电极插入眼睛附近的皮肤和尾部作为参考和接地导线,记录3.0 b 波振幅。整个实验过程在红光下进行。实验结束后,立即对小鼠眼球表面涂抹氧氟沙星眼膏,防止眼球长时间干燥而引起小鼠眼球脱水。
1.6 光学相干断层成像
小鼠腹腔注射5%水合氯醛溶液麻醉。待小鼠四肢无反应且脊背无弓形后,将其放置在固定架上并滴加散瞳药,然后将小鼠右眼球与镜面紧贴,正确定位眼球位置后进行观察,获得OCT 伪彩图。比较各实验组小鼠右眼相应的视网膜外核层(outer nuclear layer,ONL)厚度。实验结束后迅速涂抹眼膏,防止眼球长时间暴露于空气中引起眼球脱水。
1.7 视网膜组织氧化指标检测
参照陈春艳等的研究方法[17],取各组小鼠眼球,在冰盘上分离视网膜组织并置于-80 ℃保存,供待检测指标SOD、GSH-Px、CAT 和MDA 使用。称取视网膜组织,按料液比1∶9(g/mL)加入0.9%无菌生理盐水,在冰水浴下用研磨器研磨成组织匀浆。4 ℃、2 500 r/min 离心15 min,取上清液备用。测定其余各步骤均按照试剂盒说明书进行。
1.8 实时荧光定量聚合酶链式反应(quantitative realtime polymerase chain reaction,qPCR)检测视网膜中与炎症相关基因表达水平
使用Trizol 提取视网膜组织中的总RNA,反转录得cDNA,并于-80 ℃保存。SYBRGreen 试剂盒检测基因表达水平,以3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参基因,引物设计如表1 所示。反转录及实时荧光定量PCR 程序参照试剂盒具体说明。
1.9 统计学分析
采用SPSS 20.0 软件进行统计学处理,结果均以平均值±标准偏差(x±s)表示,采用单因素方差分析(analysis of variance,ANOVA)评估各组间差异,P<0.05 具有统计学差异。
2 结果分析
2.1 熟地黄粗提物对小鼠视网膜ERG 结果分析
应用ERG 分析探讨熟地黄粗提物对光诱导的小鼠视网膜功能的影响。ERG 的振幅越高,说明小鼠眼球对光的反应敏感性越强。视网膜电生理3.0 b 波振幅见图1。
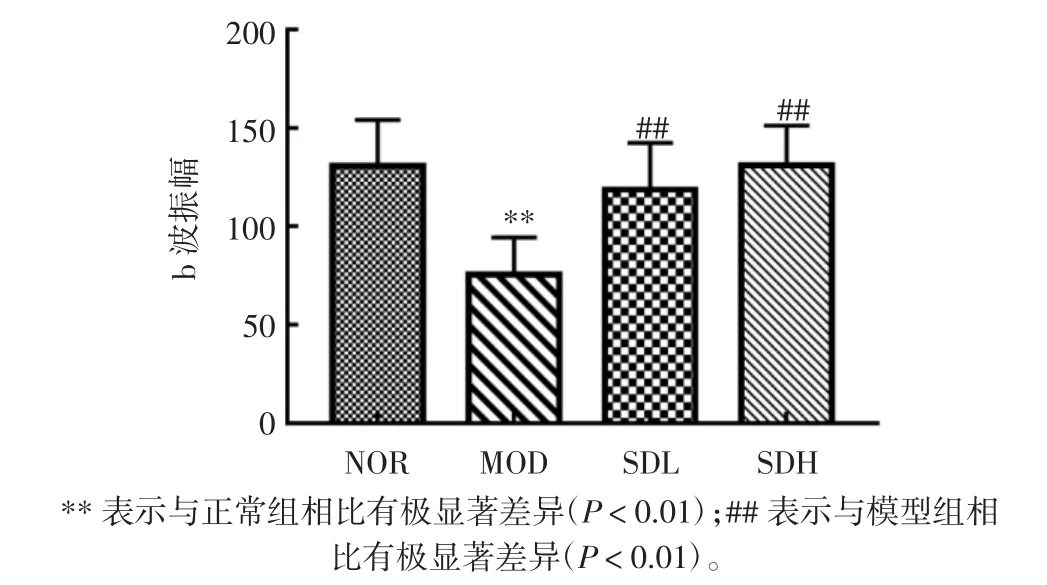
图1 视网膜电生理3.0 b 波振幅Fig.1 Retinal electrophysiology 3.0 b amplitude
如图1 所示,与正常组相比,光损伤模型组小鼠的3.0 b 波振幅显著降低(P<0.01),用熟地黄粗提物干预后,能显著抑制光诱导的b 波振幅的降低;与模型组相比,熟地黄低、高剂量组振幅分别升高了56.95%和73.18%,具有统计学差异(P<0.01)。
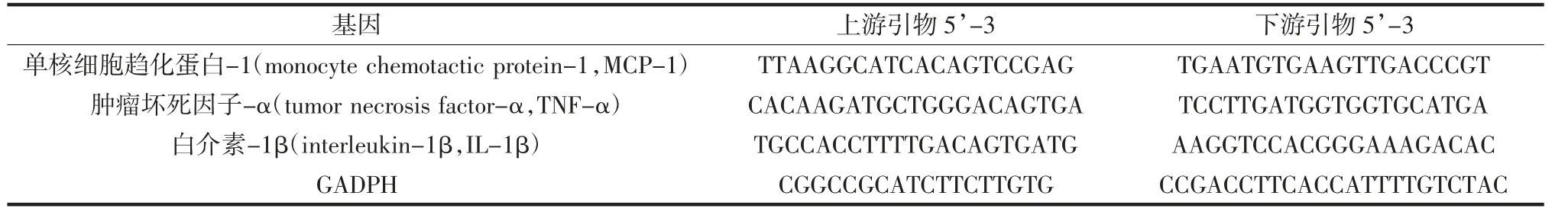
表1 视网膜组织中相关基因引物序列Table 1 Related gene primer sequences in retinal tissue
2.2 熟地黄粗提物对小鼠视网膜OCT 结果分析
光学相干断层扫描用于通过利用眼睛中不同组织的不同反射率来分析不同组织的结构和厚度。视网膜ONL 层厚度比较见表2。
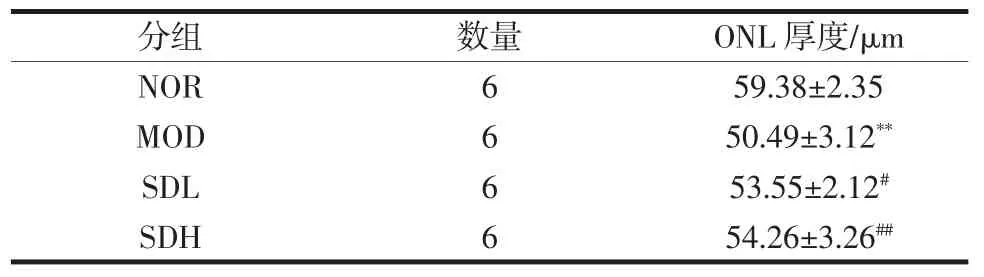
表2 视网膜ONL 层厚度比较Table 2 Comparison of retinal ONL thickness
从表2 可以看出,与正常组相比,模型小鼠视网膜的厚度明显低于正常组(P<0.01)。与模型组小鼠比较,熟地黄干预的小鼠视网膜ONL 层厚度高于模型小鼠,均具有统计学差异(P<0.05)。
2.3 熟地黄粗提物对小鼠视网膜中抗氧化酶活力的影响
强光损伤导致过量的活性氧自由基(reactive oxygen species,ROS)产生,并破环内源性抗氧化酶系统,加速氧化应激的发生。熟地黄粗提物对光损伤小鼠视网膜组织SOD、GSH-Px、CAT 活力及MDA 含量的影响见图2。
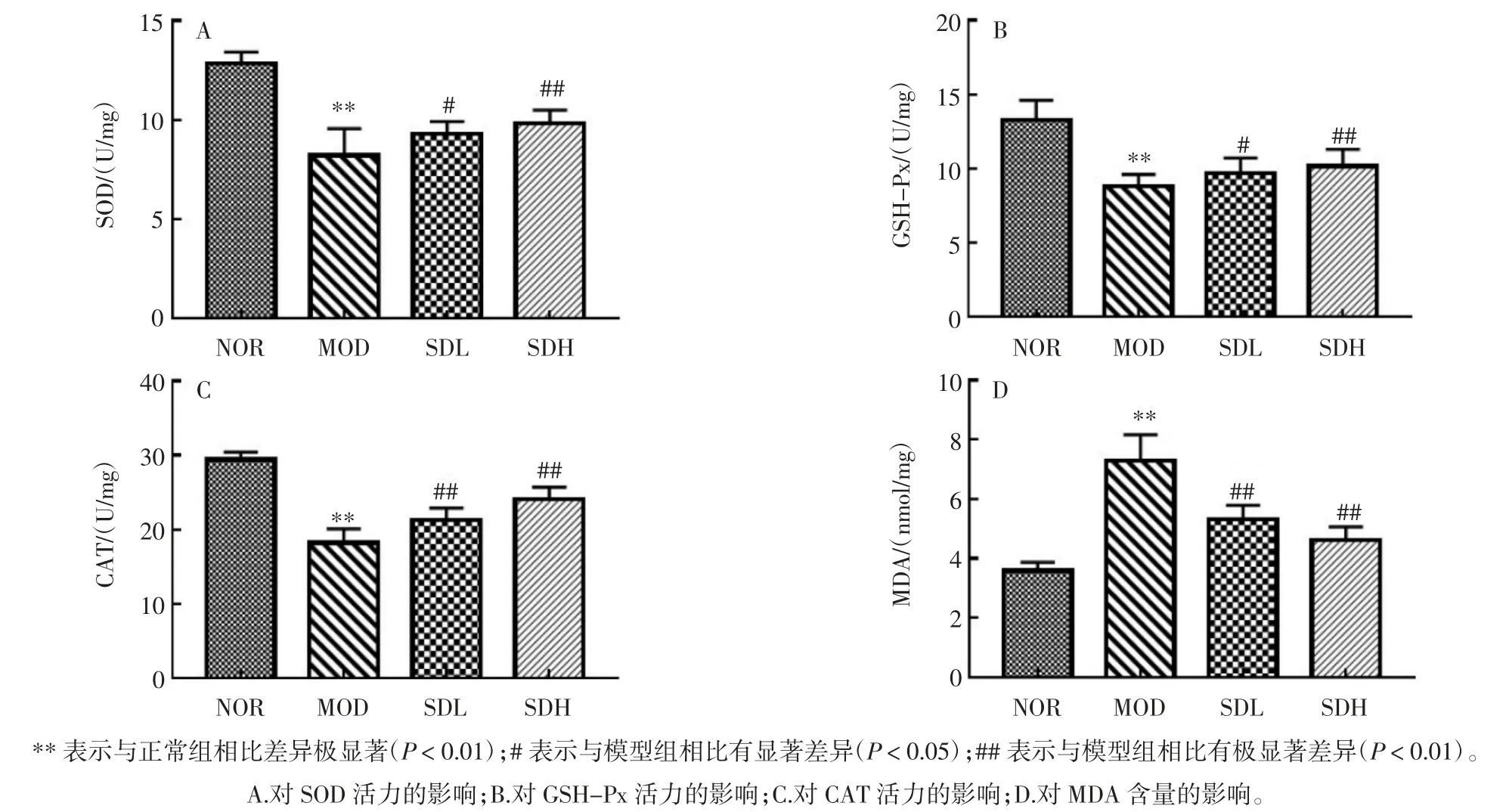
图2 熟地黄粗提物对光损伤小鼠视网膜组织SOD、GSH-Px、CAT 活力及MDA 含量的影响Fig.2 Effects of crude extracts from Rehmannia glutinosa on activity of SOD,GSH-Px,CAT and content of MDA in retinal tissues of light-damaged mice
如图2 所示,强光应激后,小鼠视网膜组织内SOD、GSH-Px 和CAT 活力均极显著降低(P<0.01),MDA 含量明显升高(P<0.01)。熟地黄粗提物干预可以明显提高视网膜组织中SOD、GSH-Px 和CAT 的活力,显著降低MDA 水平。
2.4 熟地黄粗提物对小鼠视网膜中促炎基因表达水平的影响
促炎细胞因子的表达与视网膜光氧化损伤有关[5],因此,试验研究了MCP-1、TNF-α 和IL-1β mRNA 表达水平。熟地黄粗提物对小鼠视网膜中MCP-1、TNFα 和IL-1β mRNA 表达的影响见图3。
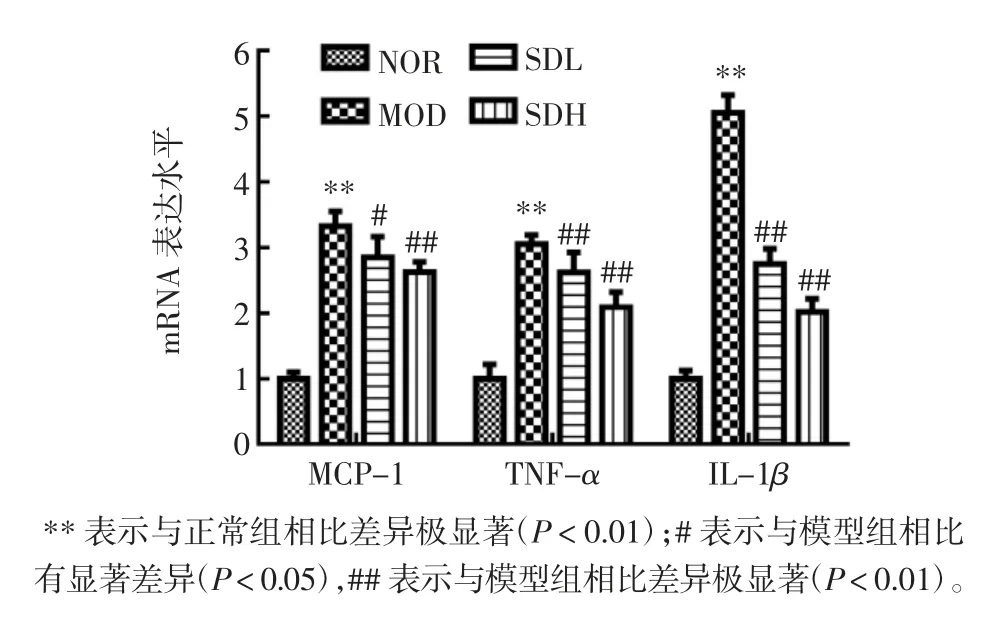
图3 熟地黄粗提物对小鼠视网膜中基因MCP-1、TNF-α 和IL-1β mRNA 表达的影响Fig.3 Effects of crude extract of Rehmannia glutinosa on mRNA expression of genes MCP-1,TNF-α and IL-1β mRNA in retina of mice
由图3 可知,模型组MCP-1、TNF-α 和IL-1β mRNA 相对表达量均显著高于正常组;与模型组相比,低、高剂量熟地黄提取物在不同水平上抑制了TNFα、MCP-1 和IL-1β 的表达(P<0.05),且熟地黄粗提物高剂量组的抑制作用优于低剂量组。
3 结论与讨论
熟地黄已经有数千年的食用历史。刘培建等研究表明,熟地黄具有抗衰老和抗氧化等多种药理特性[18]。REN 等研究表明,熟地黄水提物可通过激活Nrf2 信号通路逆转百草枯诱导的小鼠糖代谢紊乱[19]。大量研究表明,熟地黄与枸杞、菟丝子等中药复配具有缓解视疲劳[20]和保护视网膜[21]的功效。此外,熟地黄水提物可抑制小鼠星形胶质细胞中TNF-α 和IL-1β 的产生[16]。熟地黄具有良好的抗氧化和抗炎能力。视功能受损与感光细胞丢失有关,在光诱导视网膜损伤模型中,强光照射降低了ERG 3.0 b 波振幅,以及ONL 层的厚度,这与以前的报道一致[22]。
内源性抗氧化酶系统可在光损伤后被激活。过量的ROS 产生破环了这种防御机制,并加速氧化应激的发生。SOD、GSH-Px 和CAT 是抗氧化防御系统的重要酶系,它们能清除体内的活性氧自由基[23]。实验结果显示,熟地黄粗提物可以提高视网膜组织中SOD、GSHPx 和CAT 的活力,并且熟地黄低、高剂量组中MDA含量均显著低于模型组。由此可以说明,熟地黄粗提物能够提高机体的抗氧化能力。
内源性抗氧化酶的减少导致视网膜的光氧化应激,从而增加促炎症细胞因子的水平[24]。ROS 是促炎性细胞因子(如MCP-1、TNF-α 和IL-1β)释放的强烈刺激物,它们损伤视网膜细胞,在视网膜变性的发病机制中发挥重要作用[24]。通过对视网膜组织中与促炎相关基因表达水平的分析,可以看出光损伤导致MCP-1、TNF-α 和IL-1β mRNA 表达水平显著升高,给予熟地黄粗提物干预后可逆转这种情况。
综上所述,熟地黄粗提物可以提高视网膜组织的抗氧化能力并调控促炎相关基因的表达,从而对氧化应激引起的视网膜损伤和视疲劳具有缓解作用。为进一步探究熟地黄对视网膜的保护作用,可在后面的研究对熟地黄成分进行进一步分离,以期为视力保护和缓解视疲劳产品的开发提供科学依据。
