熟化发芽糙米粉对高脂血症大鼠的作用研究
2021-03-15张志宏孟庆虹高扬张英蕾严松管立军卢淑雯
张志宏,孟庆虹,高扬,张英蕾,严松,管立军,卢淑雯
(黑龙江省农业科学院食品加工研究所,黑龙江哈尔滨150086)
1 材料与方法
1.1 试验材料与试剂
发芽糙米:哈尔滨阿城金都米业有限公司,在黑龙江省农业科学院食品加工研究所完成双螺杆挤压瞬时熟化过程并进行粉碎。血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein choles terol,LDL-C)检测试剂盒:四川迈克生物科技有限公司;立普妥(阿托伐他汀钙片):辉瑞公司。
SD 雄性大鼠[72 只,SPF 级,8 周龄,体重(280±20)g]:北京维通利华实验动物有限公司;基础饲料和高脂饲料:北京科澳协力饲料有限公司。
1.2 仪器设备
7100 型全自动生化分析仪:日本HITACHI 公司;D-1 全自动高压蒸汽灭菌锅:北京发恩科贸有限公司;Multiskan go 酶标仪、TSE240V 型超低温冰箱:美国Thermo 公司;XS 204 型分析天平:瑞士METTLER TOLEDO 公司。
1.3 试验方法
1.3.1 饲料配方
基础饲料由68%碳水化合物、20%蛋白质、12%脂肪组成。高脂饲料由1%胆固醇、1%酪蛋白、1%磷酸氢钙、0.2%食盐、0.2%添加剂、10%猪油、0.2%胆盐、10%蛋黄粉、76.4%基础饲料组成。-4℃保存。
发芽糙米剂量组饲料配方:除基础饲料不同外,其它的饲料配方跟高脂饲料配方相同,发芽糙米低浓度组为63.9%的基础饲料+12.5%的发芽糙米;中浓度组为51.4%的基础饲料+25%的发芽糙米;高浓度组为26.4%的基础饲料+50%的发芽糙米,委托北京科澳协力饲料有限公司代工,-4 ℃保存。
具体原理为:预测塌岸线由水下稳定岸坡线和水上稳定岸坡线的连线组成时,水下稳定岸坡线由原河道多年最高洪水位及水下稳定坡脚α确定;水上稳定岸坡线由设计洪水位和毛细水上升高度H’及水上稳定坡脚β确定(图1)。以原河道多年最高洪水位与岸坡交点A为起点,以α为倾角绘出水下稳定岸坡线,该线延伸至设计洪水位加毛细水上升高度的高程点B,再过B点以β为倾角绘出水上稳定岸坡线,与原岸坡交于点C,C点即为水上稳定岸坡的终点。水上稳定岸坡线起点B的高程所对应的原岸坡D点,与该线终点C之间的水平距离即为预测的塌岸宽度St。
1.3.2 动物饲养及处理
雄性大鼠随机分为6 组,分别为空白组(normaldietgroup,ND)、高脂组(highfatdietgroup,HFD)、低剂量组(12.5T:HFD+12.5%GBR)、中剂量组(25T:HFD+25%GBR)、高剂量组(50T:HFD+50%GBR)和药物组[HFL:HFD+lipitor,10 mg/(kg·d)]。每组12只,分笼饲养,每笼4 只。保持室温(23±2)℃,相对湿度(60±5)%,自由进食饮水,每天记录1 次各组进食量,每周称量1 次大鼠体重。
第一阶段,空白组饲喂基础饲料,其余各组饲喂高脂饲料,6 周后,禁食12 h,不禁水,尾静脉采血测定血清中TC、TG,空白组血清TC、TG 含量与模型组比较,有显著差异说明高血脂模型造模成功。
第二阶段,空白组饲喂基础饲料,高脂组和药物组饲喂高脂饲料,剂量组分别饲喂含12.5%、25.0%、50.0%熟化发芽糙米粉的高脂饲料,药物组每天灌胃阿托伐他汀钙[立普妥,10 mg/(kg·d)],其余各组灌胃同等剂量的生理盐水。连续给药7 周,禁食12 h,不禁水,麻醉后腹主动脉采血,分离制备血清,-20 ℃保存。分离心、肝、脾、肾等脏器,以及肾周脂肪、睾周脂肪和肠系膜脂肪,取部分肝脏液氮速冻,-80 ℃保存备用。
1.4 数据处理
采用SPSS 20.0 软件包进行统计分析。多组均数进行方差齐性检验(homogenity of variances),方差不齐时,经变量交换达到齐性后作单因素方差分析(one-way ANOVA);各组间的两两比较采用多重比较(least significat difference,LSD)法。
2 结果与分析
2.1 高脂模型的建立
高脂饲料对大鼠体重及血清脂质含量变化见表1。
通过表1 可以看出,高脂模型组大鼠的体重以及体增重均极显著高于空白对照组。另外大鼠的血清中TC、TG 水平也显著升高,说明高脂血症大鼠模型建立成功。

表1 造模时大鼠体重和血清脂质含量变化Table 1 Changes in body weight and serum lipid content at modeling time
2.2 熟化发芽糙米粉对高血脂症大鼠体重的影响
成功建立高脂血症大鼠模型后,熟化发芽糙米粉对高血脂症大鼠体重的影响见图1。
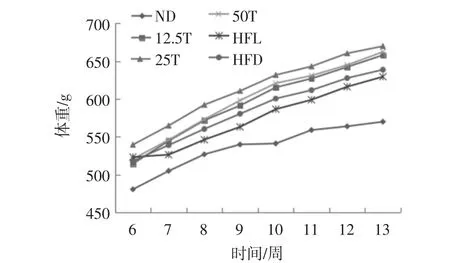
图1 饲喂熟化发芽糙米粉期间大鼠体重变化Fig.1 Body weight changes during the experiment of feeding mature GBR flour
由图1 可以看出,在整个实验期间,虽然体重增长程度不同,但6 组大鼠的体重均呈现逐渐增长的趋势。实验起始阶段,患有高脂血症的大鼠体重差异不明显,在第2 周之后,各组大鼠适应灌胃处理之后,体重增长幅度变大,含有熟化发芽糙米粉的剂量组增长明显,但与高脂组相比差异不显著。其原因可能是大鼠摄入含有大量的γ-氨基丁酸的熟化发芽糙米粉,而有研究表明发芽糙米中γ-氨基丁酸具有促进生长的作用,由此引起大鼠实验期间剂量组体重的快速增长[9]。糙米发芽后γ-氨基丁酸(γ-aminobutyric acid,GABA)大量积累,GABA 是一种功能性的非蛋白质氨基酸,广泛分布于生物体内的天然活性成分,参与哺乳动物体内的多种代谢和生理活动,在动物体内主要作为中枢神经系统的抑制性神经递质[10],促进生长激素分泌,也有研究表明GABA 可以在胃中刺激胃蛋白酶的分泌,抵抗胃溃疡,从而起到一定的保健作用[11]。而空白组大鼠摄入的为基础维持级饲料,摄食速度较快、活动量较多、体重增长最为缓慢。药物组大鼠虽然同样摄入高脂饲料,但是由于灌胃阿托伐他汀钙,能够促进脂质代谢,因此体重增长低于高脂组,高于对照组。
2.3 熟化发芽糙米粉对高血脂症大鼠的生长参数影响
实验期间大鼠的生长参数如表2 所示。
由表2 可知,患有高脂血症大鼠的肾周脂肪、睾周脂肪以及肠系膜脂肪质量均显著高于空白组,剂量组的脂肪组织质量同药物组和高脂组相比差异不显著,但是可以看出大鼠摄入一定剂量的熟化发芽糙米粉之后,对高脂血症大鼠的脂肪堆积有着降低的作用,可能是因为实验周期不足,而没有表现出显著差异性。

表2 熟化糙米粉对大鼠生长参数的影响Table 2 Matured brown rice on the growth parameters
2.4 熟化发芽糙米粉对高血脂症大鼠的主要脏体比的影响
脏器指数在一定程度上能体现实验期间大鼠的生理状况,若大鼠长期摄入高脂饲料导致大鼠脏器的脂质累积或病变均可通过脏器指数反映出来,如表3所示。
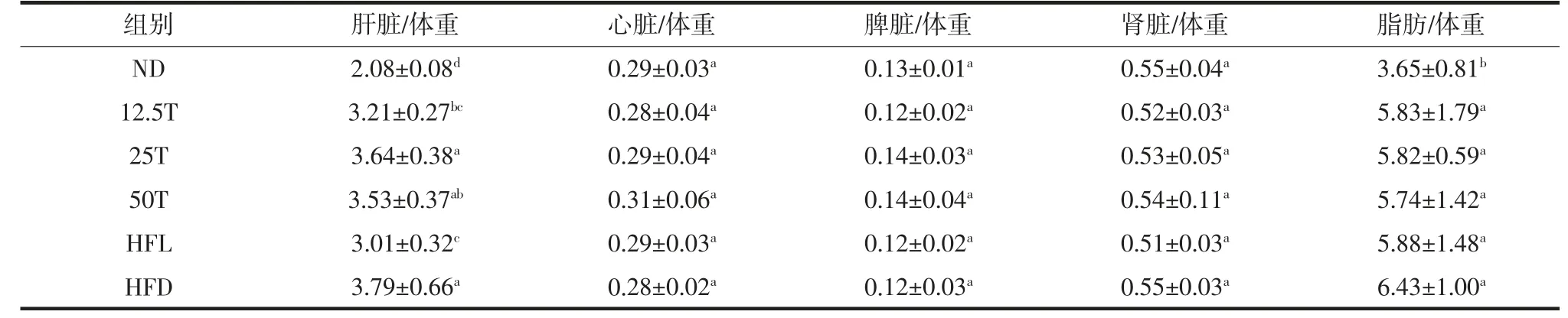
表3 熟化发芽糙米粉对大鼠脏体重量比值的影响Table 3 The cooked GBR on rat body weight ratio
高脂组的肝脏/体重显著高于空白组(P<0.05),说明高脂组因摄入过多脂肪导致肝脏显著增重。剂量组与高脂组相比,肝脏/体重有不同程度的降低,低剂量组显著低于高脂组(P<0.05),同药物组相比差异不显著,说明熟化发芽糙米粉对降低肝脏/体重有一定效果。
整体对比各实验组大鼠的心脏/体重、脾脏/体重、肾脏/体重均无显著差异(P>0.05),但从剂量组之间可以看出,随着熟化发芽糙米粉剂量降低,心脏/体重、脾脏/体重、肾脏/体重的比值降低。而脂肪/体重方面,高脂血症大鼠显著高于空白组(P<0.05),剂量组跟高脂组比无显著差异(P>0.05),但在一定程度上有降低作用,且均低于药物组,高剂量组效果最好。
以上实验结果表明,摄入熟化发芽糙米粉可以降低高脂血症大鼠肝脏/体重的脏器指数,并对机体体内的脂肪堆积有着降低作用。Yasui 等[12]发现,将发芽糙米与啤酒酵母混合后用双螺旋压片机挤压,糙米的可消化性提高,贮藏过程中脂肪酸度下降;而且生物学功能明显改善,饲喂大鼠表现出抗高血压效果。发芽糙米和大麦混合制成的复合面粉有显著的抗高血压效果。
2.5 熟化发芽糙米粉对高血脂症大鼠血脂水平影响
熟化发芽糙米粉不仅对高脂血症大鼠的脏器存在一定的影响,同时对血脂水平也存在一定的影响,见表4。
由表4 可知,剂量组大鼠的血清总胆固醇(TC)、甘油三酯(TG)含量低于高脂组,高于空白组,存在差异显著性(P<0.05);同药物组之间差异不显著(P>0.05),但低剂量组的血清TC、TG 含量低于药物组,说明熟化发芽糙米粉可有效地降低高血脂症大鼠血清中TC、TG 含量。另外低剂量组表现结果优于高剂量组,其原因可能是由于熟化发芽糙米粉中含有的γ-氨基丁酸为促生长因子,熟化发芽糙米粉剂量过高,导致高脂血症大鼠整体生长水平高于低剂量组,从而对大鼠血脂水平的降低效果低于低剂量组。
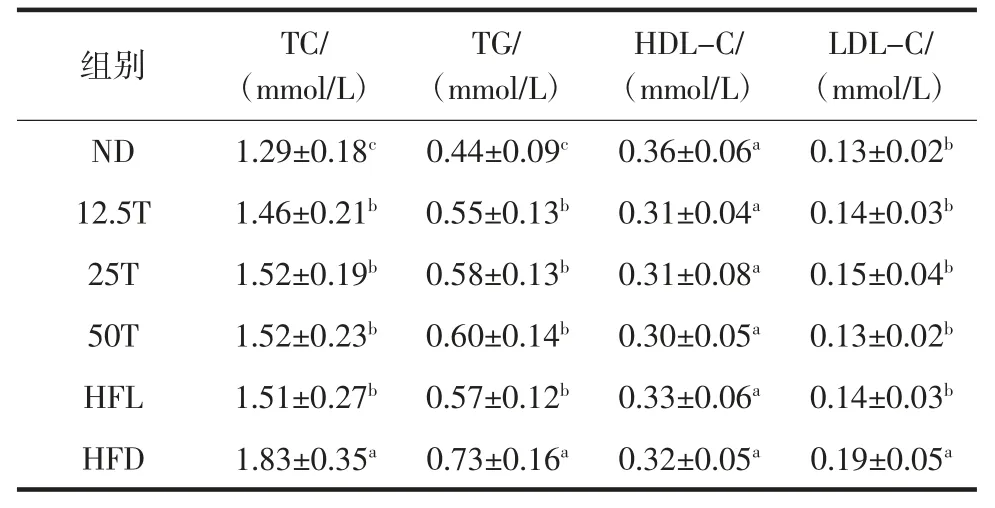
表4 熟化发芽糙米粉对大鼠血脂水平的影响Table 4 Cooked GBR on serum lipid levels
另外大鼠血清高密度脂蛋白胆固醇(HDL-C)含量在各试验组之间无显著差异(P>0.05)。高脂组大鼠血清低密度脂蛋白胆固醇(LDL-C)含量显著高于其它各组(P<0.05),剂量组同空白组、药物组之间无显著差异(P>0.05),说明熟化发芽糙米粉具有降低高血脂症大鼠的LDL-C 水平的功效,且高剂量抑制血清LDLC 升高效果最为明显。HO J N 等[13]研究发现饲喂发芽糙米抑制了肝脏和附睾脂肪细胞中的体重增加和脂质积累,并且改善了血清脂质谱,通过降低相关基因和蛋白表达来控制脂肪生成。SHEN K P 等[14]研究表明发芽糙米通过改善C57BL6J 小鼠的脂质合成和代谢来防止高脂饮食诱导的高脂血症。
2.6 熟化发芽糙米粉对高血脂症大鼠血脂水平影响
正常生理情况下,生物机体内活性氧的产生和清除保持动态平衡,维持在细胞所需的极低水平,使组织细胞免受活性氧损伤。而当患上高脂血症时,这种动态平衡被打破,机体内活性氧增多,脂质过氧化作用增强,丙二醛(malondialdehyde,MDA)等醛类产物含量增多,组织细胞的膜结构易受损伤。另一方面,高脂血症在生理上直接影响动脉壁的抗氧化酶系统,降低动脉壁内超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)以及谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等活性,从而导致体内氧自由基清除功能障碍,直接损伤局部动脉壁而造成血管机能异常,总抗氧化能力(total anti-oxidant capability,T-AOC)的高低可反映机体抗氧化的能力大小。但Lim S M 等[15]研究发现GBR 通过抑制体重增加和食物摄取,改善脂质谱,减少肥胖大鼠的瘦素水平和白色脂肪组织质量。这与本实验的体重和摄食量变化不是完全吻合,但对脂肪/体重比值结果趋于一致性。Lee Y R 等[16]同样证实发芽糙米具有降胆固醇和抗氧化状态的功效。
熟化发芽糙米粉对大鼠氧化应激水平的影响见表5。

表5 熟化发芽糙米粉对大鼠氧化应激水平的影响Table 5 Cooked GBR on oxidative stress levels
从表5 可知,与空白组比较,模型组大鼠血清中的MDA 含量显著升高(P<0.05),说明高脂饮食可促进大鼠体内发生的脂质过氧化反应,使得血清中的MDA含量显著升高;剂量组大鼠血清MDA 的含量接近于空白组(P<0.05)。与空白组比较,模型组大鼠血清SOD活性显著降低(P<0.05),说明高脂饮食可降低大鼠体内清除氧自由基的能力,从而使得大量氧自由基进入血液循环;低剂量组大鼠血清SOD 活性与空白组无明显差异,药物组大鼠血清SOD 活性显著高于模型组(P<0.05)。中、高剂量组同药物组相比无明显差异,表明受试物能增强SOD 活性,从而增强机体清除自由基能力。CAT 也是机体抗氧化酶系统的重要组成之一,它可与SOD 协同作用而清除氧自由基。与空白组比较,模型组大鼠血清CAT 活性显著降低(P<0.05),表明大鼠体内清除自由基的能力减弱;中、高剂量组大鼠血清CAT 活性接近空白组,表明受示物能显著增强CAT 活性(P<0.05)。
GSH-Px 是机体存在的一种含硒清除自由基和抑制自由基反应的酶系统,在氧化防御反应中起着非常重要作用,与空白组比较,模型组大鼠血清GSH-Px 活性显著降低(P<0.05),表明大鼠机体对脂质过氧化反应产物的清除能力减弱;中、高剂量组大鼠血清GSHPx 活性显著高于空白组(P<0.05),低剂量组大鼠血清GSH-Px 活性接近于空白组,表明受示物能增强机体GSH-Px 活性,减少过氧化对机体的伤害,并且与给药剂量呈正相关。高脂饮食导致大鼠血清中T-AOC 水平有所下降,再给予受试物之后,各剂量组T-AOC 水平均有一定程度提高,说明在高脂饮食大鼠体内存在氧化与抗氧化的失衡,产生的自由基多于清除的自由基,使自由基在体内蓄积,引起脂质过氧化,干扰机体的代谢活动,从而导致机体氧化损伤。
3 结论
本试验通过对高脂血症大鼠饲喂熟化发芽糙米粉,发现可以降低高脂血症大鼠肝脏/体重的脏器指数,降低高血脂症大鼠血清中TC、TG 含量,提高高脂血症动物机体免疫力,并对机体体内的脂肪堆积有着降低作用。发芽糙米中γ-氨基丁酸具有促进生长的作用,由此引起大鼠实验期间剂量组体重的快速增长。熟化发芽糙米粉可有效地降低高血脂症大鼠血清中TC、TG 含量,具有降低高血脂症大鼠的LDL-C 水平的功效,且高剂量抑制血清LDL-C 升高效果最为明显。
熟化发芽糙米粉能够提高机体内SOD、CAT、GSH-Px 三大抗氧化酶活性,降低脂质过氧化产物MDA 的含量。这一结果说明熟化发芽糙米粉能够提高机体内抗氧化功能,清除机体内过多的氧自由基,从而调节和改善自由基代谢的平衡,并减少机体内发生脂质过氧化反应,调整高脂饮食引起的脂肪代谢紊乱。
