TDF转换为TAF治疗病毒学应答后CHB的疗效和安全性研究
2021-03-15陈丽文高文军张倩华
陈丽文 高文军 祝 达 蔡 遐 张倩华
(中山市第二人民医院肝病综合科 中山 528400)
富马酸替诺福韦二吡呋酯(tenofovir disoproxil fumarate,TDF)是慢性乙型肝炎(chronic hepatitis B,CHB)治疗使用的一线药物,该药物可控制乙肝DNA复制,耐药发生率低[1],但肾脏安全性值得关注。富马酸丙酚替诺福韦(tenofovir alafenamide,TAF)作为在中国新上市一线药物[1~3],具备良好的肾脏安全性。关于TAF与TDF在疗效、安全性方面的研究相对较少,本研究对此进行临床研究。
1 资料与方法
1.1 研究对象
回顾性分析我院2018年11月~2019年5月期间收治的132例TDF治疗48周以上,病毒已应答的CHB患者,将继续使用TDF的患者纳入对照组,TDF转换为TAF的患者纳入实验组,各66例。记录两组治疗基线时间及48周后谷丙转氨酶(ALT)、谷草转氨酶(AST)、血肌酐(Cr)、尿酸(UA)、血β2微球蛋白(β2-MG)、尿β2微球蛋白(Uβ2-MG)、血胆固醇(CHOL)、甘油三酯(TG)、低密度脂蛋白(LDL-C)、肝硬度(FS)结果并进行分析。
1.2 纳入及排除标准
纳入标准:(1)符合慢性乙型肝炎诊断标准[1];(2)入选前符合初治应用TDF时间大于48周且病毒学应答(乙肝DNA<100 IU/ml)。
排除标准:(1)肝硬化;(2)肝癌及其他恶性肿瘤;(3)合并HCV、自身免疫性肝病、酒精性肝病、药物性肝损伤;(4)合并肾脏病史或严重肾功能不全;(5)合并糖尿病或高血压。
1.3 药物方案
富马酸替诺福韦二吡呋酯[Aspen Port Elizabeth(Pty)Ltd,批准文号H20130589,规格:300mg×30片/盒]治疗方案:每日服用1次,每次300mg。富马酸丙酚替诺福韦(Patheon Inc,批准文号H20180060,规格:25mg×30片)治疗,每日随食物服用1次,每次25mg。两组均治疗48周。
1.4 检验及检查设备
肝肾功能、β2-MG、CHOL、TG、LDL-C检测使用西门子全自动生化分析仪(ADVIA 1800);尿液分析仪测定Uβ2-MG;血清HBV DNA使用达安公司乙型肝炎病毒核酸测定试剂(PCR-荧光探针法),检测下限(<100IU/mL)。所有检验在我院检验中心完成检测。
肝硬度设备为FIBROSCAN 502,操作医师为从事超声工作>5年以上者。
1.5 统计学处理
数据采用SPSS19.0统计学软件进行分析处理,绘图采用GraphPad Prism 5进行。所有计量资料均符合正态分布,采用单因素ANOVA检验;计数资料采用四格表χ2检验。P<0.05表示差异具有统计学意义。
2 结果
两组在基线时间上,性别、年龄、ALT、AST、Cr、UA、β2-MG、CHOL、TG、LDL-C、FS无统计学差异(均P>0.05),两组所有病例基线HBV DNA均小于100 IU/ml。实验组Uβ2-MG(1.21±0.149 mg/L)明显高于对照组(0.46±0.057 mg/L),且具有统计学意义(P<0.001),见表1。

表1 两组在基线时间数据比较
两组在48周时,ALT、AST、Cr、UA、β2-MG、TG、FS无统计学差异(均P>0.05)。实验组Uβ2-MG(0.96±0.512 mg/L)与对照组(0.89±0.946 mg/L)比较无统计学差异(P>0.05)。实验组CHOL、LDL-C(4.88±0.719、2.90±0.578)明显高于对照组(4.41±0.696、2.70±0.389),且均具有统计学意义(P<0.05)。两组均未出现病毒学突破表现,见表2。

表2 两组在48周时数据比较
实验组48周时AST(29.15±7.485)低于基线(32.09±9.014),具有统计学意义(P=0.044)。实验组48周时LDL-C(2.90±0.578)高于基线(2.66±0.320),具有统计学意义(P=0.004)。实验组48周时FS(6.19±1.469)低于基线(6.88±2.162),具有统计学意义(P=0.034)。其他指标无统计学差异(均P>0.05),见表3。
对照组48周时Uβ2-MG(0.89±0.946)明显高于基线(0.46±0.057),具有统计学意义(P=0.011)。对照组48周时FS(5.79±1.473)低于基线(6.53±1.519),具有统计学意义(P=0.005)。其他指标无统计学差异(均P>0.05),见表4。
3 讨论
3.1 TAF与TDF疗效对比
TAF的作用机制与TDF基本一致,可抑制病毒聚合酶活性,阻断HBV-DNA链的延长与HBV的复制[4]。本研究中,两组患者均未出现48周病毒学突破,提示TAF与TDF在乙肝DNA的控制上无明显差异性。两项多中心的随机双盲对照研究中[5~6],TAF在ALT复常率方面明显优于TDF。本研究中两组在基线时ALT、AST均小于正常值上限,在48周时未见ALT异常,两组无统计学差异。但换用TAF组48周时较基线AST有轻度降低,且具有统计学意义,提示使用TAF可能会获得更高的转氨酶复常率。TAF在我国上市时间较短,目前国内鲜有TAF与TDF在肝硬化方面的比较报道。本研究中,两组均在48周时获得了更低的FS值,且具有统计学差异,但两组互相比较并无统计学差异,提示TAF与TDF有相近的改善肝纤维化作用,说明两者在预防肝硬化的发生上可能具有相近的能力,需要更大样本和更长时间的研究来验证。

表3 实验组基线与48周时数据比较
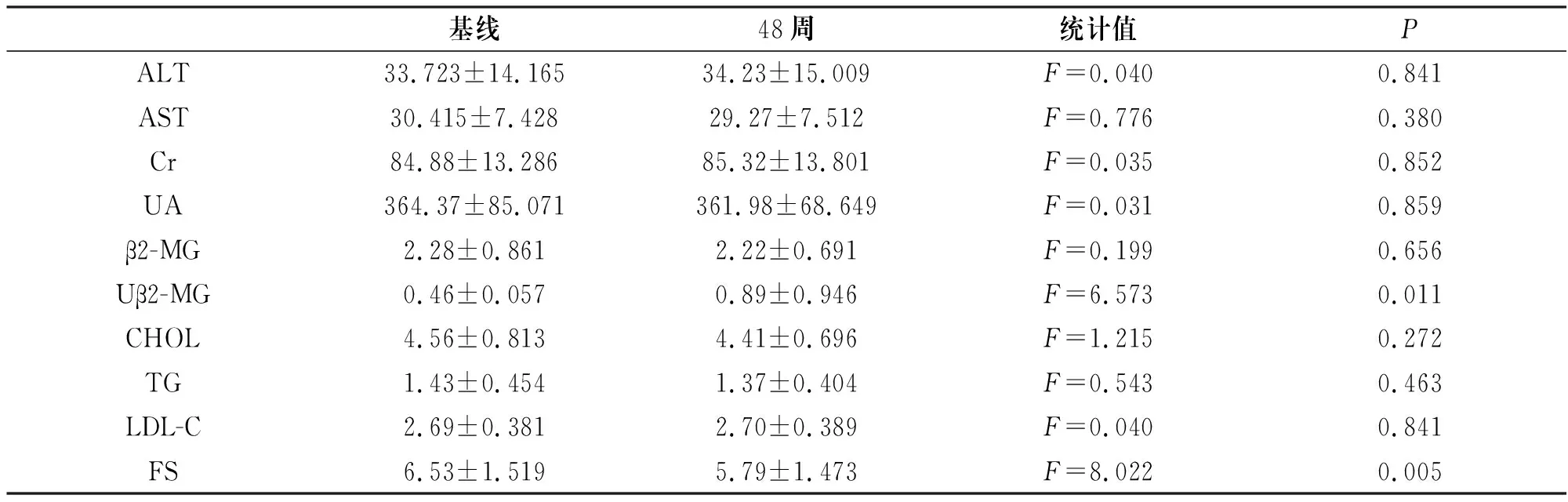
表4 对照组基线与48周时数据比较

图1 两组在基线与48周Uβ2-MG比较
3.2 TAF与TDF肾脏安全性对比
TDF服用后易对肾小管线粒体造成损伤,从而提升Uβ2-MG水平。TAF相比TDF,在全身血浆中的暴露量降低89%[5],降低进入肾小管的药物量,提高了TAF的肾脏安全性[7]。本研究发现在基线时,换用TAF组Uβ2-MG水平明显高于TDF组,且具有统计学差异。这可能与临床医师在开具TAF处方时,关注了患者的肾小管功能,造成数据的差异性。但在48周后,两组在Uβ2-MG水平上无统计学差异;TDF组在48周时出现了明显Uβ2-MG水平升高,且统计学具有差异性;TAF组在48周时出现了Uβ2-MG水平降低,但无统计学差异,见图1。这可能说明,TDF转为TAF后能有效停止肾小管损害,但不一定能改善肾小管功能。换用TAF后是否能得到更大的肾小管获益,需要更长时间的、更大样本量的研究来说明。两组在Cr、UA、β2-MG上无差异性,且同组48周前后也无统计差异性,这提示可能针对TDF及TAF的肾脏安全性评估,Uβ2-MG水平更具有现实意义。
3.3 TAF对血脂的影响
在本研究中,发现在两组基线血脂无统计学差异的情况下,换用TAF48周后CHOL、LDL-C明显高于TDF组,而TG无差异性。48周对比基线,TDF组血脂指标均未见明显差异性,而换用TAF组LDL-C明显高于基线。CHOL虽也高于基线,但无统计学差异。在临床上,开具TAF处方时,可能会更偏向年龄较大潜在肾功能欠佳者,本研究基线中换用TAF组平均年龄略大于TDF组,但无统计学差异。而更高的胆固醇和低密度脂蛋白也是老年患者心血管事件发生的高危因素,这需要更多数据来证实TAF的安全性并在TAF的应用过程中密切监测CHOL和LDL-C。
综上所述,对于TDF经治的CHB患者,换用TAF的疗效不劣于TDF持续治疗,在肾小管安全性上具有优势,但需注意血脂异常。
