不同镁/磷盐添加剂对蓝藻堆肥的氮素损失控制效果
2021-03-15唐尙柱赵晓海斯鑫鑫王顺永李珊珊张学胜李玉成
唐尙柱,赵晓海,斯鑫鑫,王顺永,李珊珊,张学胜,李玉成
(安徽大学资源与环境工程学院,合肥230601)
近年来,随着巢湖流域内经济与社会的不断发展,大量的氮、磷等营养元素输入湖体,致使水体富营养化现象加剧,蓝藻水华频繁暴发[1]。打捞是当前应对蓝藻水华暴发较为有效的治理手段,但是打捞上来的蓝藻如不及时进行妥善处理极易造成二次污染[2−3]。蓝藻中含有丰富的有机质及氮、磷等多种利于植物生长的营养元素,是农业生产中优质的肥料资源[4−5],因此通过高温好氧堆肥的方式将蓝藻转化为有机肥成为蓝藻资源化利用的重要方式之一[6]。然而,相关研究表明,好氧堆肥过程中会以NH3挥发的形式损失大量的氮素[7−8]。例如:动物粪便堆肥过程中这一损失量约为初始氮含量的9.6%~46%[9];污泥堆肥过程中约为40%~80%[10];城市垃圾堆肥化处理过程中约为50%~60%[11−12]。蓝藻富含蛋白质,在传统的好氧堆肥过程中,有机氮降解后极易转化为NH3排放进入大气[10]。因此,降低NH3挥发是蓝藻堆肥过程中氮素损失控制的关键。
当前控制堆肥过程中NH3排放的方法主要包括调整堆肥材料本身的特性[13];改善堆肥工艺条件[14];添加化学药剂使材料的属性发生改变,或是与释放的NH3发生反应[10,12];添加外源微生物以改变堆肥过程中碳和氮的代谢[15]。鸟粪石结晶法此前被广泛应用于废水处理中氮和磷的回收再利用,这为实现堆肥过程中的氮素损失控制提供了一种新的思路[16]。通过添加镁(Mg)盐和磷(P)盐将堆肥过程中释放的NH3以磷酸铵镁结晶(MgNH4PO4·6H2O)的形式沉淀下来,可有效减少NH3的挥发。有研究已证实该方法在食物垃圾、家禽和猪粪便的堆肥过程中对于降低NH3排放具有积极作用[17−19],然而其在蓝藻堆肥过程中的氮素转化和损失机制可能与上述物料堆肥不尽相同,因此需要做进一步研究。
此前关于蓝藻堆肥的研究多集中于堆肥过程中的养分变化或是藻毒素降解情况[20−21],有关氮素损失控制的报道也仅局限于酸化沸石、过磷酸钙等几种常用氮素固定剂的添加[4,22],对基于鸟粪石结晶反应原理的氮素损失控制技术之间的对比关注较为少见。为此,本文以菌渣、稻壳作为调理剂,联合蓝藻在基地温室大棚内进行较大规模的好氧堆肥试验,研究了4种不同组合的Mg盐和P盐对堆肥过程中氮素损失控制的效果,以期为蓝藻好氧堆肥工程化应用提供较佳的工艺参数。

表1 堆肥材料的基本理化性质Table 1 Basic characteristics of composting materials
1 材料与方法
1.1 试验场地与供试材料
堆肥试验在安徽省合肥市肥西县紫蓬镇新农村实验基地的温室大棚内进行。试验所需蓝藻自巢湖塘西河口打捞获取,菌渣由合肥立新菌种厂培训学校提供,稻壳从实验基地附近的紫蓬镇制米厂获得,上述材料的基本理化性质见表1。此外,堆肥过程中添加的Mg(OH)2、MgSO4、H3PO4、KH2PO4均为化学纯试剂。
1.2 堆肥方法与试验设计
堆肥试验采用蓝藻、菌渣和稻壳混合堆肥,各堆体分别添加蓝藻500 kg、菌渣500 kg和稻壳250 kg。为了加快堆肥进程,同时添加堆体总质量1%的EM菌促进堆体发酵。控制堆体初始含水率在55%左右,初始C/N为22.89。
为了比较不同组合Mg盐和P盐对蓝藻堆肥过程中氮素的控制效果,试验共设置4个处理组和1个空白对照组:①MP组,混合堆料与Mg(OH)2+H3PO4;②MKP组,混合堆料与Mg(OH)2+KH2PO4;③MSP组,混合堆料与MgSO4+H3PO4;④MSKP组,混合堆料与MgSO4+KH2PO4;⑤CK组,混合堆料。各试验组均做2组重复。已有的研究结果[23−25]表明,堆肥过程Mg盐和P盐的添加量相当于初始氮含量的15%(以摩尔计)时有利于鸟粪石结晶的形成,因此本研究中Mg盐和P盐的添加量为15%。将称好的Mg盐与P盐各自用水溶解后搅拌混匀,再添加到堆肥物料中充分混合。所有试验组均按长×宽×高=1.5 m×1.5 m×0.8 m锥体自然堆置。堆肥周期设定为42 d,分别在第10、20、30 d和40 d翻堆。
1.3 样品采集与分析方法
堆肥期间每日上午9:30和下午17:30使用红外线温度探测仪(SENIT/SNT 550,德国衡利)测定堆体温度。NH3样品采用通气法采集[26]。分别在堆肥开始后的第0、5、10、16、22、32、42 d取样,于堆体上部、中部、下部各取约200 g物料充分混合后作为一个堆肥样品。样品分为3部分:一部分作为新鲜样品贮于4℃冰箱中;一部分用于测定样品含水率;一部分风干、磨碎、过筛后备用。
1.4 氮素损失率与固定率的计算方法[22]
根据氮素平衡有:第一次取样前后:
第二次取样前后:
依次类推,每次取样间隔均有氮素损失。
第n次取样前后,氮素平衡式:
则总的全氮损失量:
氮素损失率:
NH3−N损失率:
氮素固定率:
式中:n为取样次数;W0为堆肥开始时堆肥原料总质量(鲜质量),kg;Mw0为堆肥开始时堆肥样品含水量,%;Wn为每次取样后堆肥的质量(鲜质量),kg;Mwn为每次取样时堆肥样品含水量,%;Wn′为每次取的堆肥样品质量(鲜质量),kg;Nn为每次取样的TN含量,g·kg−1。
1.5 数据处理与分析
采用Microsoft Excel 2010与Origin 2018软件对试验数据进行基础分析和绘图;所有试验数据均采用SPSS22软件进行单因素方差分析(ANOVA),并通过LSD−t检测差异显著性。
2 结果与讨论
2.1 堆肥过程中的基本理化指标
如图1a所示,试验开始后,各试验组的温度迅速升高,MP、MKP、MSKP处理组和CK组在6~8 d时达到各自堆制过程中的最高温度,分别为63.2、60.5、61.2℃和61.5℃,并在高温阶段(>50℃)持续了11~13 d,这足以使得堆肥产品达到卫生要求。30 d后随着易降解有机质的耗尽,堆体温度逐渐下降直到接近气温。MSP组温度在0~30 d显著低于CK组(P<0.01),最高温度只达到53.6℃,并且高温阶段只持续了6 d,表明MSP处理对于堆肥过程具有明显的抑制作用。
如图1b所示,4个处理组的起始pH均低于CK组,这与所添加Mg盐和P盐的性质有关。试验开始后,高氮物质剧烈矿化产生的大量NH+4−N使各试验组的pH逐渐上升并达到峰值;而后随着NH3的大量释放以及硝化作用的增强[25],堆体pH逐渐降低最终趋于稳定。堆肥结束后,除CK组外,各处理组pH均产生了小幅度上升,这主要是由于Mg盐和P盐的添加使得堆肥过程中更多的NH+4−N被固定下来。MSP组的pH显著低于其他处理组(P<0.01),这可能是由于MgSO4+H3PO4呈弱酸性,使得发酵过程中各种挥发性有机酸的累积加剧,导致堆肥的pH进一步降低。
如图1c所示,各试验组的有机质含量均随着时间的变化逐渐降低。堆肥结束后,MP、MKP、MSP、MSKP处理组和CK组的有机质含量分别为471.89、475.24、549.20、482.96 g·kg−1和462.77 g·kg−1,较初始有机质含量分别下降了25.47%、23.12%、12.23%、21.26%和25.47%。整体来看,有机质在0~16 d的降解速率明显大于16~42 d。这主要是由于堆肥前期微生物代谢作用随着温度的升高不断增强,并且所分解的均为结构简单易降解的有机物;堆肥后期微生物活动随着温度的降低不断减弱,并且木质素等较难分解的有机物成为主要碳源,因此降解速率逐渐减小[21]。
如图1d所示,各试验组初始GI均低于50%,说明堆肥物料具有较高的植物毒性,这也意味着蓝藻不经过处理直接作为肥料施用存在一定风险。在0~5 d,各试验组的GI相较于初始变化较小,这主要归因于堆肥初期挥发性脂肪酸和高浓度NH+4的产生对种子萌发产生了抑制[28]。此后随着堆肥的继续进行,所有试验组的GI都逐渐增加。堆肥结束后,除MSP组外,其余各试验组的最终GI均超过80%,说明MSP组堆肥未达到腐熟状态。
研究表明,MSP组的温度、有机质及GI指标的变化情况有异于其他处理组的原因主要是由于MSP组的低pH所致。微生物在低pH条件下的活性会大幅降低,同时较低的pH有利于NH+4−N和各种挥发性有机酸在堆体中累积,这些均抑制了堆肥的降解进程[17,23]。
2.2 堆肥过程中氮素的变化
2.2.1 NH3的排放规律
如图2a所示,各试验组NH3的大量排放主要集中在堆肥前15 d,之后几乎检测不到NH3的排放,这与之前的研究结果相一致[7,13],主要是由易降解有机物的强烈降解以及由此产生的高温、高pH和高NH+4含量引起的。之后随着底物的耗尽,氨化作用不断减弱,NH3排放率降低。CK组NH3排放峰值出现在第5 d,达到324.68 g·d−1,而MP、MKP、MSP和MSKP组分别在第8、9、10 d和6 d达到峰值,分别为122.41、103.02、45.14 g·d−1和140.93 g·d−1,较CK减 少 了62.30%、68.27%、86.10%和56.59%,这说明Mg盐和P盐的添加能有效降低NH3排放量并延缓排放高峰。
如图2b所示,15 d之后NH3累积排放量趋于稳定,不再增加。整个堆肥过程中CK组NH3累积排放量为1 832.61 g,而MP、MKP、MSP和MSKP组分别为934.97、990.53、423.07 g和1 124.22 g,相较于CK组分别降低了48.98%、45.95%、76.91%和38.65%。这主要是由于Mg盐和P盐的添加在NH+4存在的条件下发生鸟粪石结晶反应,将游离的NH+4固定为MgNH4PO4·6H2O沉淀下来,进而降低了NH3排放量[16]。MSP组的NH3累积排放量显著低于其他各处理组(P<0.01),其原因主要是较低的pH以NH+4的形式保留了更多的氮,从而降低了NH3的排放[23]。
2.2.2 NH+4−N、NO−3−N及TN的变化
如图3a所示,试验开始后,含氮有机物在氨化细菌作用下不断分解,使得各试验组NH+4−N含量不断升高达到峰值。此后由于NH3的释放以及硝化作用的增强,NH+4−N含量逐渐下降,最终随着堆肥进入腐熟期,NH+4−N含量趋于稳定。堆肥结束后,CK组NH+4−N含量为3.14 g·kg−1,相较于初始含量减少了40.19%;而MP、MKP、MSP和MSKP组分别为5.01、4.43、6.28 g·kg−1和5.72 g·kg−1,相较于初始含量分别增加了37.64%、23.40%、44.03%和29.23%,这说明Mg盐和P盐的添加对氮素起到了良好的固定作用,与此前的研究结果一致[7,23−24]。堆肥第10 d之后,MSP组的NH+4−N含量一直保持在较高水平且显著高于CK组(P<0.001),其原因一方面是由于低pH降低了NH3的排放;另一方面可能是因为低pH抑制了硝化细菌将NH+4−N进一步转化[13,17]。有研究表明,鸟粪石结晶法会显著增加堆肥中NH+4−N的含量,由于本试验使用的2.0 mol·L−1KCl溶液作为NH+4−N提取剂,无法提取鸟粪石晶体中的NH+4,因此在图3a中未观察到明显趋势[7,23]。
如图3b所示,试验开始后0~10 d,各试验组NO−3−N含量仅呈现出缓慢增加的态势,这主要是因为高温和高NH+4−N含量对硝化细菌的生命活动产生了抑制作用[29]。之后随着温度的降低以及大量NH3的释放,硝化细菌活性增强,通过硝化作用将堆体内游离的NH+4−N转化为NO−3−N,因而NO−3−N含量上升[12]。堆肥结束后,MP、MKP、MSP、MSKP处理组和CK组NO−3−N含量相较于初始含量分别增加了269.68%、247.50%、217.61%、272.02%和268.10%,这说明Mg盐和P盐的添加对于堆肥过程中NO−3−N的固定没有明显的促进或抑制效应。MSP组的NO−3−N含量略低于CK组,这可能是由于低pH抑制了硝化作用的转化效率[13,17]。
如图3c所示,试验开始后0~15 d,尽管NH3排放显著,但TN含量仍然逐渐增加,这与此前的研究结果一致,其原因主要是含碳有机物的降解率高于NH3的排放率[30]。此后随着试验的进行,含碳化合物不断降解,使得TN含量持续上升。堆肥结束后,CK组的TN含量为21.53 g·kg−1,相较于初始含量增加了26.87%,而MP、MKP、MSP和MSKP组的TN含量分别为27.84、26.02、22.23 g·kg−1和24.89 g·kg−1,相较于初始含量分别增加了66.31%、54.42%、30.15%和46.50%。各处理组TN含量的升高幅度均大于CK组,其原因主要是Mg盐和P盐的添加与堆肥中的NH+4反应生成了鸟粪石晶体,固定了的氮素[24]。
2.2.3 氮素固定率比较与固氮机制探讨
根据物料守恒与氮素平衡原理[22],计算不同处理蓝藻堆肥过程中氮素损失率与固定率,结果见表2。可以看出NH3释放是氮素损失的主要方式,占比达71.29%~89.35%,与此前的相关研究基本一致[9−11]。通过Mg盐与P盐的添加,堆肥氮素固定率达33.54%~71.09%。
为探讨其固氮机制,采用粉末X射线衍射(XRD)对42 d后的堆肥样品进行分析。如图4所示,将各处理组衍射图谱与CK组衍射图谱以及鸟粪石标准图谱进行比对分析,证实了各组样品中均含有MgNH4PO4·6H2O。根据相关研究[22],在中性和碱性条件下,主要发生以下反应:
随着堆肥的进程,含氮有机物分解产生大量NH+4,从而发生以下反应:
综上所述,堆肥过程中能够形成鸟粪石晶体,但是其反应受pH条件制约。相关研究表明鸟粪石的最佳结晶pH范围为7.5~9[31],因此,低pH可能是导致MSP组图谱出峰强度相较于其他3个处理组典型性较弱的主要原因。由表2可知,MSP组的氮素固定率显著大于其余3个处理组,其原因一方面是低pH抑制了NH+4−N向NH3转化,从而保存了更多的NH+4−N;另一方面是低pH抑制了堆肥反应的进行,堆体内的含氮有机物并未被微生物充分利用,因而显示出较高的氮素固定率。

表2 不同处理蓝藻堆肥过程中氮素损失率及固定率(%)Table 2 Efficiency of nitrogen−loss and inhibiting nitrogen−loss during composting of cyanobacteria in different treatments(%)
2.3 堆肥产品安全性及肥效评价
2.3.1 微囊藻毒素降解效果
微囊藻毒素(Microcystin,MC)是一类具有严重危害性的生物毒素,主要包括MC−LR和MC−RR[21]。虽然好氧堆肥对MC的降解较为明显,但若处理不当可能会造成一定的风险[32]。因此,本试验重点关注了堆肥前后样品中MC的含量及其降解率,结果见表3。
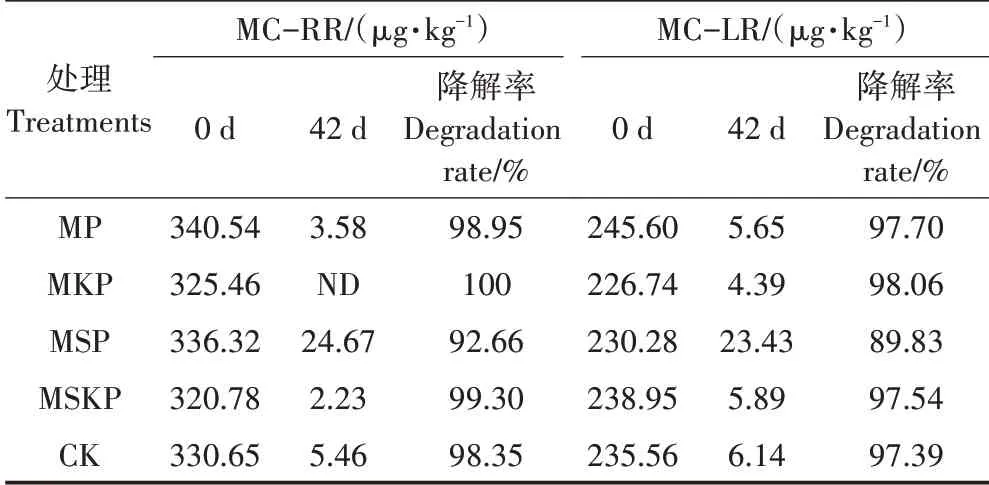
表3 不同处理蓝藻堆肥过程中微囊藻毒素含量的变化Table 3 Changes of microcystin content during composting of cyanobacteria in different treatments
如表3所示,堆肥结束后,MP、MKP、MSKP处理组和CK组的MC含量降解趋势与汪晶晶等[21]的研究结果一致。MP、MKP和MSKP组对MC的降解率均高于CK组,这可能是由于这3种处理延缓了堆肥的降温期,从而获得了较高的降解率。MSP组的MC降解率明显低于CK组,这主要是由于低pH抑制好氧堆肥发酵过程所导致。
2.3.2 肥效评价
有机肥料国家标准(NY 525—2012)中规定了有机肥的技术指标,其中有机质含量(以烘干基计)≥45%,总养分(N+P2O5+K2O)含量(以烘干基计)≥5%。以此标准为对照,堆肥试验结束后MP、MKP、MSP、MSKP处理组和CK组的有机质含量(以烘干基计)分别为47.19%、47.52%、54.92%、48.30%和46.28%,总养分(N+P2O5+K2O)含量(以烘干基计)分别为8.76%、9.70%、7.71%、9.60%和6.62%,均达到了标准要求。
3 结论
(1)MP、MKP和MSKP处理可显著降低堆肥过程中的NH3排放与氮素损失,且堆肥产品均可达腐熟状态。
(2)MSP处理由于其初始pH低而抑制了堆肥的进程,种子发芽指数显示堆肥未能完全腐熟。
(3)综合来看,虽然MKP处理的氮素固定率略低于MP处理,但其具有更高的微囊藻毒素降解率与总养分含量,是蓝藻堆肥工程化应用中理想的固氮方式。
(4)本研究中Mg盐与P盐的添加量是参照畜禽粪便作为堆肥原料的相关研究后确定的,而以蓝藻这一植物性物料为堆肥原料,其更适宜的添加量有待于进一步研究。
