黄羽肉鸡ACSL1 基因多态性与腹脂性状的相关性研究
2021-03-15郎倩倩徐振强张德祥1
郎倩倩,徐振强,张 燕,张德祥1,*
(1.华南农业大学动物科学学院,广东广州 510642;2.广东省农业科学院动物科学研究所,畜禽育种国家重点实验室,农业农村部华南动物营养与饲料重点实验室,广东省动物育种与营养公共实验室,广东省畜禽育种与营养研究重点实验室,广东广州 510640;3.广东温氏南方家禽育种有限公司,广东新兴 527400)
腹脂过度沉积已成为现代肉鸡生产面临的一个严峻问题[1],对黄羽肉鸡腹脂性状的选择方法目前主要有直接选择、间接选择和分子标记辅助选择。研究显示,腹脂重和腹脂率具有较高的遗传力,对其进行直接选择能够取得较为理想的效果[2-3],但直接选择法测定难度大,较难推广应用。间接选择法主要是通过对与腹脂性状相关性较强的其他性状的选择来达到间接选择腹脂的目的,如体尺性状、饲料报酬性状等[4]。
鸡的腹脂沉积是一个复杂的生理过程,与脂肪代谢有关的基因及其在脂肪沉积中的作用研究一直备受关注。在分子水平上挖掘与腹脂性状相关的基因,找到一些分子标记,能为解决腹脂过度沉积问题提供一定依据。经过多年研究,学者们也发现了许多与腹脂性状有关的基因。邵勇钢等[5]研究表明A-FABP基因多态性与拜城油鸡的腹脂性状存在一定的相关性;李耀辉[6]研究发现,BMP6基因的2 个多态位点(g.64475440C>T 和g.64474334G>C)与试验群体的腹脂重存在一定的相关性;薛倩等[7]研究表明甲状腺激素应答蛋白Spot 14(THRSPα)基因中的C129T 和T160G 2 个突变位点与京海黄鸡的腹脂性状相关联(P<0.05 和P<0.01)。以上研究发现的多态位点都能够作为分子标记对腹脂性状进行辅助选择,进而为优质鸡的腹脂选择提供相应的理论依据。
长链酯酰辅酶A 合成酶(ACSLs)是长链脂肪酸通过硫代酯化进而合成酰基辅酶A 衍生物所必需的酶,也是脂肪酸代谢的第一步[8]。哺乳动物ACSL 家族由ACSL1、ACSL3、ACSL4、ACSL5 和ACSL6 组成,其中ACSL1 是主要的异构体之一,主要存在于能量代谢组织中,在骨骼肌、肝脏和脂肪组织中都有表达,可以调节机体的能量代谢[9]。同时,ACSL1在脂肪酸的活化、转运和降解以及脂类生成等过程中也至关重要[10]。有研究报道,ACSL1在心脏和脂肪组织β氧化过程中也发挥关键作用[11]。
综合可知,ACSL1基因在脂类代谢中有着一定的作用[12]。故本研究在前人研究基础上,采用PCR-直接测序技术对黄羽肉鸡ACSL1基因(鸡ACSL1基因位于4 号染色体上,全长37 027 bp,共有23 个外显子)进行遗传多态性分析,选出与腹脂性状相关的SNP 位点,为黄羽肉鸡腹脂性状的分子标记选择提供一定参考。
1 材料与方法
1.1 实验动物 选择1 日龄天露黄鸡N409 品系共500只母鸡,由广东温氏南方家禽育种有限公司提供。鸡群饲养于广东温氏南方家禽育种有限公司肉鸡试验场,地面平养,饲养期105 d。全程按广东温氏南方家禽育种有限公司肉鸡饲养模式进行。1~42 日龄饲喂黄小料,43~49 日龄由黄小料逐步向黄肉料过渡,50~105 日龄饲喂黄肉料。日粮营养水平见表1。饲养过程中淘汰僵鸡、残次鸡,并记录死淘鸡只数量和翅号。
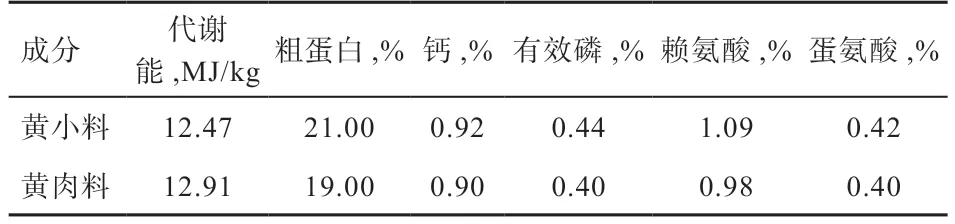
表1 日粮营养成分
1.2 实验试剂 实验试剂包括2×Easy Taq SuperMix,购自北京全式金生物技术有限公司;DEPC 处理水、离心管及枪头购自上海生工生物工程技术服务有限公司;核酸染料,购自上海生工生物技术服务有限公司;DL 2000 DNA Ladder Marker,琼脂糖(Agarose)购自普博生物技术有限公司;E.Z.N.ATM NRBC Blood DNA Kit 购自Omega 公司;无水乙醇购自广州化学试剂厂。
50×TAE Buffer(pH 8.5):称量 242 g Tris,加ddH2O至约800 mL,充分溶解,加4 mL 0.5mol/L EDTA(pH 8.0)和57.1 mL 冰醋酸,加ddH2O 至1 000 mL,贮存于室温。
0.5mol/L EDTA(pH 8.0):称取168.1 g Na2EDTA·2H2O置于1L 的烧杯中;加入约800 mL 去离子水,充分溶解后用NaOH 调节pH 至8.0,然后加去离子水定容至1L 后高压灭菌,室温保存。
1.3 实验仪器 Bio-Rad S1000 PCR 仪购自美国Bio-Rad 公司;Eppendorf 微量移液器,购自德国Eppendorf公司;电子分析天平购自德国Sartorius 公司;Rios 纯水系统购自美国Millipore 公司;高压灭菌锅HV-85 购自HIR AYAMA 公司;微波炉购自广州格兰仕生活电器有限公司;小型高速离心机购自Eppendorf 公司;凝胶电泳仪购自BIO-RAD 公司;4℃冰箱购自SIEMENS 公司;-20℃低温冰箱购自日本SANYO 公司;制冰机购自日本SANYO 公司;一次性注射器购自广州竺祥生物科技有限责任公司;恒温水浴锅购自浙江临海市东方仪器厂;XW-80 型漩涡混合器购自上海第一医学院仪器厂;GDS-8000PC 凝胶成像系统购自美国UVP 公司。
1.4 测定方法 在105 日龄,测定500 只母鸡的体重、体尺性状(胸宽、骨盆宽、体斜长、胫长)。与此同时,用一次性医用1.5 mL 注射器于翅下静脉采血,将采得的1 mL 血样装入放有2%EDTA 的离心管中,与翅号对应,充分摇匀,并于-20℃冰箱中保存。采血完成后,进行屠宰实验,测定全净膛重、腹脂重、皮脂厚。所有指标的屠宰测定方法均根据《家禽生产性能名词术语和度量统计方法》(NY/T 823-2004)执行[12]。
1.5 血样DNA 抽提 根据OMEGA 试剂盒血样DNA提取说明书抽提DNA,并放入-20℃冰箱中保存备用。
1.6 引物设计合成 根据NCBI(https://www.ncbi.nlm.nih.gov/)提供的红色原鸡ACSL1基因的序列(Gene ID:422547),利用Oligo7.0 软件设计多对引物,用于扩增ACSL1基因的外显子区(Exon),并送至北京六合华大基因科技股份有限公司合成引物。引物信息如表2 所示。
1.7 DNA 混池组建以及SNP 位点筛选 选取腹脂重两尾的72 个个体,其中高腹脂的36 个个体随机分成6 组,每组均为高腹脂,低腹脂的36 个个体也随机分成6 组,每组均为低腹脂,总共有12 组混池。
对PCR 产物直接测序以检测每组混池中的SNP 位点。所用试剂为2×Easy Taq SuperMix 和ddH2O,引物信息见表2,40 μL 混池扩增反应体系:2×Easy Taq SuperMix 20 μL、DNA 模板1 μL(50 ng/μL)、上下游引物各0.4 μL(0.1 μmol/L),ddH2O 补充至40 μL。
PCR 反应程序:94℃预变性3 min;94℃变性30 s;退火30 s;72℃延伸Y s(产物长度不同,延伸时间也不同,1 kb/min),36 个循环;72℃再延伸5 min;最后4℃保存,所有扩增反应均在S1000TM Thermal Cycler PCR仪中进行。
将扩增成功的产物送于测序公司进行测序,根据PCR 产物的测序结果,利用DNAStar 中的SeqMAN 程序进行序列和峰图对比,筛选出SNP 位点,选取SNPs较丰富的片段进行SNPs 分型。
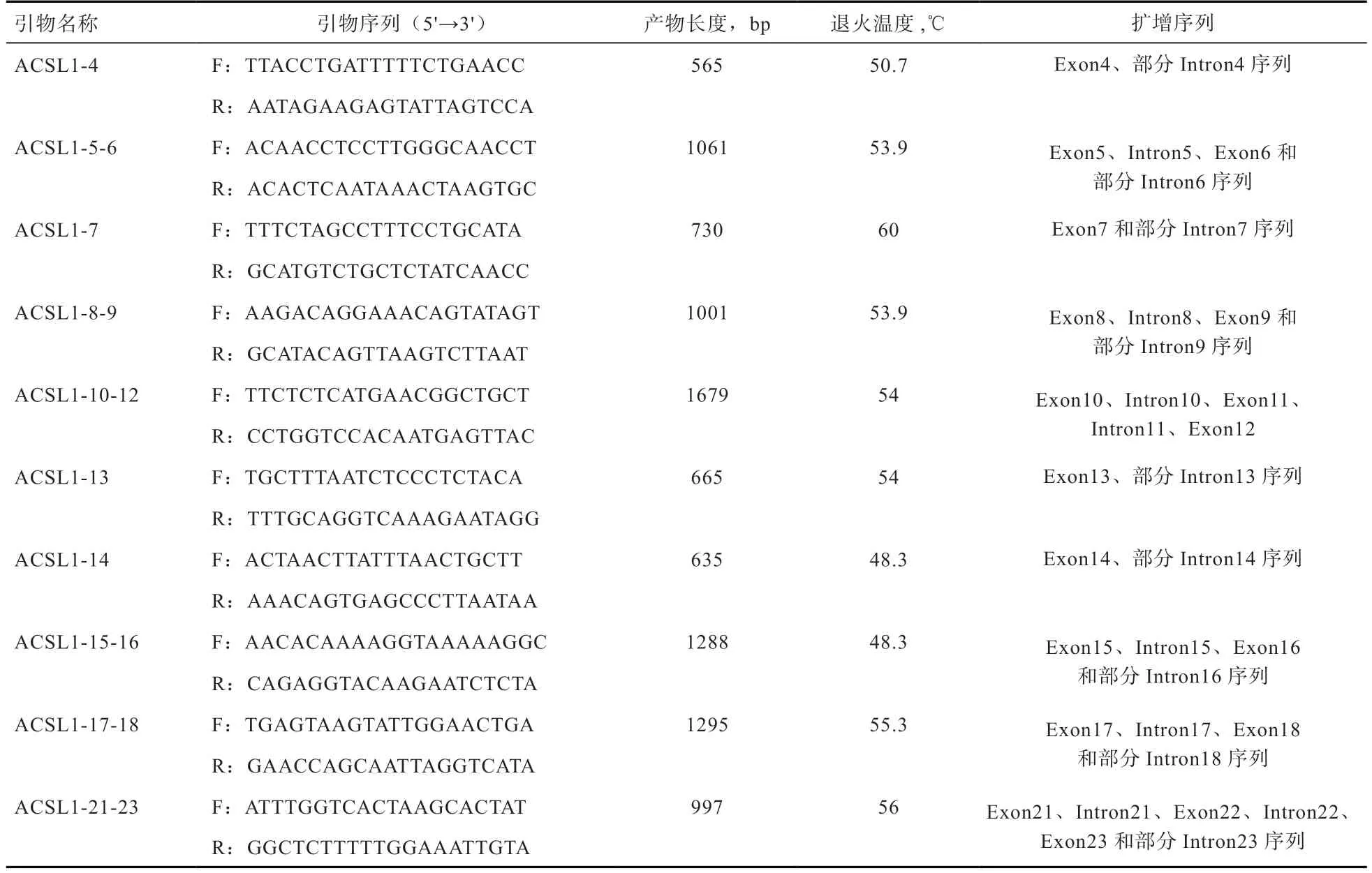
表2 引物信息
1.8 实验群体SNP 位点的分型 根据1.7 的筛查结果,对引物ACSL1-17-18 扩增片段的SNPs 进行全部样品筛查,实验鸡群反应体系与1.7 混池的扩增反应体系相同。
PCR 扩增程序为:94℃预变性3 min;94℃变性30 s;55.3 ℃退火30 s;72 ℃延伸90 s,36 个循环;72℃再延伸5 min;最后4℃保存,所有扩增反应均在S1000TM Thermal Cycler PCR 仪中进行。
将扩增成功的样品送至测序公司进行测序,根据PCR 产物的测序结果,利用DNAStar 软件的SeqMAN程序进行序列和峰图对比,并记录好分型结果。
1.9 基因与基因型频率的计算和哈代-温伯格检验 使用下列公式计算SNP 位点的等位基因频率:

其中,Fi表示SNP 位点等位基因I 的频率,Aii和Aij分别表示各个品种内SNP 位点为纯合(ii)和杂合(ij)的个体数,n 表示某个品种的个体数。哈代-温伯格平衡检验采取卡方检验,使用Excel 软件进行计算。
2 结果与分析
2.1 实验群体基因组抽提结果 对500 只个体的血样全部抽提DNA,所有DNA 经Thermo 核酸仪检验,最终将条带清晰明亮、质量较好,浓度和纯度均达到实验要求的DNA 用于后续实验。
2.2ACSL1基因SNPs 位点的筛选 初筛结果表明,第17~18 外显子区域(1 295 bp)SNPs 位点较丰富,且测序结果较好,易于分型,故对这段区域进行全部样品筛查。最终检测到3 个SNP 突变位点(表3)。
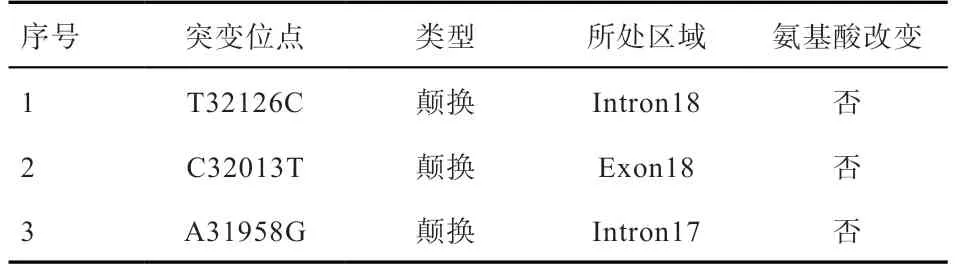
表3 ACSL1 基因SNPs 突变位点
2.3ACSL1基因各位点的哈代-温伯格平衡检验 对T32126C、C32013T、A31958G 这3 个位点进行分型,统计出这3 个SNPs 的基因型数量、等位基因频率,并进行哈代-温伯格平衡检验,结果如表4 所示,3 个SNPs 经检验后的P值都大于0.05,因此其基因频率符合哈代-温伯格平衡,说明该实验群体足够大且满足随机交配,并未发生突变、选择和迁移。

表4 各SNPs 的基因型数、等位基因频率和哈代-温伯格平衡检验
2.4ACSL1基因SNPs 位点与各性状的相关性分析 表5结果显示,A31958G 位点与各个性状都不相关(P>0.05),但GG 型群体的全净膛重显著高于AG 型群体,与AA型群体差异不显著。
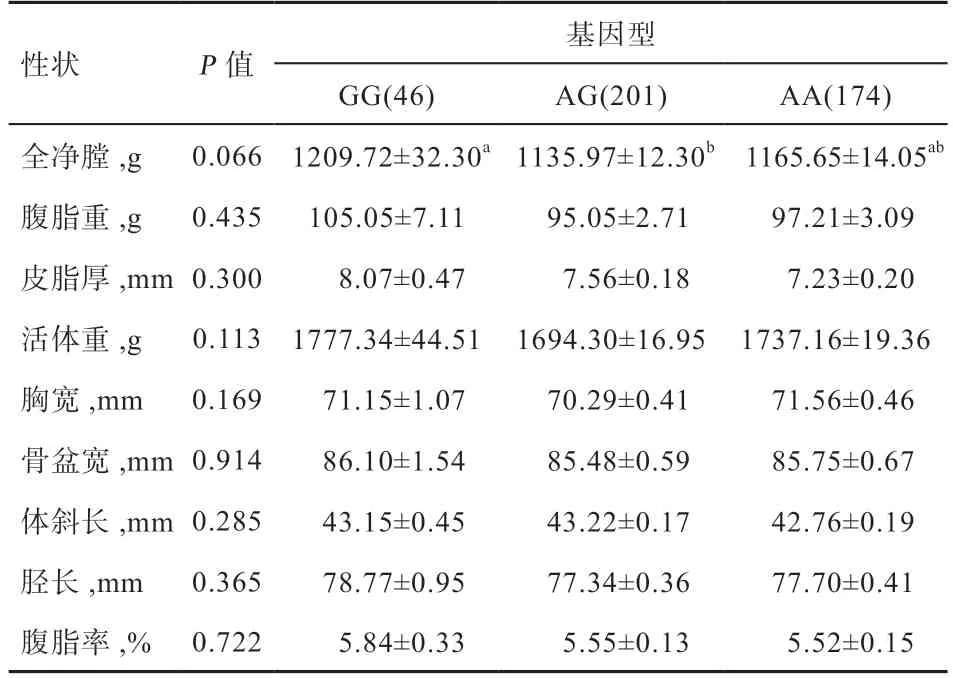
表5 ACSL1 基因A31958G 位点与各性状关联分析
表6 结果显示,T32126C 位点与活体重显著相关,且该位点TC 型群体的活体重显著高于TT 型群体与CC型群体,而TT 型群体与CC 型群体则差异不显著。
由表7 可知,C32013T 位点与腹脂重和腹脂率存在很强的相关性(P<0.01),且该位点TT 型群体的腹脂重与腹脂率都极显著低于TC 型群体与CC 型群体,而TC 型群体与CC 型群体差异不显著。
3 讨 论
本研究以鸡ACSL1基因为研究对象,通过扩增其外显子区域并对其多态性进行研究,最终在第17~18 外显子区域(1 295 bp)检测到了T32126C、C32013T、A31958G 3 个SNP 突变位点。目前ACSL1基因在有关家畜育种中的研究多为基因多态性的检测[13],且在鸡上的研究不多。岳碧娥等[14]通过检测和测序证实ACSL1基因存在的2 个SNP 位点,可作为朗德鹅分子遗传标记位点;本研究发现T32126C 突变位点对实验群体的活体重有一定影响,C32013T 突变位点对实验群体的腹脂重与腹脂率有显著影响,而关于这2 个位点能否作为遗传标记对黄羽肉鸡的活体重与腹脂进行选择,仍有待进一步验证。

表6 ACSL1 基因T32126C 位点与各性状关联分析
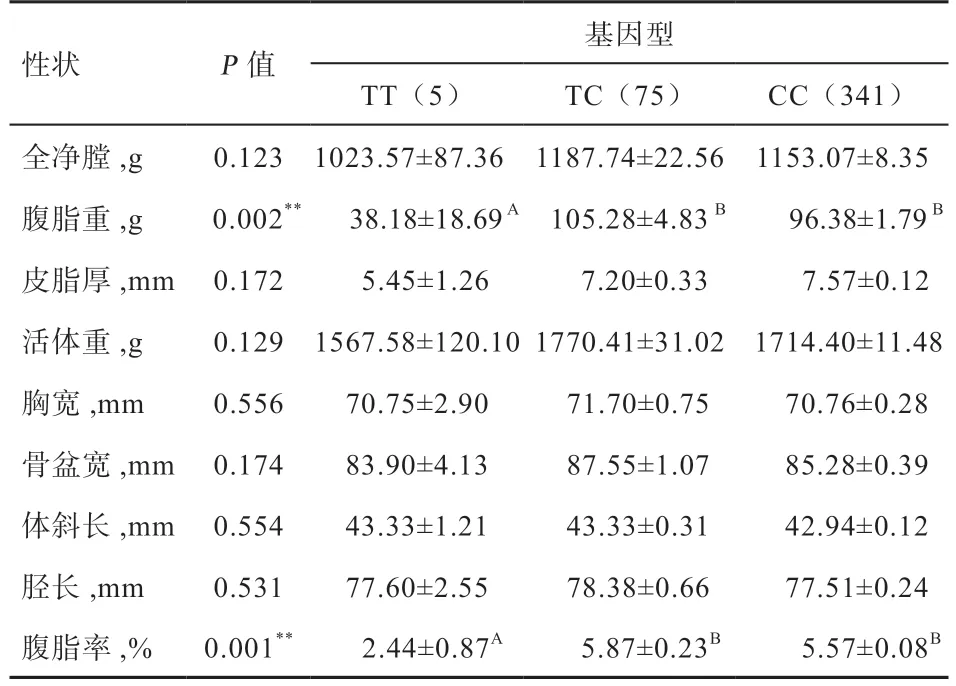
表7 ACSL1 基因C32013T 位点与各性状关联分析
Li 等[15]研究表明ACSL1可能与猪的脂肪沉积能力和肉质有关。Widmann 等[16]研究表明ACSL1基因是牛骨骼肌脂肪酸组成的功能候选基因,且该基因可能在调节牛肉脂质组成中起着重要作用。这些研究结果都表明,ACSL1基因在脂肪代谢中起重要作用,本实验首次发现的C32013T 位点与腹脂重和腹脂率存在很强的相关性,能够为选择低脂的优质鸡提供一定依据。曹阳[17]以绵羊ACSL1基因的序列信息为参考序列,对ACSL1基因多态性检测结果表明,第2 外显子的突变位点对部分脂肪酸及氨基酸含量有影响,而本研究首次发现的C32013T 位点位于ACSL1基因的第18 外显子区域,为同义突变,并未造成氨基酸改变,该突变可能会改变mRNA 的剪切效率或准确性导致基因的转录活性发生变化,进而影响个体性状。
李庆岗等[18]研究发现ACSL1基因的T 等位基因为该大白猪的优势基因,将TT 型个体留作种用能显著减少猪的背膘厚度。本研究发现C32013T 位点中,TT型群体的腹脂重与腹脂率都极显著低于TC 型群体与CC 型群体,而TC 型群体与CC 型群体差异不显著,故将TT 型个体留作种用可能有助于减少黄羽肉鸡的腹脂含量;T32126C 位点则与实验群体的活体重呈显著相关,且该位点TT 型群体与CC 型群体的活体重均显著高于TC 型群体,但TT 型群体与CC 型群体差异不显著,故将TT 型群体与CC 型群体留作种用可能会利于黄羽肉鸡的增重。
4 结 论
本研究发现,黄羽肉鸡ACSL1基因第17~18 外显子区域(1 295bp)SNPs 位点较丰富,T32126C、C32013T、A31958G 这3 个位点的等位基因频率符合哈代-温伯格平衡,且A31958G 突变位点、T32126C 突变位点与腹脂重、腹脂率不相关,C32013T 突变位点对鸡的腹脂重与腹脂率有显著影响。故可以尝试利用C32013T 突变位点对黄羽肉鸡腹脂重进行分子标记辅助选择。另外,鸡ACSL1基因T32126C 突变位点对活体重有显著影响,故该位点也能够尝试作为分子标记用于优质鸡的活体重选择。
