METTL14促进肝纤维化的机制研究
2021-03-15张君佩陈颖沈丹杰刘海玲田怡陈世耀
张君佩 陈颖 沈丹杰 刘海玲 田怡 陈世耀
肝星状细胞(HSC)是肝纤维化的主要效应细胞,当肝脏受到损伤因子刺激时,HSC邻近细胞通过旁分泌作用释放多种细胞因子启动HSC的活化,使其转变为具有增殖性、收缩性和促纤维性的肌成纤维细胞。同时,HSC活化后会分泌大量细胞因子,通过该自分泌途径导致HSC的持续活化以及肝纤维化的持续进展[1]。因此,深入了解HSC活化的分子机制,寻找新的靶点阻断HSC的持续活化是逆转肝纤维化进展的关键。
RNA甲基化修饰(m6A)是真核生物中最普遍的转录后修饰方式,广泛存在于肝脏、肾脏及大脑等多个器官中[2]。与DNA甲基化相似,m6A是一种可逆的动态修饰,受甲基转移酶(METTL3、METTLl4、WTAP等)和去甲基酶(FTO、ALKBH5等)的共同调控[3,4]。METTL14是m6甲基转移酶复合物的重要组分之一,其在体外的甲基化转移能力高于METTL3[5]。研究发现,肝癌样本中的METTLl4水平显著下调,而过表达METTLl4后能够抑制肝癌的转移能力[6]。本研究检测HSC活化后METTLl4的表达水平,进一步研究METTLl4对HSC活化的影响,以阐明METTLl4在肝纤维化中的调节机制。
资料与方法
一、材料与试剂
肝星状细胞系(HSC-T6)购自中国科学院上海细胞库;TGF-β1、Trizol、MTT以及嘌磷霉素购自美国Sigma公司;胎牛血清、DMEM高糖培养基以及青霉素-链霉素(100X)购自美国Gibco公司;RNA PCR Kit (AMV) Ver.3.0以及SYBR Premix ExTaqTM试剂盒购自日本TaKaRa公司;METTL14过表达载体 pGCMV-IRES-EGFP-METTL14以及阴性对照载体pGCMV-IRES-EGFP-NC由上海吉凯基因化学技术有限公司构建;RT-qPCR的引物由上海生物生工有限公司合成;抗-COL I、抗-α-SMA、抗-GAPDH抗体以及二抗购自英国Abcam公司;Trizol、Lipofectamine 2000购自美国Thermo Fisher Scientific公司;其他试剂购自国药集团化学有限公司。
二、细胞培养与活化诱导
HSC-T6细胞培养于含有10%胎牛血清以及1%双抗的DMEM高糖培养基,置于37℃、体积分数为0.05的二氧化碳养箱中传代培养。调整HSC-T6的细胞密度,按1×106浓度接种于6孔板中,细胞贴壁后,将6个孔分为两组,每组作三个平行。TGF-β1组加入2 ng/mL TGF-β1和对照液共培养,24 h后进行相关检测。
三、实时定量PCR
采用Trizol法提取细胞总RNA,根据试剂盒的说明将RNA反转录为cDNA。采用SYBR Premix ExTaqTM试剂盒进行RT-qPCR。GAPDH作为内参,引物序列如下,METTL14正向:5′-AGT GCC GAC AGC ATT GGT G-3′,反向:5′-GGA GCA GAG GTA TCA TAG GAA GC-3′;I型胶原(COL1)正向:5′-GAG GGC CAA GAC GAA GAC ATC-3′,反向:5′-CAG ATC ACG TCA TCG CAC AAC-3′;α-平滑肌动蛋白(α-SMA)正向:5′-AAA AGA CAG CTA CGT GGG TGA-3′,反向:5′-AAA AGA CAG CTA CGT GGG TGA-3′;GAPDH正向:5′-ACA ACT TTG GTA TCG TGG AAG G-3′,反向:GCC ATC ACG CCA CAG TTT C-3′。结果采用荧光定量PCR中的相对定量法,以2-△△Ct表示基因的相对表达水平。
四、细胞转染
按1×106浓度将HSC-T6细胞接种于6孔板,待细胞贴壁后,根据Lipofectamine 2000的操作说明将METTL14的过表达载体(METTL14组)及阴性对照载体(NC组)分别转染至HSC-T6细胞中,48 h后加入2 μg/mL嘌呤霉素筛选细胞,并进行RT-qPCR验证。
五、MTT检测
取对数期METTL14组及NC组的HSC-T6细胞,按照每孔5 000个细胞接种于96孔板中,培养24 h及48 h后,按照MTT试剂盒说明书分别在相应的孔中加入20 μL MTT溶液(5 mg/mL),继续培养4 h。培养完成后,弃去孔内上清液,每孔加入200 μL DMSO,避光震荡10 min,在酶标仪上测定各孔在492 nm处的吸光度值(A)。
六、迁移检测
取对数期METTL14组及NC组的HSC-T6细胞,采用无胎牛血清的DMEM培养基重悬细胞,按照每孔3×104个细胞接种于8 μm的transwell小室的上室,在下室中加入600 μL DMEM完全培养基。24 h后,用棉签擦除上室的细胞,PBS洗两次,然后加入适量0.1%的结晶紫染液处理20min。染色完成后,置于显微镜下拍照、计数。
七、蛋白质印迹分析
取对数期METTL14组及NC组的HSC-T6细胞,接种于6孔板中,细胞融合至80%~90%时,加入含蛋白酶抑制剂和磷酸酶抑制剂的RIPA蛋白裂解液提取细胞总蛋白,并用BCA试剂盒确定蛋白浓度。蛋白变性后取等量的蛋白上样,置于9%SDS-PAGE电泳中分离蛋白。将蛋白转移至PVDF上,加入5%脱脂奶粉,室温封闭2 h。加入一抗(抗-COL I 1∶2000;抗-α-SMA 1∶2000;抗-GAPDH,1∶5000),4℃孵育过夜。次日,加入二抗(1∶3000),室温孵育2 h。采用ECL化学发光试剂盒显色,并拍照。
八、统计学方法
所用统计软件为SPSS 17.0。正态分布的计量数据以均值±标准差表示,两组和两组以上组间比较分别采用非配对t检验和单因素方差分析(one-way ANOVA),P<0.05为差异有统计学意义。
结 果
一、TGF-β1对HSC-T6细胞中METTL14表达的影响
TGF-β1与HSC-T6细胞共培养后,TGF-β1组中METTL14的相对表达水平为(3.78 ± 0.45)高于对照组的(1.00 ± 0.21),差异有统计学意义(P<0.05),表明TGF-β1促进METTL14的表达,METTL14的高表达可能与肝纤维化有密切的关系。
二、METTL14过表达对HSC-T6增殖和迁移的影响
对照组中METTL14的相对表达水平为(1.00 ± 0.18),过表达组中METTL14的表达为(6.04±0.64),差异有统计学意义(P<0.05)。MTT检测过表达组HSC-T6细胞在24 h及48 h的吸光度,结果显示24 h后,过表达METTL14组与对照组的吸光度分别为0.313 ± 0.032,0.264 ± 0.018,差异无统计学意义(P>0.05);48 h后,METTL14过表达组的吸光度为0.730 ± 0.047,高于对照组的(0.533 ± 0.022)差异有统计学意义(P<0.05)。Transwell分析表明,过表达METTL14组HSC-T6的细胞迁移数为186.00 ± 42.75,而对照组仅为97.00 ± 7.00(图1),差异有统计学意义(P<0.05),表明过表达METTL14组的迁移能力显著增强。上述结果表明METTL14能够刺激HSC-T6的增殖与迁移能力。
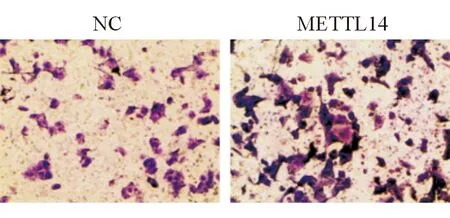
图1 过表达METTL14对HSC-T6迁移能力的影响(×400)
三、METTL14过表达对COL I及α-SMA的影响
METTL14组中COL I的相对表达水平为(2.48 ± 0.31),高于对照组的(1.00 ± 0.26),(P<0.05),α-SMA的相对表达水平为(3.36 ± 0.43)亦高于对照组的(1.00 ± 0.24),(P<0.05)。蛋白质印迹结果进一步证实,METTL14组中的COL I与α-SMA的蛋白水平明显高于对照组(图2),表明METTL14能够促进HSC-T6的活化。
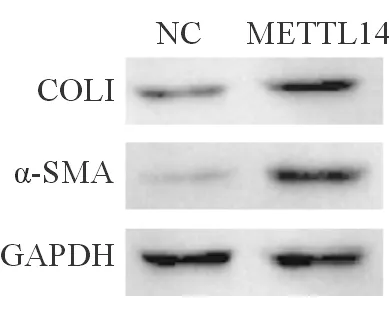
图2 过表达METTL14对HSC-T6中COL I与α-SMA蛋白表达的影响
讨 论
TGF-β1是目前已知很强的促肝纤维化细胞因子[7]。本研究将TGF-β1与HSC-T6共培养诱导其活化,结果显示METTL14的表达显著增加,表明METTL14的上调可能与肝纤维化相关。HSC的增殖与活化是肝纤维化的中心环节[8,9],活化的HSC细胞可分泌过量的ECM如COL Ⅰ与COL Ⅲ以及细胞骨架蛋白α-SMA。本研究显示过表达METTL14后显著促进HSC-T6的增殖,迁移以及COL I与α-SMA的表达合成,表明METTL14的异常高表达是HSC增殖、活化的重要机制。
m6A是真核细胞RNA中丰度最高的修饰方式,参与RNA分子的转录后调控,包括RNA的剪接、输出、定位、降解以及翻译[10-12]。METTL14是m6A修饰所必需的甲基转移酶,可以与METI′L3形成稳定的异二聚体,二者相互协同,共同促进RNA的甲基化修饰[3,5]。m6A甲基化修饰过程是动态可逆的,通过去甲基化酶FTO或ALKBH5的去甲基化作用实现,为METTL14介导的HSC的活化提供了更多的干预靶点。目前关于METTL14调控疾病的分子机制主要集中在肿瘤领域[13,14]。本研究揭示了METTL14在肝纤维化中的重要作用,即高水平的METTL14促进HSC增殖及COL I和α-SMA的表达。
今后应开展体内实验进一步明确METTL14的表达与肝纤维化的关系,以及METTL14修饰差异的核心调控基因及其在肝纤维化中调控作用和机制。本研究证明了METTL14促进HSC的活化是肝纤维化进展的重要机制,为抗纤维化的治疗提供了新的靶点。
