食管癌肿瘤出芽的研究进展
2021-03-15郑羽佳陈东来王文佳王伟桑永华张永胜陈勇兵
郑羽佳 陈东来 王文佳 王伟 桑永华 张永胜 陈勇兵
食管癌一直都是威胁人类健康的主要恶性肿瘤,发病率和病死率分别为全部恶性肿瘤的第六和第五位[1]。食管癌主要分为食管鳞癌和食管腺癌2种组织学类型,我国以食管鳞癌为主。流行病学研究[2]显示,吸烟和饮酒是食管癌的重要危险因素。目前食管癌的治疗方法根据分期早晚而决定,早期主要应用腔镜下黏膜切除或者黏膜剥离术,术后给予必要的放化疗,对于中晚期患者主要采取以手术为主的综合治疗,通常对切除有困难的患者给予术前放化疗,术后必要时再给予放化疗。避免早期食管癌进展以及对中晚期食管癌采取有效的措施可使更多的患者受益[3-6]。因此,如何有效进行食管癌病变分期成为目前需要关注的问题。目前组织形态学分析仍是对恶行肿瘤分期的重要手段。肿瘤出芽(tumor budding,TB)作为一种存在于多种恶性肿瘤中的病理现象,已展示出其潜在的预后预测价值。因此,研究TB的发生、分级及其对食管癌的预后影响具有重要的临床病理意义。
一、TB及其病理过程
TB是可在多种癌症中见到的一种病理学现象,对于TB的定义目前仍有争议,被广泛接受的定义是:TB指显微镜下所见的肿瘤浸润前沿间质内散在的呈未分化形态的肿瘤细胞群,这种细胞群往往呈单个肿瘤细胞或小于5个细胞的小灶状(图1)。TB并非一个静态的过程,而被视作肿瘤转移的动态过程[3]。肿瘤转移最重要的过程是上皮-间质转化(epithelial-mesenchymal transition,EMT)。EMT的异常激活被认为是肿瘤转移的标志,其上皮细胞失去细胞间黏附,并获得间质细胞典型的迁移和侵袭性特征。多种肿瘤研究表明,TB中有上皮标志物(如E-钙黏蛋白)的下调和间质标志物(如波形蛋白)的上调,因此,提出了一种观念,即TB是EMT的形态表达[7]。Niwa等[8]检查了78例食管鳞癌患者手术标本的EMT状态,发现TB高级别组和间质表型相关,低级别组和上皮表型相关,表明在食管癌中,肿瘤EMT状态与TB明显相关(P=0.009)。然而,越来越多的研究发现,TB中的EMT过程并不完整,只经历了部分EMT,表现为杂种单细胞E/M表型。
二、TB的分子机制
TB被认为是EMT的形态表达,而EMT的发生受多种生长因子调控,如转化生长因子﹑肝细胞生长因子﹑表皮生长因子等,这些生长因子可与酪氨酸激酶受体结合,经过不同的信号通路,影响细胞黏附分子的功能,进而促进肿瘤细胞的侵袭[9-10]。Jensen等[11]的研究证实了TB和EMT分子表达的一致性,表明TB中富集激活的TGF-β信号及与EMT-TF(ZEB1,PRRX1)的表达增加和METTF(OVOL1,KLF和GRHLs)的表达减少有关。在一项对T1期食管鳞癌的研究中,发现E-钙黏蛋白和TB密切相关(P=0.04)[12]。此外,Jass等[13]研究发现,TB显示出β-连环蛋白和p16的表达增加,p16表达和WNT途径的破环是TB的先决条件。说明TB不仅仅是由于肿瘤边缘的宿主免疫反应引起的结构破坏的结果,更是基因控制下的动态过程。另有研究显示,TB与趋化因子配体相关,TB经过CXCL12染色后,更容易辨认,且CXCL12可以调控肿瘤增殖和转移[14]。现关于TB的分子生物学研究多基于大肠癌,与食管癌相关的研究较少,这值得研究者的关注。
三、TB的计数与分级方法
TB的细胞和细胞核异型性较大,细胞质嗜酸性,因此在HE染色下即可观察到。国际肿瘤出芽共识会议(International Tumor Budding Consensus Conference,ITBCC)指出,TB的评估主要基于HE染色,而非细胞角蛋白免疫组织化学染色(immunohistochemistry,IHC)[15]。一项荟萃分析表明,通过HE计数TB和IHC间没有实质性的差异,会议目前建议仍用HE染色计数TB[15-16]。但是一些研究发现,IHC在可重复性和观察者之间的一致性方面优于HE[17-18],此外TB可能被肿瘤周围的炎症反应掩盖,无法用HE染色鉴别,而此时IHC可以更好地显示肿瘤内出芽。尽管之前大多数TB计数都基于HE染色,但近年来,为了减少TB计数的错误,很多研究都应用了IHC的方法。
最开始的研究并没有明确地对TB进行分级,后来Ueno等[19]提出了两种对TB分级的方法,选择TB最密集的区域,一种根据TB的数量(<5,5~9,10~19和≥20,×25视野,即0.385 mm2区域)分为4组,另一种根据TB的数量(<10 和≥10,×25视野,即0.385 mm2区域)分为2组。在此基础上,ITBCC确定了TB的标准判定方法,即低级别为0~4个出芽,中级别为5~9个出芽,高级别为10个及以上出芽[9]。然而,大多数的食管癌研究都采用了改良的Ueno方法,选择TB最密集的区域(×20视野)计数,<5的出芽数为低级别,≥5的出芽数为高级别[6]。
四、TB与食管癌治疗决策
目前食管癌患者的治疗决策主要由临床TNM分期和患者的临床症状决定,而分期是基于影像学数据进行的,这与病理分期相比,具有过度或分期不足的风险。目前,很少有研究去探讨TB对于食管癌术前活检标本的重要性及其对治疗决策的影响。Jesinghaus等[20]基于TB和细胞巢大小建立了一个改进的分级系统,称为“细胞分离度”(Cellular Dissociation Grading,CDG)。还对术前活检标本的CDG及肿物切除术后的临床分期进行了队列研究,发现较差的CDG与更高的临床T分期和淋巴结转移密切相关(P<0.001)。该研究显示,一个独立于临床分期的可以预测食管癌浸润深度和淋巴结转移的有效参数,可以用于治疗前活检及肿物切除,为临床治疗前决策(如初次切除术及新辅助放化疗)提供新的有力的参考。另外,有研究[21]表明TB可作为预测淋巴结转移的独立预后因素,这在浅表食管癌中十分重要。这种风险评估可作为治疗决策的主要决定因素,治疗范围可从对低风险肿瘤进行内窥镜下切除术到对高风险转移者进行新辅助放化疗后再行食管切除术。同时,Jesinghaus等[22]还基于CDG,对接受新辅助化疗后的术后标本进行研究,发现CDG仍是独立预后因素,提示CDG能进一步对接受了新辅助化疗的患者进行预后分层,即使患者对新辅助治疗表现出良好的初始反应。缺乏预测因素导致无法在进行或未进行新辅助治疗的患者中选择最佳的辅助治疗,而CDG正是能够与病理、临床分期相结合的具有潜力作为新辅助化疗后的预测指标,帮助决策最佳治疗方案。
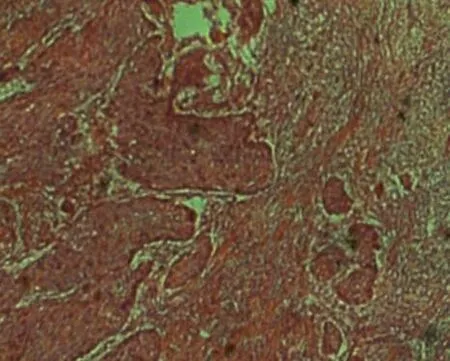
图1 食管癌的肿瘤出芽现象(HE,×40)
五、TB与食管癌淋巴结转移
此前,研究[3]表明,TB和大肠癌淋巴结转移密切相关,是淋巴结转移的新的危险因素。以此推论,TB和食管癌淋巴结转移也可能具有相关性。Landau等[21]分析了210位pT1期的食管腺癌患者,高级别TB患者有41%出现了淋巴结转移,而低级别TB患者只有15%出现,没有TB的患者只有10%出现了淋巴结转移。该研究表明广泛的TB是浅表食管腺癌淋巴结转移的独立危险因素,浅表食管腺癌应将TB作为预后评估的一部分。最近,Fuchinoue等[23]研究了50例浅表食管鳞癌的患者,使用HE染色和IHC两组计数TB的方法,均证明了TB和浅表食管鳞癌的淋巴结转移相关(P<0.001),并指出TB可能是淋巴结转移的原因。
六、TB与食管癌预后
很多研究都表明了TB和食管癌的不良预后有关,表1总结了近20年来TB和食管癌预后关系的相关研究。Roh等[24]最早研究了56例食管鳞癌患者,其中低级别TB患者22例(36.9%),高级别TB患者34例(60.7%),随访发现低级别组的3年生存率明显高于高级别组。该研究表明TB可能是高度恶性潜能的病理表现,会降低食管鳞癌患者的生存率。之后,Koike等[25]研究了136例食管鳞癌,也表明了低级别组的3年和5年生存率明显高于高级别组。因此,TB可被视为肿瘤转移的第一步,能反应病灶内肿瘤的侵袭性,并可辅助推断患者是否可以受益于当前的治疗。一项关于接受新辅助化疗后的食管鳞癌患者预后的研究发现即使在接受了新辅助化疗后,存在高级别TB的患者5年生存率仍然较低,是食管鳞癌的不良预后因素。在接受新辅助化疗之后再次进行TB的评估,可以给后续是否需要行其他辅助治疗提供一个有效的信息。Nakanishi等[28]研究发现,高级别TB与较大的肿瘤直径﹑淋巴结转移﹑血管浸润等不良预后因素有关,且无病生存期明显短于低级别TB组。因此,可以将TB作为判断预后的因素之一,但是也要注意低级别TB与晚期复发相关,尤其是pT2和pT3的患者中。
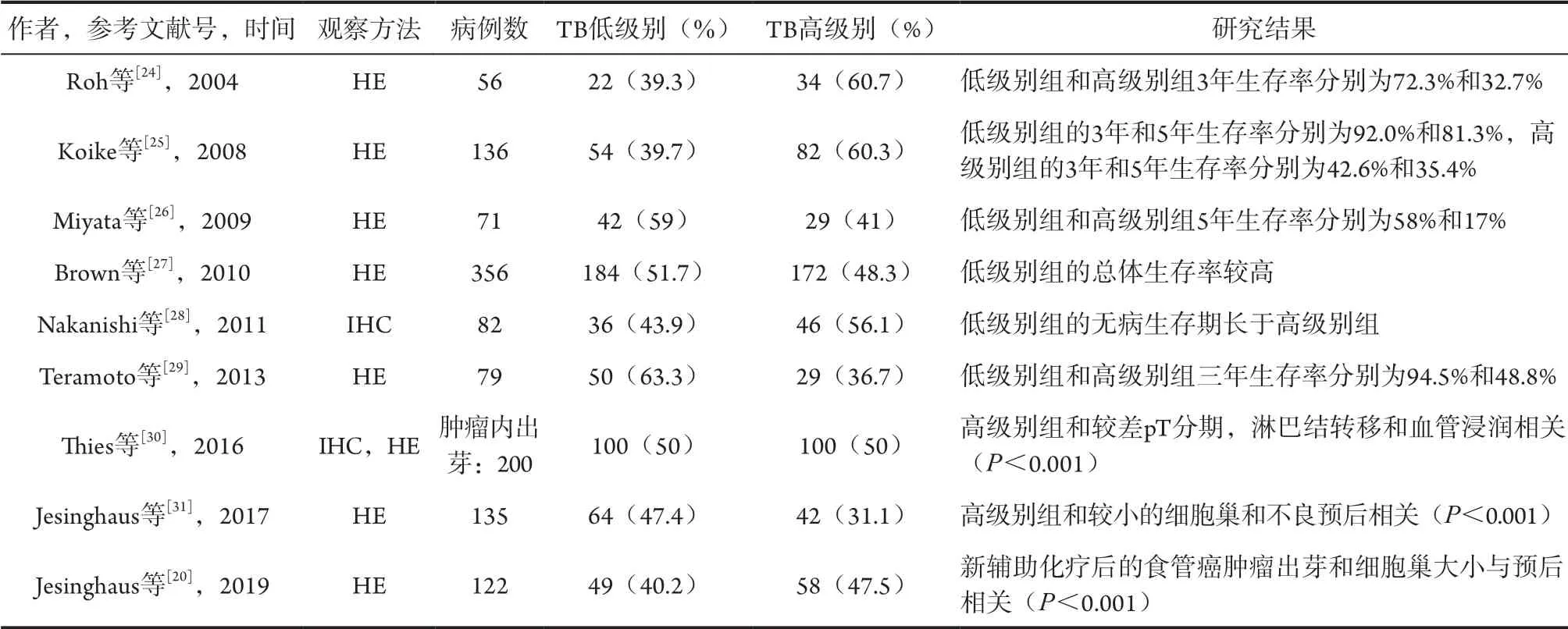
表1 近年来TB和食管癌预后的关系
有一项研究选取了79例pT1期的食管鳞癌患者,50例为低级别TB,29例为高级别TB,低级别组的3年总体生存率明显高于高级别组(94.5% vs. 48.8%,P<0.001)[29]。通过多因素分析表明TB是食管鳞癌的独立预后因素,还提出可以将TB作为食管癌切除手术和内镜黏膜切除术(endoscopic mucosal resection,EMR)标本的常规病理检查。
大多数研究均探讨TB在食管鳞癌中的意义,值得一提的是,Thies等[30]研究食管腺癌的TB,并将TB分为肿瘤内出芽和肿瘤周围出芽。该研究表明较高的肿瘤内出芽与较差的总体生存率相关 (P=0.029),且在pT1亚组分析中,肿瘤内出芽也与较差预后相关(P=0.038),而肿瘤周围出芽对患者预后没有显著影响(P=0.385)。因此,TB可用于早期食管癌活检标本的病理学诊断中,为预测肿瘤预后提供了新的参考。
七、结语
TB可以预测食管癌患者的预后,且与食管癌治疗前分期﹑淋巴结转移﹑血管浸润等密切相关,高级别TB提示较差的预后[32]。可考虑将TB纳入常规病理检测以及TNM分期中,但仍有大量问题有待研究。首先,TB的分子病理学特征仍未明确,与部分EMT过程尤其是杂种单细胞E/M表型的相关性有待进一步考证;在高通量测序技术飞速发展的今天,学界对TB阳性病灶内肿瘤的突变频谱等信息仍所知甚少。其次,TB的分级大多基于Ueno的方法进行改良,缺乏统一标准,且关于应用HE染色还是IHC未有定论,有待研究进一步统一标准[6]。此外,切除术式和切缘距离是否会影响存在TB的接受外科手术的食管癌患者预后仍亟待研究。最后,有关TB在接受新辅助化疗及术后放化疗患者中预后意义的研究尚显匮乏,需更多的临床研究深化认识。希望随着越来越多的学者对TB现象的重视和研究,TB的评估可以早日被应用,这对食管癌及其他肿瘤的治疗及预后判断都有重要的意义。
