miRNA在肺癌中的作用机制及潜在临床意义
2021-03-15王琳瑶薛逢来史晓舜沈建飞
王琳瑶 薛逢来 史晓舜 沈建飞
肺癌高居全球癌症病死率之首,已成为发达国家和发展中国家的男性病死率最高的恶性肿瘤,且已超过乳腺癌,成为发达国家女性病死率最高的恶性肿瘤。肺癌在病理学上分为非小细胞肺癌(non-small cell lung cancer,NSCLC;85%)和小细胞肺癌(small cell lung cancer,SCLC;14%)两大类型,NSCLC进一步分为鳞状细胞癌(squamous cell carcinoma,SCC;30%)、腺癌(adenocarcinoma,AC;50%)和大细胞癌(large cell cancer,LCC;10%)[1]。尽管免疫治疗及靶向治疗显著提高了肺癌患者5年的生存率,但生存率仍然很低。诊断较晚、治疗方法有限、获得性耐药及复发是肺癌患者预后不良的主要原因。近年来,miRNA失调已被证实是肿瘤发生、发展的一个重要因素或机制,它通过恶性细胞、非恶性基质细胞和肿瘤微环境中非细胞成分之间的相互作用影响肿瘤增殖、血管新生、转移和获得性耐 药[2-3]。因此,研究miRNA与肺癌的关系已成为目前的研究热点,且已在很大程度上弥补了对肺癌发病机制认识上的不足。
1993年在对线虫的研究中首次发现miRNA,即lin-4和let-7。它们是由20~24个小核苷酸所组成的内源性非编码RNA,相对稳定、体积小,且具有高度保守性,这与其功能的重要性有密切的关系[4]。miRNA可以识别并结合在mRNA的3'非编码区(UTR)中的互补位点,从而通过降解或翻译mRNA抑制导致转录后基因沉默。完全性互补通过剪切和降解mRNA导致转录抑制,不完全互补或有限碱基对导致翻译抑制[5]。此后又证实miRNA与靶基因的密切联系,甚至几个miRNA也可以精确调控同一个靶基因。另外,miRNA还与蛋白质形成微小核糖核蛋白复合体(microRNA ribonucleoprotein complex,miRNP),这也可导致基因激活,并与mRNA的5'UTR和开放阅读框架(open reading frame,ORF)相结合,影响翻译的激活。目前,已明确miRNA在真核生物中的重要功能有调控转录、参与mRNA选择性剪接、参与mRNA的稳定和翻译调控过程以及影响蛋白质的稳定和转运[6]。据推测,miRNA调节人类约三分之一的基因,这种对基因表达的显著调控作用是miRNA区别于其他RNA的独立特征,并有望成为新的肿瘤生物标志物和潜在的治疗靶点[7]。
一、miRNA的生物合成
miRNA生物合成的第一步是通过微处理器复合物处理初级的pri-miRNA,pri-miRNA由RNA结合蛋白DGCR8和III型RNA水解酶DROSHA组成。此初始事件需要通过DGCR8识别pri-miRNA发夹的茎与侧翼单链RNA(ssRNA)之间的连接,然后募集DROSHA,切割RNA双链体以产生premiRNA产物[8]。新合成的pre-miRNA通过exportin-5(输出蛋白5)或者RNAGTP转运到细胞质。在组装miRNP的过程中,RNA螺旋酶提取了两条双链miRNA,仅有一条单链进入miRNP,而另一条链则被降解。加工完成后,单链miRNA通过与Argonaute(Ago)蛋白结合形成RNA诱导的沉默复合物(RNA-induced silencing complex,RISC)并靶向mRNA的3'UTR,导致mRNA降解、翻译减少或脱腺苷化[9],从而降低微调蛋白的表达影响生物学功能。据文献报道,miRNA-622首先与RISC结合形成RISC-miRNA-622复合物,再互补配对结合到靶mRNA的3'非翻译区,调控下游靶蛋白的表达,从而参与细胞的生长、增殖、分化及凋亡等 过程[10]。

图1 miRNA与肺癌的关系
二、miRNA表达与肺癌发生
研究[11]表明,miRNA与肺癌,尤其是NSCLC的发生密切相关。如在NSCLC组织中miRNA-30a-5p、miRNA-486-5p和miRNA-126-3p下调,而miRNA-205-5和miRNA-210-3p上调,其中miR-30a-5p与miR-210-3p具有高度敏感性和特异性,可为区分癌组织与非癌组织进一步提供依据[12](图1)。此外,miRNA-210-3p在鉴别AC与其他病理类型的肺癌方面显示出较高的准确性[13]。一些研究还证实miRNA-92b、miRNA-146a、miRNA-375、miRNA-1224和miRNA-1246在SCLC中高表达[14],而miRNA-27a-5p和miRNA-34b-3p则在SCLC中低 表达[15]。
类癌是一类罕见的肺癌,曾有小样本研究[16]显示let-7b-5p在大多数肺类癌患者中呈过表达。
肺癌中许多原癌基因与miRNA所参与调控表达的联系十分密切,具体表现为一种或多种miRNA表达水平的下调或上调通过靶向原癌基因的信号转导通路而影响肿瘤的发生及发展[17]。例如作为NSCLC的抑癌基因,miRNA-223可通过靶向EGFR调控PI3K/AKT途径[18](表1);miRNA-199b可靶向抑制ERK和Akt信号通路相关基因,抑制K-Ras突变NSCLC的生长和转移[19];miRNA-449a通过抑制MAP2K1降低NSCLC细胞的侵袭性等[20]。
肺癌发生的另一个重要因素是抑癌基因的失活,目前已证实大多数NSCLC和SCLC存在p53抑癌基因失活[22](表2),Takahashi等[23]发现45%的NSCLC中存在p53突变,而在SCLC中73.3%存在p53突变,一些miRNA可直接结合p53 mRNA的3'UTR抑制p53翻译[24],如miRNA-675-5p、miRNA-449a、miRNA-200a、miRNA-141和miRNA-429等。同时,miRNA也可通过抑制p53拮抗物以增强p53蛋白的稳定性和功能,如miRNA-149-3p和miRNA-4270[25-26,30-31]。少数NSCLC和几乎所有的SCLC存在另一种重要抑癌基因Rb的失活,如miRNA-17-92在SCLC中高表达,以抵消RB失活导致的DNA损伤[27]。另外,肺癌中LKB1基因突变可调节肿瘤细胞的分化和迁移[28],例如miRNA-451可通过调节LKB1/AMPK抑制NSCLC细胞的增殖和迁移[21],miRNA-93通过抑制LKB1/PTEN/CDKN1A激活PI3K/AKT途径,促进NSCLC的发生和转移,miRNA-150-5p可通过抑制LKB1促进NSCLC发生和发展[29,32]。miRNA-208a的过表达通过p21促进NSCLC细胞中AKT/mTOR的激活,从而促进癌细胞增殖[33],miRNA-221-3p的过表达降低了p27的表达并促进了NSCLC癌细胞周期从G1到S期的发展[34]。
因此,miRNA几乎全程参与了肺癌的发生和发展,这种调控作用体现在各型肺癌的细胞分子水平上。
三、肺癌中miRNA调控异常的机制
成熟miRNA在肺癌中的调控异常与癌细胞生长、侵袭及迁移密切相关,而这种调控异常的主要原因包括表观遗传修饰的改变、表观遗传缺失、基因缺陷以及转录抑制等[35]。
表观遗传修饰的改变通常为广泛的基因组DNA启动子低甲基化,这可导致突变的致癌性miRNA的表达。与相应基因组低甲基化相关的14q32 miRNA的过表达促进肺癌的转移,其中的miRNA-487a-3p、miRNA-323b-3p和miRNA-539-5p显著促进了侵袭性表型[36]。另外,启动子低甲基化与miRNA-130b表达的升高明显关联[37]。另一种表观遗传修饰的改变为DNA启动子的高甲基化,可导致抑制肿瘤的miRNA表达下调,例如,具有抑癌作用的miRNA-137就因DNA启动子的高甲基化而在肺癌中被下调[38](图2)。
表观遗传缺失具体表现为组蛋白甲基化缺失和组蛋白乙酰化缺失,二者可分别使突变的致癌性miRNA表达及抑癌性miRNA表达下调[39]。

表1 抑癌miRNA及其靶基因

表2 致癌miRNA及其靶基因
肺癌中miRNA的调控异常与基因缺陷也有重要关系,其中最常见的就是p53在NSCLC中的表达或功能缺失,并且使下游效应因子缺失。miRNA通过直接靶向p53来调节其水平和功能,如miRNA-183-5p、miRNA-675高表达可以抑制p53而促进机体NSCLC的转移及生长[40-41]。Drosha和Dicer是miRNA生物发生的两大关键酶[42],而p53通过Drosha加工复合体的相互作用,对miRNA的生物加工发挥了调控作用:在早期NSCLC患者血浆中miRNA-27a、miRNA-31和miRNA-182呈高表达是由于p53突变干扰Drosha加工机制[43](图2)。
肺癌细胞中miRNA调控异常与转录抑制的关系具体与c-Myc这种原癌基因相关:c-Myc是miRNA-17-92簇激活剂,它与启动子结合后导致多种抑癌miRNA的表达缺失,或上调致癌miRNA的表达。研究表明c-Myc/miRNA-150/EPG5介导的自噬功能障碍促进了NSCLC的发展[44],其穿梭在肺癌衍生的细胞外囊泡中可诱导癌基因miRNA-19b和miRNA-92a表达的上调[45]。另外,c-Myc还可直接作为一些miRNA的靶基因,例如miRNA-449c靶向c-Myc可抑制NSCLC细胞进程[46](图2)。
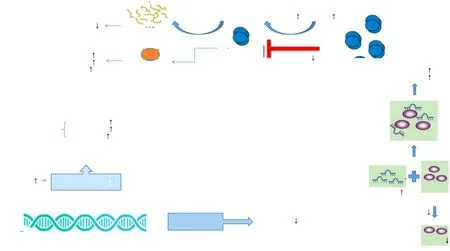
图2 miRNA在肺癌中调控异常的机制
四、miRNA在肺癌的有氧糖酵解中的作用
肺癌细胞与正常组织细胞代谢的最大不同之处在于癌细胞的有氧糖酵解特性。癌细胞中约有一半的ATP是通过糖酵解途径合成的,即便是在有氧环境中,癌细胞仍然偏好通过糖酵解途径提供能量并生成乳酸,这被称为瓦伯格效应(Warburg effect)。这种效应既可提高癌细胞对缺氧的耐受性又可分解破坏癌细胞周围的细胞基质,以促进肿瘤细胞迁移[47-48]。新兴研究[49]表明,miRNA可以通过直接调节主要糖酵解酶的表达或间接调节致癌或抑癌信号通路来影响癌症代谢。
肺癌细胞的有氧糖酵解特性需优先增强特定同型糖酵解酶的表达,这些酶包括葡萄糖转运蛋白(glucose transporter type 1,GLUT1)、己糖激酶(hexokinase 2,HK2)、磷酸果糖激酶(phosphofructokinase,PFK)、磷酸葡萄糖变位1(phosphoglucomutase,PGM1)、磷酸甘油酸激酶1(phosphoglycerate kinase 1,PGK1)、丙酮酸激酶同工酶M2(pyruvate kinase M2,PKM2)、蛋白激酶B(protein kinase B,PKB)、磷酸酯酶与张力蛋白同源物(phosphatase and tensin homology deleted on chromosome ten,PTEN)、磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)、乳酸脱氢酶(lactate dehydrogenase,LDH)等。这些糖酵解酶可调节一些针对它们自身的mRNA降解的miRNA[50]。如在缺氧条件下,miRNA-210-3p靶向三羧酸循环中的琥珀酸脱氢酶(Succinate dehydrogenase,SDHD),以调节线粒体代谢和缺氧诱导因子(hypoxia inducible factor-1,HIF-1)的活性并增强糖酵解[51]。下调的miRNA-144-5p通过靶向GLUT1的表达,增强了肺癌细胞的葡萄糖代谢(图3)。miRNA-320a低表达与PFKm的升高有关,miRNA-26-5p靶向PTEN并触发PI3K/AKT/mTOR通路,影响肿瘤细胞的增殖和 代谢[52]。此外,与对放射敏感的肺癌细胞相比,获得性放射抵抗的NSCLC细胞miRNA-133b表达显著下调,靶向PKM2的表达升高,导致糖酵解率升 高[53]。miRNA-377-5p通过靶向AKT1信号转导可抑制肺癌细胞增殖[54]。miRNA-22-3p靶向ENO1促进了腺癌糖酵解和肿瘤的进展[55]。另外,miRNA-23a-3p还可靶向PTEN以抑制NSCLC的增殖和侵袭[56]。下调miRNA-214抑制HK2和PKM2来抑制NSCLC细胞的增殖和糖酵解,miRNA-133b过表达可通过下调PKM2抑制肺癌干细胞的生长和增殖[57-58]。
五、肺癌细胞中的PD-L1和miRNA
目前公认的恶性肿瘤的发生和发展的一项重要因素是其可逃避免疫监测。癌细胞可以通过多种方式扭曲宿主的免疫检查点,以此逃避免疫系统的排斥。现研究较为明确的是调控肿瘤微环境中早期T细胞活性、程序性死亡受体1(programmed death-ligand 1,PD-1)及程序性死亡受体配体PD-L1和PD-L2[59]。PD-1/PD-L1信号通路主要通过降低T淋巴细胞活化、抑制T淋巴细胞增殖和诱导特异性T细胞凋亡而发挥负性调节的作用。PD-L1是在免疫反应中T细胞表面表达的免疫检查点的抑制剂,其与存在于淋巴细胞上的PD-1相互结合使细胞毒性T细胞(cytotoxic T lymphocyte,CTL)抑制细胞因子和蛋白水解酶的分离[60]。癌细胞能表达PD-L1,引起免疫细胞功能障碍和凋亡,并且还能与B细胞、自然杀伤性T细胞以及树突状细胞上表达的PD-1结合,以抑制抗癌免疫力[61]。研究[62-64]已证实PD-L1的表达受信号通路、转录因子和表观遗传因子的调控,诸如miRNA-513、miRNA-197、miRNA-34a等miRNA在许多恶性肿瘤中负调控PD-L1(图4)。
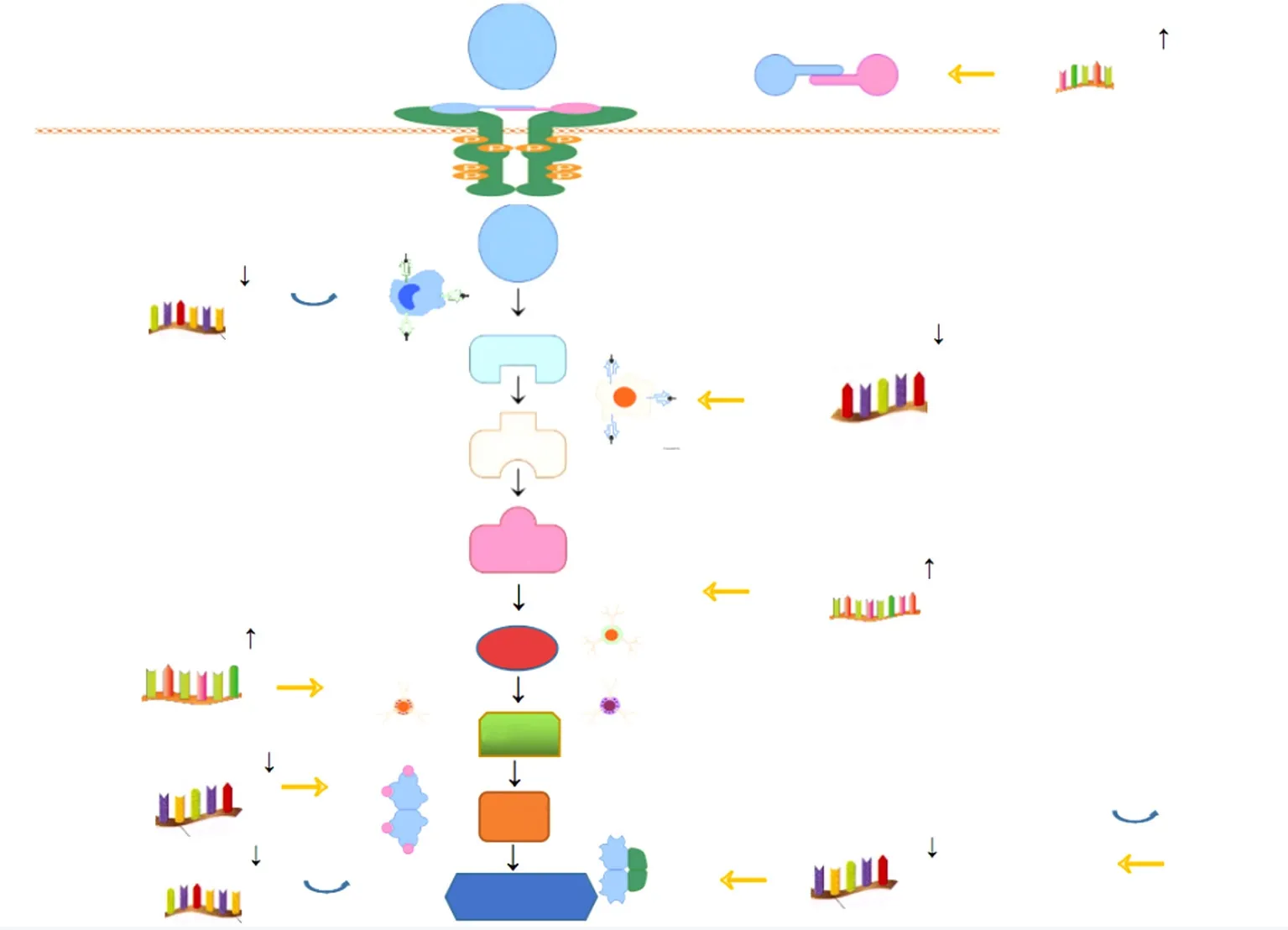
图3 miRNA调节肺癌糖酵酶的示意图
临床上通过控制PD-L1表达和细胞增殖的分子提高治疗的疗效[65-66]。研究表明,miRNA-197介导的CKS1B/STAT3轴可通过多种致癌基因(Bcl-2、c-Myc和cyclin D1)调控肿瘤进展,驱动肿瘤PD-L1的表达,且miRNA-197模拟物可使PD-L1耐药细胞对化疗敏感[64],miRNA-197-5p与PD-L1表达呈负相关,并与NSCLC患者的短生存期相关。此外,miRNA-33a-5p在腺癌中高表达且预后良好,这与PD-1、PD-L1、CTLA-4表达降低有关[67]。
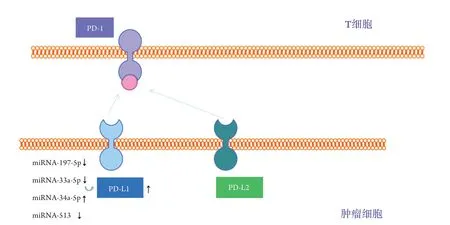
图4 miRNA调控PD-L1表达及免疫检查点阻断的示意图
六、肺癌诊断与监测的新工具:miRNA作为生物标志物
随着生物技术的发展,临床肿瘤诊断及预后监测愈发受益于肿瘤分子标志物的发展及其检测技术的不断完善。现已发现miRNA在人体血清、血浆和痰液等体液中大量存在并稳定表达,而且肿瘤患者外周血miRNA的检测已成为热点[68]。
一项包括中国人等亚裔患者在内的研究结果中,揭示了5组用于检测早期NSCLC的miRNA血清测试,并验证了其在多个患者队列中的表现。如let-7a-5p和miRNA-375可抑制肿瘤的活性,其在肺癌患者血清中表达也较低,是肺癌的预后生物标志物。而miRNA-1-3p、miRNA-214-3p呈高表达,miRNA-1-3p具有致癌活性,miR-214-3p可能是致癌因素[69]。此外,miRNA-145、miRNA-145-5p和miRNA-145-3p在肺鳞癌中作为抗肿瘤miRNA而发挥重要作用,其中miRNA-145-5p在早期NSCLC的检测中被证明是可靠的生物标志 物[70]。miRNA-19b-3p、miRNA-221-3p、miRNA-409-3p、miRNA-425-5p、miRNA-584-5p以及miRNA-21-5p被确定为诊断腺癌的潜在生物标志物[71]。miRNA-126-5p靶向抑制NSCLC中的MDH1活性,显示miR-126-5p在NSCLC的诸多miRNA中的组织学特异性[72],可作为区分NSCLC与转移性肺癌的生物学标志物。与NSCLC相比,SCLC中已明确的与miRNA关联的生物标志物的结果还较少。血浆中miRNA-92a-2水平可作为一种诊断SCLC的潜在生物标志物,而miRNA-184和miRNA-574-5p可作为其预后的潜在生物学指标[73-74](表3)。
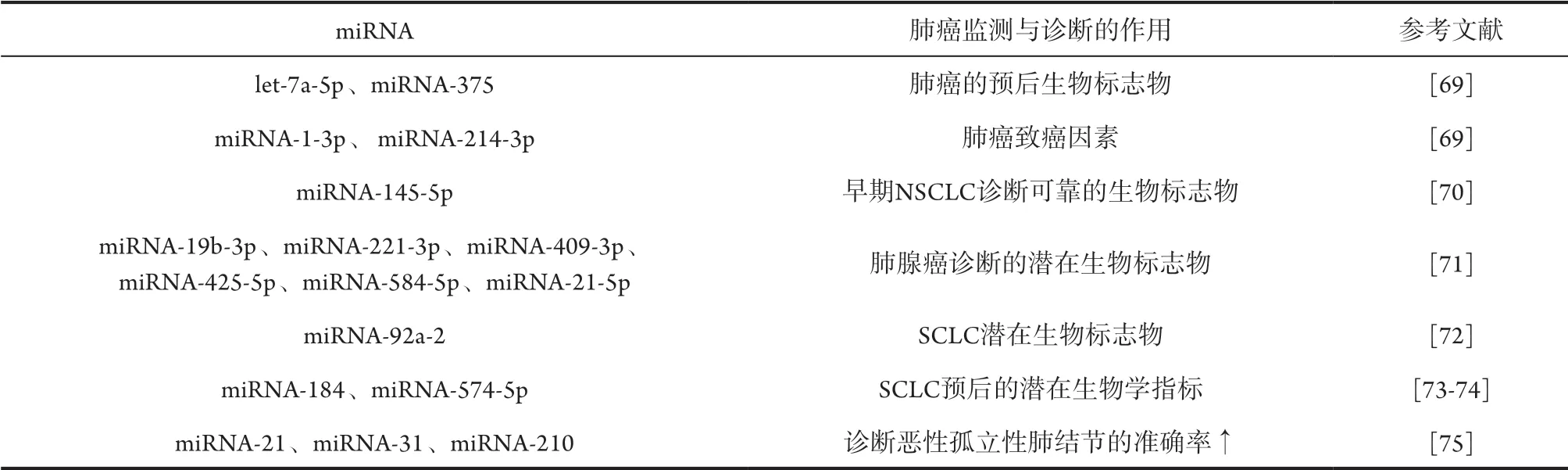
表3 肺癌诊断与监测的新工具:miRNA
miRNA作为肺癌诊断的新手段,还可能使一些早期肺癌患者的高频率影像学检查现状得以改善。研究者们开发了一组包含miRNA-21、miRNA-31和miRNA-210的组合的miRNA生物标志物[75],以此减少用CT进行肺癌筛查的频率,并可提高术前诊断恶性孤立性肺结节的准确率 (表3)。但痰液中的miRNA作为肺癌生物标志物还需更多前瞻性研究。
因此,miRNA可作为肺癌的潜在生物学标志物。但肺癌发病机制十分复杂,且对于miRNA在其发生及发展中所发挥的作用仍有许多未知领域,要彻底实现miRNA作为临床诊断及预后的生物学指标还需继续深入探索。
七、miRNA与肺癌的转移及预后
miRNA表达谱有助于miRNA作为恶性肿瘤的转移监测及预测预后的潜在生物标志物。运用TCGA数据库获取肺癌患者临床信息及miRNA的表达数据,就可识别差异表达的miRNA并作进一步分析,对患者的血清、血浆、痰液甚至组织等样本进行验证。
近期一项研究报道了利用qRT-PCR检测发现发生远处转移的NSCLC患者血浆中的miRNA-21和miRNA-23a水平显著高于无转移患者,且二者的表达与肿瘤大小显著相关,但与淋巴结转移无关[76],而miRNA-148a的下调则与NSCLC淋巴结转移和不良的预后密切相关,并抑制肿瘤的转移,其表达上调使DNMT1表达降低,进而抑制了A549和H1299细胞(NSCLC的细胞系)的迁移和侵袭能力[77]。另外,miRNA-21-5p在NSCLC中通过靶向SMAD7的表达促进肿瘤的发展,其在肿瘤组织中的高表达与肿瘤大小、淋巴结转移、远处转移以及分化显著相关[78]。miRNA-155-3p和miRNA-155-5p直接靶向TP53INP1可抑制NSCLC中的细胞增殖、迁移和侵袭[79]。miRNA-92a、miRNA93-5p、miRNA-17-5p的表达升高和let-7b、miRNA-145-5p的下调与腺癌的较差生存结果相关,并可作为侵袭性肺癌的预后标志物[80-82]。
同时,一些miRNA可在不同肺癌病理亚型中表现出改变,而不只局限于一种。Reis等[83]阐述了miRNA-16-5p、miRNA-92a-3p和miRNA-451a的表达调节在早期腺癌患者的血浆中具有高度特异性,而在早期鳞癌中则具有高度敏感性,这些miRNA在肺癌发生中的已知调控途径包括EGFR、K-RAS和PI3K/AKT的信号转导。
再者,不同的miRNA靶向于某一信号转导通路可使肺癌显现出不同的肿瘤生物学行为。例如,miRNA-184和miRNA-574-5p均通过抑制PTPRU或EPAS1参与β-catenin信号转导,并在SCLC中调控肿瘤的侵袭及转移;前者可显著减轻NSCLC的转移,而后者则增强了转移,并且是SCLC的独立危险因素[74]。所以,如何大幅度提高miRNA监测及判定各型肺癌预后的敏感性和特异性,是miRNA从临床前研究到临床中运用所要面临的又一大问题。
八、miRNA在肺癌治疗中的调控作用
近年来,靶向治疗联合放化疗在肺癌患者、尤其是晚期肺癌患者的治疗中具有较高的临床应用价值,而靶向miRNA治疗剂的开发也已成为重要的抗癌补充策略及研究热点。证据表明,一些关键miRNA的调节还可能逆转致癌信号通路,并增强抗癌治疗中的细胞毒性作用[84]。如miRNA-4262可通过调节PTEN进而参与NSCLC对紫杉醇的耐药性,抑制其表达可能是克服NSCLC对紫杉醇耐药性的一种方法[85];miRNA-34a直接靶向MYCN可以使NSCLC细胞对顺铂敏感。由于miRNA调节参与恶性肿瘤发生及发展的信号通路中的非编码序列和其他众多基因的表达,故而使其承担起了潜在的治疗靶点角色。
EGFR-TKI等药物在近些年晚期NSCLC患者已面临严重的耐药问题。部分患者EGFR-TKI获得性耐药机制除了与HER2扩增、MET扩增激活和PI3K突变等有关外,还与miRNA或其他的非编码RNA有关[86]。这些证据使得与EGFR-TKI耐药相关联的一些miRNA有望成为NSCLC患者的潜在治疗佐剂。如大多数晚期NSCLC患者对厄洛替尼产生了耐药性,miRNA-125a-5p明显降低了NSCLC患者EGFR mRNA的表达,且呈时间依赖性,导致细胞增殖明显抑制和自发凋亡,miRNA-125a-5p对EGFR的抑制作用可有效触发肺癌细胞凋亡,同时克服肺癌细胞对EGFR-TKI的耐药性,miRNA-125a-5p可能是肺癌患者潜在的治疗辅助剂[87]。
抗HER2的单克隆抗体是目前治疗SCLC的又一重要靶向药物。miRNA-125a和miRNA-125b可结合到HER2的mRNA 3'UTR,二者下调导致SCLC细胞中HER2上调。钙黄素试验证明顺铂等化疗药物在活体原位肺癌模型中抗肿瘤作用增强,通过调控miRNA-125-HER2途径可作为曲妥珠单抗介导的SCLC细胞毒性的新型治疗靶点[88]。
一些miRNA靶向的调控轴在肺癌放射治疗中也起重要作用,并代表了NSCLC新的潜在治疗靶点。如miRNA-21-5p的抑制可通过HMSH2促进NSCLC的放射敏感性[89-90]。miRNA-144-5p靶向激活ATF2并增强了NSCLC的放射敏感性,而miRNA-124可靶向抑制STAT3,进而抑制NSCLC生长并诱导所放射的细胞凋亡[91-92]。miRNA-339-5p靶向PRL-1提高肺癌细胞的放射敏感性[93]。
miRNA作为治疗恶性肿瘤的靶点或潜在靶点,在临床前和临床实验阶段显示出有希望的前景。但基于临床环境中靶向miRNA治疗的复杂性及其他问题,还需更多临床前及临床的前瞻性 研究。
九、总结与展望
目前已可在肺癌的不同阶段使miRNA得到实时定量及定性检测,并可作为肺癌的诊断、预后甚至预测性生物标志物。但要使miRNA完全进入临床诊断阶段仍存在诸多难点,如miRNA标志物的特异性及敏感性欠佳,检测和定量技术也需要改善,从而能够普及于临床,且经济有效。
此外,miRNA还可被用于补充当前肺癌干预治疗的策略。合成或干预特定的miRNA来抑制肺癌的发生、发展、耐药性及放射抵抗性等。但是仍有许多障碍需要克服,诸如药物输送、特异性、脱靶效应、毒性介导及免疫学激活的不良事件等突出问题。
再者,某些miRNA在增强或抑制肺癌进展方面具有双重作用,且不同信息分子与不同信号转导途径之间还存在交叉对话,构成了复杂的调控及信号转导网络。因此,想要实现miRNA从临床前阶段到临床中诊治肺癌的彻底转变,就需要对其在肺癌发生、发展中的作用及机制有更深入的认识及理解,并通过大规模的研究解决许多上述的关键性问题。
