新辅助化疗、靶向治疗联合手术治疗临床 Ⅲ期EGFR阳性肺腺癌
2021-03-15赵晨张辉刘冬张淼武文斌周悦
赵晨 张辉 刘冬 张淼 武文斌 周悦
肺癌目前是全球发病率和病死率最高的恶性肿瘤,非小细胞肺癌(non-small cell lung cancer,NSCLC)是最常见的病理类型[1]。早期肺癌以手术治疗为主,晚期肺癌(Ⅳ期)以化疗、靶向治疗等内科保守治疗为主。据统计,临床上约1/3的NSCLC就诊时已处于临床Ⅲ期(cⅢ)[2],目前对于cⅢ期的最佳治疗模式仍存在较大争议,手术、化疗、靶向治疗,包括近期新出现的免疫治疗等都能使特定人群患者获益。联合治疗模式也有很多临床试验在开展及案例报道,包括新辅助化疗联合手术、新辅助放化疗联合手术及靶向联合化疗等[3]。
针对可手术切除的cⅢ期NSCLC,虽然近年来胸腔镜手术技术的快速进步使围手术期并发症明显降低,但单纯手术患者术后5年生存率仍较低,约20%~35%[4],且术后易出现复发和远处转移,因此目前国内外指南均推荐采用包含手术在内的多学科治疗模式,基本治疗策略已经从手术切除联合术后辅助[5]逐渐过渡到新辅助治疗后再行根治性手术等综合治疗方案[6]。本研究旨在探讨cⅢ期且EGFR阳性的患者行新辅助化疗、靶向治疗后再行外科手术这一新的综合治疗模式的安全性及有效性。
对象与方法
一、对象
观察组:收集徐州市中心医院2019年9月至2020年9月收治的12例临床病理诊断为cⅢ期肺腺癌的NSCLC患者。纳入标准:①根据国际肺癌研究协会(International Association of Lung Cancer,IASLC)第8版标准,cTNM为T3N1M0、T1~3N2M0(ⅢA~ⅢB);②EGFR阳性,既往无其他肿瘤病史;③年龄≤75周岁,功能状态评分(Performance status ,PS)0~2;④无远处转移,无放疗化疗病史,无胸部手术史;⑤骨髓造血功能、肝肾功能正常,心、肺功能无明显异常。剔除标准:①肿瘤无法完整切除;②伴发糖尿病、高血压等基础疾病、控制不佳;③病历资料不完整。
对照组:同期我院肺癌数据库中术前无新辅助治疗,匹配观察组入组条件单纯接受外科手术的20例患者。
二、方法
观察组采用培美曲塞+卡铂方案行新辅助化疗,即:培美曲塞500 mg/m2,静脉滴注,d1;卡铂AUC=5静脉滴注,d1;21天为1个周期,共行2个周期化疗,同时给予VB12、叶酸及地塞米松预处理;化疗同时口服第一代靶向药吉非替尼 250 mg/d;化疗方案结束后3~4周行手术治疗, 10例患者顺利接受手术治疗(A组),手术方式均为标准肺叶切除+系统淋巴结清扫术,手术方式首选胸腔镜手术,根据术中情况可选择中转开胸。
对照组(B组)手术方式同观察组。
三、观察指标
采用门诊随诊及电话形式随访,末次随访时间为2020年12月。①观察组的不良反应评价依据美国国立癌症研究所(Nation Cancer Institute,NCI)标准[7],包括消化道反应、皮疹、骨髓抑制、周围神经炎等,严重程度分为Ⅰ~Ⅳ级;②手术相关临床指标包括手术切除率、淋巴结清扫枚数、术中出血量及引流管拔除时间、术后住院时间;③术后严重并发症类型包括肺部感染、胸腔感染、支气管胸膜瘘、乳糜胸、呼吸衰竭、神经损伤、30 d死亡病例等;④记录患者总生存时间。
四、疗效评价
根据实体瘤疗效反应评价(Response Evaluation Criteria In Solid Tumors,RECIST)标准评价术前新辅助的疗效[8],包括完全缓解(complete response,CR),部分缓解(partial response,PR),疾病稳定(stable disease,SD)及疾病进展(progression disease,PD),缓解例数=CR+PR;组织学评价依据《临床肿瘤内科学学》[9]分为Ⅰ~Ⅳ级,有效=Ⅰ级+Ⅱ级。
五、统计学方法
采用SPSS 22.0软件进行数据分析。计量资料均以x±s表示,两组间的各观察指标均采用独立样本t检验,因样本量较小两组间率的比较采用Fisher精确检验,以P<0.05为差异有统计学意义。
结 果
一、A、B两组患者一般资料比较
两组患者性别、年龄、吸烟史、手术方式(胸腔镜/开放手术)、TNM分期差异均无明显统计学意义(P>0.05,表1)。
二、两组患者术中、术后临床指标比较
A、B两组术中出血量、术后住院时间及术后严重并发症发生率等差异均无统计学意义(P>0.05,表2)。A组肿瘤分化程度优于B组,差异有统计学意义(P<0.05,表2)。

表1 两组患者临床病例资料情况比较
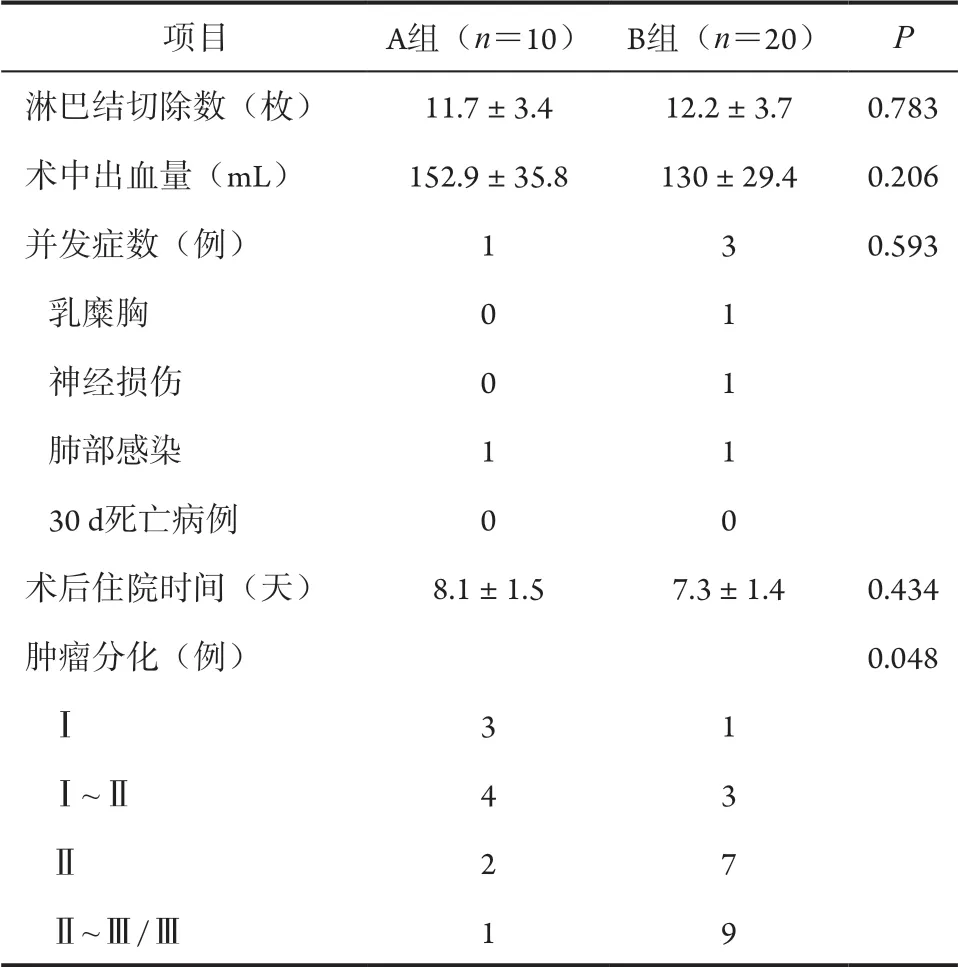
表2 两组患者术中、术后临床指标比较
三、观察组近期疗效
12例患者行新辅助化疗+靶向治疗方案,1例出现PS评分下降且病灶SD,1例出现PD,总体耐受较好(11/12),总体有效率约83.3%(10/12);术后病理4例pⅠ,5例pⅡ,1例pⅢ,与治疗前临床分期比较,降期率达75%(9/12)。
讨 论
流行病学调查[9]显示,临床工作中,85%以上肺癌患者是NSCLC,而这类患者5年生存率不到20%。目前临床对于NSCLC可切除患者仍首选手术治疗,但Ⅲ期患者直接切除术后5年生存率不足15%;另一方面新辅助治疗后Ⅲ期NSCLC患者手术R0切除率[10]提高至75%以上,pCR率接近15%,并且5年生存率接近25%[11-12]。针对Ⅲ期NSCLC的最佳治疗模式存在较大争议,临床仍在积极探索中[13-16]。
相关临床研究[17-18]显示,针对肺癌的新辅助化疗有效率25%~74%,病理降期率达20%~60%。新辅助化疗具有以下优点[15]:①新辅助化疗能够缩小原发病灶,降低肿瘤的临床与病理分期;②增加肿瘤与正常组织以及转移淋巴结和血管及周围组织间隙,从而提高手术切除率;③通过减少和消灭微转移灶而提高长期生存率;④能够评价机体对化疗药物敏感性及为后续最佳化疗药物选择提供帮助。随着分子药物研究的进展,近年来以EGFR-TKIs为代表的靶向药物已被广泛用于存在基因突变的NSCLC患者的临床治疗。EGFR属于跨膜糖蛋白,其表达与细胞分裂、凋亡、迁移及组织黏附等多种功能密切相关,而EGFR-TKIs则与EGFR结合充分发挥抑制肿瘤生长效应,针对EGFR突变型患者疗效非常显著[19]。多项临床随机对照研究[20-21]显示,晚期EGFR基因突变型NSCLC一线治疗采用EGFR-TKIs后患者客观缓解率(objective response rate,ORR)和无进展生存期(progression-free survival,PFS)均取得较好结果,中位生存期(median overall survival,mOS)亦接近30个月。
本研究观察组参考日本NEJ009 Study[22]的试验设计,采用一代靶向药吉非替尼口服,联合培美曲塞+卡铂方案化疗的术前新辅助方案。观察组总体耐受较好,总体有效率达83.3%,治疗后降期率高达75%。既往研究[23]报道,新辅助化疗后患者因组织水肿、纤维化及粘连往往导致肿瘤区域解剖层次变差,血管鞘增厚,同时血管壁脆性增高,引起渗血增多进而导致手术操作难度增加。靶向药物更多局部作用于肿瘤组织,对组织层次和血管鞘影响较少。但本研究中A组术中出血量、引流管拔除时间、术后住院时间均多于B组,但差异无统计学意义,可能与纳入样本量较少、个体差异较大相关。A组的肿瘤高-中分化比例明显高于B组,有文献报道,肿瘤分化与患者远期预后密切相关[24],但本研究随访时间较短,远期预后有待后续继续随访。对于新辅助治疗后手术时机的选择,国内外有研究[12,25]报道新辅助治疗结束30天内手术可以达到最佳预后,同时口服靶向药9周可以达到较好的肿瘤学治疗效果,所有本研究选择新辅助化疗结束3~4周后手术。
综上所述,对于EGFR阳性、健康状态较好(PS 0~2)的cⅢ期肺腺癌患者,术前行新辅助化疗、靶向治疗后再行外科手术可达到术前降期、改善肿瘤分化的效果,并有助于延长生存时间,并且这一新的综合治疗模式安全、有效。但所得结论有待继续随访,有待更大规模的前瞻性研究论证。
