经纵隔镜与胸腔镜治疗早期食管癌的围手术期结果
2021-03-15范啸李洪宋鹏汪潜云
范啸 李洪 宋鹏 汪潜云
食管癌的全球发病率和病死率较高,分别位居恶性肿瘤的第4和第8位,是严重影响人类身体健康的恶性肿瘤之一[1]。目前可切除食管癌的首选治疗方式仍是外科手术切除[2]。以往对于食管癌的切除一直是传统的开放手术,但目前随着腔镜技术的发展,腔镜较传统开放手术可放大局部视野而清晰暴露出食管及其周围结构,使术者能顺利地完成精准操作,具有术中出血少、手术时间短及术后并发症少等优点[3],因此在食管癌中治疗中广受推崇,逐渐成为临床医生及患者的首选治疗方式。
目前常州市第一人民医院(以下简称‘本中心’)常用的食管癌微创手术方式主要为胸腔镜辅助食管癌切除(胃食管颈部吻合,McKeown)及纵隔镜辅助经纵隔食管癌根治术。本文主要分析这两种微创手术方法治疗早期食管癌的围手术期结果。
资料与方法
一 、临床资料
回顾性分析本中心2015年1月至2020年6月经纵隔镜食管癌切除(mediastinoscope-assisted transhiatal esophagectomy,MATHE)的60例患者及行胸腔镜联合开腹手术的60例食管癌患者的资料。将患者按照治疗方法分为MATHE组与胸腔镜下食管癌切除(thoracoscope-assisted transthoracic esophagectomy,TATTE)组。由于本中心采用MATHE手术时常规采用开腹游离胃,而腔镜下食管癌切除常用胸腔镜游离食道+腹部开放游离胃及胸腹腔镜联合食管癌切除两种方式,为尽可能排除腹部手术方式不同造成的差异,两组都采用常规开腹方式游离胃及行管胃重建,均在颈部切口进行吻合。纳入标准:①通过胃镜活检病理证实为食管癌;②术前胸部增强CT及上腹部B超检查无明显转移;③术前经食管超声内镜(endoscopic ultrasonography,EUS)检查纵隔无明显肿大淋巴结,且食管癌浸润不超过T2。排除标准:①既往有颈椎疾病史,头颈不能后仰者;②有明确心肌梗死、脑梗死、肺梗死病史等合并重要器官功能不全;③胸部CT或C超声内镜示纵隔淋巴结肿大超过1 cm。
二 、手术方法
MATHE组采用全身麻醉后行单腔螺纹管气管插管,患者取平卧体位,肩部垫高,头颈后仰;手术采用左颈胸锁乳突肌前缘切口(下至胸骨上凹、上至胸锁乳突肌中点,约6 cm)及上腹正中切口,由两小组医师同时进行。一组医师术中使用电视纵隔镜经颈部切口游离上中段及部分下段食管。主动脉发出的食管营养支采用钛夹夹闭后剪断,直至下肺静脉水平,同时清扫术中可见的纵隔淋巴结。另一组医师行上腹部切口游离胃,保留胃大弯侧和右胃动脉,并经膈肌食管裂孔游离食管下段至下肺静脉水平,放置纱布作为标记,以确保食管完全游离。切断缝闭贲门部,将食管从颈部切口拉出。将胃体在体外制作管胃后沿食管床送至颈部,行食管一胃底颈部吻合,颈部切口放置硅球引流。
TATTE组患者全身麻醉后行左侧侧俯卧位,于右侧腋中线第7肋间作置镜孔;腋前线第3、6肋间为主操作孔,右肩胛下角线第7肋间作为辅助操作孔。以CO2制造人工气胸。在胸腔镜下打开纵隔胸膜,离断奇静脉,游离食管肿瘤与周围组织,向上游离至颈段食管,向下游离至膈肌食管裂孔处;清扫食管周围及纵隔淋巴结;确认胸腔无出血后放置胸腔引流管,关闭胸部切口。胸部手术结束后患者改为平卧位,头偏右侧,在上腹正中做长约12 cm切口,游离出胃并制作管状胃,清扫腹腔淋巴结;最后在颈部作长约5~6 cm小切口,游离颈部食管,将食管肿物切除,将做好的管胃经食管床拉至颈部,完成胃和食管的吻合。
三、观察指标
比较两组间手术时间、术中出血量、纵隔淋巴结清扫数目、肺部感染及喉返神经损伤及吻合口瘘情况。
四、统计学处理
采用SPSS 24.0统计软件进行分析,计数资料采用χ2检验,计量资料采用独立样本t检验。P<0.05为差异有统计学意义。
结 果
纳入研究病例中MATHE组男39例,女21例,年龄51~82(69.3±7.8)岁。TATTE组男44例,女性16例,年龄44~79(67.8±6.4)岁。两组间性别、年龄、肿瘤发生部位差异无统计学意义(均P>0.05,表1)。
两组手术均顺利进行,无围手术期死亡病例。MATHE组手术时间较TATTE组相应减少,差异有统计学意义(P<0.05);而与MATHE组相比,TATTE组纵隔淋巴结清扫、术中出血量有明显优势,差异有统计学意义(均P<0.05)。两组肺部感染、喉返神经损伤及吻合口瘘发生情况差异无统计学意义(均P>0.05,表2)。
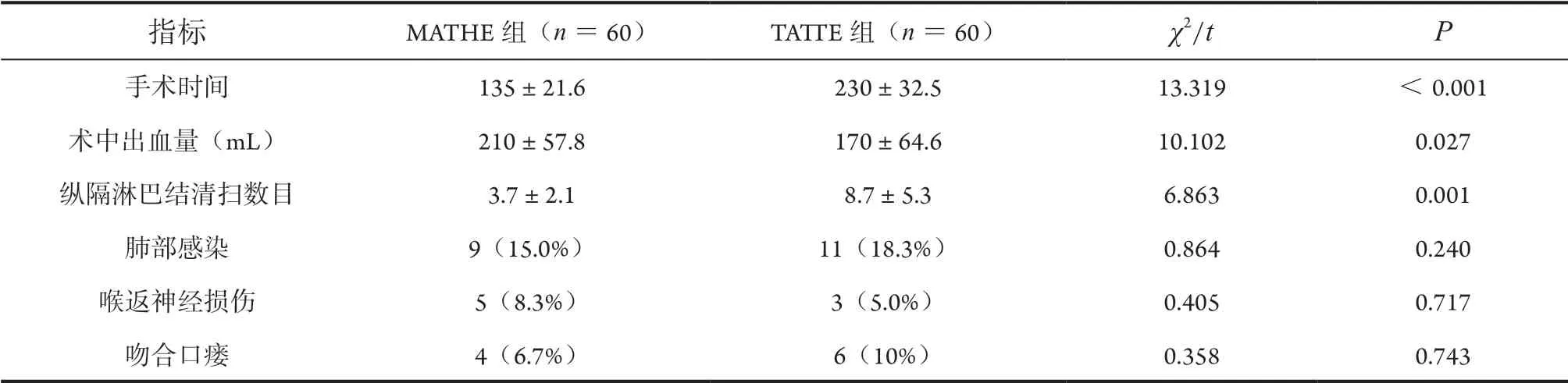
表2 两组间各观察指标比较
讨 论
自1992年Cuschieri等[4]首次报道了微创食管癌手术,因其具有创伤小、术中出血少、并发症发生率低及术后恢复快等优势,逐渐被一线胸外科医生所认可。目前治疗食管癌常用的微创方式主要有胸腹腔镜联合食管癌切除(胃-食管颈部吻合,McKeown)[5-6]、胸腹腔镜联合食管癌切除(胃食管胸内吻合,Ivor-Lewis)[5-6]和经裂孔的微创食管癌切除术[7],纵隔镜辅助经纵隔的食管癌根治术,纵隔镜联合腹腔镜食管癌切除术等。我中心自2005年起开展纵隔镜食管癌的微创治疗,总结以往十多年纵隔镜食管癌治疗经验与教训[8-11],经纵隔镜辅助治疗早期食管癌技术相当成熟。此外,随着微创技术的发展,胸腔镜在食管癌治疗中越来越普及。在纵隔镜下自颈部游离食管,术者的视野是自胸顶向膈肌裂孔,食管的解剖层次是自上向下,解剖径路与胸腔镜手术有很大不同[12]。
本研究主要探讨经纵隔镜联合腹部开放食管癌切除术(胃食管颈部吻合)与经胸腔镜联合腹部开放食管癌切除术(食管胃颈部吻合)两种术式治疗早期食管癌的临床效果。MATHE组较TATTE组缩短手术时间更有优势,差异有统计学意义,这与复旦大学中山医院的研究[13]结果一致。这主要是因为TATTE组先在侧俯卧位下经胸腔镜游离食管,结束后再重新改平卧位进行腹部与颈部操作,而MATHE组由两小组医师成员分别从颈部与腹部同时进行,能有效缩短手术时间。TATTE组较MATHE组在术中出血量及纵隔淋巴结清扫方面有显著优势,差异有统计学意义。由于在纵隔镜辅助食管癌切除中,纵隔的空间狭小,置入纵隔镜使手术范围进一步受到限制,局部暴露困难,术中止血相对困难,出血风险增加以及胸部淋巴结的清扫较为困难。在肺部感染、喉返神经损伤、吻合口瘘发生方面,MATHE组与TATTE组相比,差异无统计学意义。理论上,纵隔镜手术避免了开胸,保证了胸膜腔的完整性;而TATTE组由于经胸部建立人工气胸,在胸部操作过程中牵拉并损伤肺组织,有增加术后肺部感染发生的风险[14]。在以往的经验教训下,经胸腔镜手术时须特别注意保护围手术期肺,动作轻柔,术后及时行抗炎、雾化、祛痰等支持治疗能有效降低术后感染的风险。本研究仍有不足之处,主要分析了近5年食管癌患者的病史资料,缺乏长期的随访数据以进一步评估患者的远期生存情况。
综上,经纵隔镜与经胸腔镜在治疗早期食管癌中都是可行的,但在减少术中出血和淋巴结清扫上,经胸腔镜手术较经纵隔镜手术具有更大的优势。
