鼻一氧化氮测定在变应性鼻炎临床应用的Meta分析
2021-03-13刘哲于金壮田杰史丽
刘哲,于金壮,田杰,史丽
一氧化氮(nitric oxide,NO),化学式NO,相对分子质量为30,常温下是一种无色无味难溶于水的气体。Furchgott等[1]早在1980年于Nature杂志报道其生物学功能。大量研究表明NO能够通过血液、淋巴液、各种体液等不同途径,作用于细胞膜表面,介导细胞应答。除此之外,其扩张血管及支气管、调节神经递质和炎症介质释放等作用也被熟知[2-5]。研究证实,呼吸道慢性炎症性疾病(特别是哮喘)患者呼出气体中NO含量远高于正常人群[6]。呼出一氧化氮(fractional exhaled NO,FeNO)的检测在诸如哮喘等慢性呼吸道炎症疾病的临床诊疗、病情评估以及指导用药等方面具有重大意义[7-8]。变应性鼻炎(allergic rhinitis,AR)和哮喘均为IgE介导的Ⅰ型气道变态反应。2001年世界卫生组织(WHO)提出“同一气道,同一疾病”(one airway one disease)的观点已被各国专家认可,因此针对AR患者nNO(nasal nitric oxide,nNO)的测定具有重要价值。
欧洲呼吸学会(European Respiratory Society, ERS)和美国胸科学会(American Thoracic Society, ATS)对FeNO的检测做出了严格规范[9-10]。目前鼻腔NO检测方式分为鼻呼气测量法和经鼻气流测定法。但针对nNO的测定仍然缺乏严格的规范性以及被广泛认可的统一标准。关于其测定方法在早期的研究中存在一定争议[11-14]。这可能与许多混杂因素有关,如是否存在鼻部其他疾病、鼻喷激素的使用、近期是否有相关过敏原暴露以及检测方法的差异等。鼻腔中NO可被量化测定,相较于AR皮肤点刺实验以及IgE测定,具有便捷、无创、简易和主观因素小等优势,具有重要的临床应用价值。总之,AR患者nNO量化研究需要更加系统的回顾和总结,以便于对之后的相关研究和后期临床实践应用做出参考和建议。
本文旨在对AR和nNO水平之间的关系进行系统回顾和Meta分析,总结相关研究信息及特点,为临床nNO检测对AR的诊疗提供合理、有效的循证医学证据。
1 资料与方法
1.1 检索策略
应用计算机检索2005年1月1日至2021年3月31日国内外发表的关于变应性鼻炎患者nNO检测的相关文献。所检索中文数据库包括:中国期刊全文数据库(CNKI)、维普(VIP)及万方数据库;英文数据库包括:PubMed、Web of Science、Embase、Cochrane Library。中文检索词为:“变应性鼻炎、过敏性鼻炎、鼻炎、鼻一氧化氮、一氧化氮、NO”;同时筛选条件包含临床对照研究。英文检索主题词为“allergic rhinitis、nasal、 nitric oxide”,以主题词和自由词相结合,运用数据库高级检索模式,过滤器选择“clinical trial”,并手工检索相关期刊、会议论文集及尽可能多的参考文献。
1.2 文献纳入及排除标准
纳入文献:中英文病例对照研究,明确诊断的AR患者(包括季节性和常年性),年龄、性别、种族不限,合并或不合并哮喘患者。各项研究测定nNO仪器及方法不限(单个研究组间测定方法应相同)。结果指标测量均以ppd(parts per billion,ppd)为单位。
排除文献:研究数据不完整,无法获得相关数据的临床研究;明显设计缺陷或设计错误的研究;重复的研究;质量评价较低的研究;动物实验相关研究;综述及Meta分析。
1.3 文献筛选及资料提取
首先通过EndNote X7软件对文献进行计算机去重,由2名研究人员严格按照纳入及排除标准独立筛选文献,最终将筛选结果进行核对,若出现意见分歧时则通过讨论及第三方的意见共同决定是否纳入。确定相关入选文献后,通过阅读全文,对文献基本信息(包括年龄、性别比例、病例数、NO测量方式、种族等)进行提取汇总。
1.4 文献质量评价
通过纽卡斯尔-渥太华量表(the Newcastle-Ottawa scale,tNOS)对所纳入的研究进行方法学质量评价。通过研究人群选择、组间可比性、暴露因素三个项目中的8个条目对病例对照研究进行方法评价,采用星级系统评价原则(满分为9颗星)对文献进行半量化评价[15-16]。
1.5 统计学分析及偏倚分析
采用Review Manager5.3和Stata 16软件进行统计分析。病例和对照组之间的差异以标准化平均差(SMD)及95%置信区间(95%CI)表示。采用Inverse Variance法进行检验,P<0.05为有明显统计学差异。各研究间的异质性大小通过Q值和I2值进行评估。I2<25%表示不存在异质性; 25%≤I2<50%表示低度异质性;, 50%≤I2<75%表示中度异质性;I2≥75%表示高度异质性。Q检验中,P<0.1表示具有异质性,P>0.1表示无异质性。若无异质性选择固定效应模型加权合并,若存在异质性则用随机效应模型加权合并。发表偏倚采用漏斗图表示,并通过Begg和Egger‘s’法对漏斗图进行量化分析(P>0.1认为无发表偏倚)。
1.6 敏感性分析
根据tNOS文献质量评价结果,对纳入研究中tNOS评分中位数及以上的高质量研究进行单独分析,排除只能通过摘要提取数据的研究后进行分析,调查潜在的异质性来源。根据纳入研究的病例及对照组人群特征进行取舍后再分析。通过逐个删除单一研究进行重新分析。为了避免数据重叠,排除来自同一研究中心和同一时期纳入其他研究的患者数据。
1.7 亚组分析
根据年龄,分为成人和儿童两组进行亚组分析。研究地域人群分为亚洲及欧美国家。针对nNO的不同测量方式(经鼻气流式和鼻呼气式)进行亚组分析。根据常年性和季节性(花粉季和非花粉季)AR进行分类分析。
1.8 回归分析
以平均年龄、肺功能指标(FEV1、FEV1/FVC)、测量nNO时的经鼻气流流速等协变量为自变量(x),以nNO变化为因变量(y)进行一元回归模型的回归分析。采用数据处理软件Stata 16通过限制最大似然 (ReML) 方法进行分析。
2 结果
2.1 检索结果
通过检索初步获取中英文文献共885篇。进行计算机软件去重后,获得文献690篇。阅读文献题目,去除综述、Meta分析、动物实验、离体实验后,筛选得到文献129篇。再对文献进行摘要及全文阅读后,最终入选文献36篇(图1)。其中中文文献8篇,英文文献28篇。纳入研究中AR患者3 012例,对照组2 409例。

图 1 文献筛选流程图Fig 1 Document screening process
2.2 纳入研究的信息特征
各研究组别的人数在5~328之间,各组别年龄区间为3~65岁;合并哮喘或鼻息肉的患者从0%到100%不等;吸烟比例为0%~79.2%;FEV1均值77% ~ 101.2%,FVC均值82%~98%,FEV1/FVC均值82%~93.8%;男性占22%~80%(表1)。其中,5篇文献[20,25-27,44]根据AR患者合并哮喘与否进行进一步分析;1篇文献[29]区分季节性鼻炎与常年性鼻炎后进行分析;1篇文献[18]针对季节AR是否处于发病季节进行分析;1篇文献[42]根据AR严重程度进行区分;1篇文献[35]根据NO测量传感器不同进行了分类研究。1篇文献[39]同时对合并哮喘与否、季节性鼻炎与常年性鼻炎、季节AR是否处于发病季节进行了不同的分类研究。4篇文献[20-22,40]无法获得原文,数据通过摘要提取。各项研究nNO测量仪器传感器基本分为化学、电化学两类;5项研究[19,23,29,35-36]采用鼻呼气法进行测量,其余均为经鼻气流测定法(表2)。

表1 纳入研究基本信息Table 1 Basic characteristics of the included studies

续表1
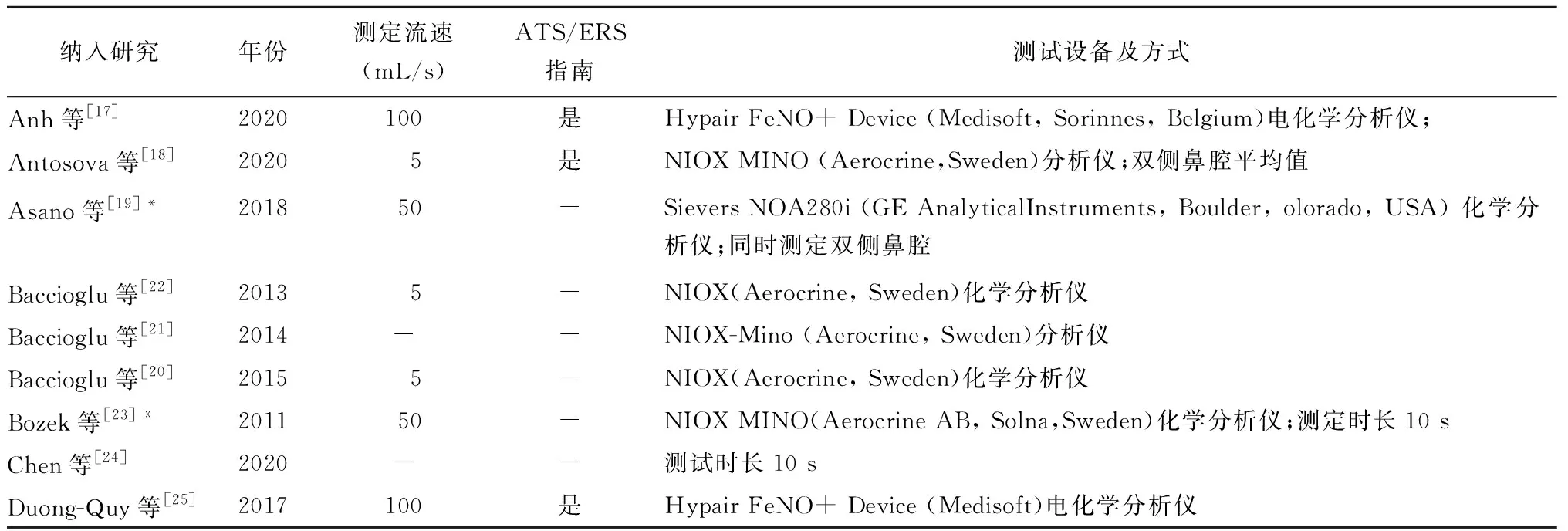
表2 鼻一氧化氮检测方式Table 2 Method of nasal nitric oxide measurement

续表2
2.3 文献质量评价
根据tNOS量表进行评价,得分区间在5~8分,平均分值为6.7(表3)。

表3 纽卡斯尔-渥太华量表评分Table 3 Newcastle-Ottawa scale

续表3
2.4 总体分析结果
对所纳入研究进行总体分析结果显示,3 012 例AR患者的nNO值明显高于2 409例健康对照人群(SMD:1.39,95%置信区间:1.07~1.71),两组比较差异具有统计学意义(P<0.01)。各研究的异质性具有统计学意义(I2=96%,P<0.1)(图2)。

图 2 变应性鼻炎患者与对照组鼻一氧化氮检测水平
2.5 发表偏倚
总体研究漏斗图基本对称,表明纳入研究的发表偏倚较小(图3)。采用Begg法和Egger‘s’法对发表偏倚进行量化后P=0.936(图4),无明显发表偏倚。

图 3 偏倚性分析漏斗图Fig 3 Funnel plots

图 4 Begg’s及Egger’s法偏倚性分析
2.6 敏感性分析
根据tNOS评价量表得出所纳入研究平均得分为6.7分,选取tNOS评分大于等于7分以上的高质量研究[17,25,26,28-30,35,37-39,40,42-46,48-50]进一步分析(排除低质量及通过摘要获得数据的研究),结果与总体分析结果相似(表4)。再分别针对明确无哮喘[17,20,23,25-28,30-34,36,38-47,49-52]和无吸烟史[18,19,24,26-29,34,36,41-45,46,52]患者的研究进行分析,并对涉及具有明确皮肤点刺试验阳性或(和)IgE抗体异常患者[18-23,24,28,29,32-37,39,41,42,44,46,47,49,51,52]的研究进行分析,均得到类似结果(表4)。逐个删除单一研究对总体分析的结果影响不大。

表4 敏感性分析Table 4 Sensitivity analyses
2.7 亚组分析
针对22项成人[17-18,23,25,27,28,30-33,35-39,41,44-47,49,51]研究及7项[24,26,34,42-43,48,52]儿童研究分析发现,成人、儿童病例与各对照组相比nNO水平均有统计学差异(表5)。欧美[18,23,26,29,31,35-37,41-44]、亚洲[17,19-22,24-25,27-28,30,32-34,38-40,42-43,45-52]、鼻呼气[19,23,29,35-36]及经鼻气流测试亚组分析发现,nNO测定结果具有统计学差异。对常年性AR[17,29,38-39,43,47,50]研究结果表明,nNO在常年AR病例组与对照组之间也具有统计学差异。对花粉季节[18,28,39,46]进行的研究重复分析,进一步证实季节性AR患者和健康受试者之间的nNO具有显著差异。相反,4项研究[18,29,39,41]证实处于非花粉季节的季节性AR病例和对照组间的nNO水平无明显差异(P=0.54)。由于纳入的研究均为前瞻性研究,因此未进行研究设计亚组分析。针对季节性鼻炎(花粉季和非花粉季)及鼻呼出气体测定方式的亚组分析发现,异质性相关数值有所降低,但没有消除异质性。

表5 亚组分析Table 5 Subgroup analyses
2.8 回归分析
AR患者和健康对照组的回归模型显示,测试时气流流速与病例和对照组之间的nNO水平差异有关(Z=3.42,P=0.001)。年龄与病例及对照组之间的nNO差异具有一定相关趋势(Z=-1.57),但无明显统计学意义(P=0.117)。FEV1及FEV1/FVC两组间的nNO差异无明显相关性,也不影响本研究的异质性(图5)。

图 5 Meta回归分析
3 讨论
本研究结果表明,AR患者的nNO水平较正常人群有所增加。敏感性分析证实,nNO测定结果基本不受哮喘病史、 吸烟史等因素的影响。亚组分析进一步说明nNO测定结果与患者的年龄、地域种族无关,说明nNO测定在一定范围内具有稳定性。鼻呼气和经鼻气流测定两种测定方式均可区分变应性鼻炎患者与健康人群,这丰富了nNO检测的机动性和多样性。有趣的是,在对常年性与季节性(花粉季、非花粉季)变应性鼻炎进行亚组分析时,发现常年AR和处于花粉季的季节性AR患者nNO水平普遍高于健康人群,而处于非花粉季的季节性AR患者nNO水平与对照组相比差异无统计学意义。这对通过检测nNO水平鉴别常年性与季节性AR具有重要的临床价值。
然而,值得注意的是nNO的测定值可能会受到鼻窦炎、鼻息肉、鼻窦窦口堵塞等因素影响。鼻腔内黏膜肿胀可能导致鼻窦口阻塞,从而阻止NO向鼻腔分布。We等[53]研究发现AR合并急性上颌窦炎患者的nNO水平与鼻腔阻力呈负相关。Hou等[54]发现与健康受试者相比,部分鼻塞症状较重的AR患者的nNO水平显著降低,但部分鼻塞评分小于7分的AR患者的nNO水平较正常人显著升高。Ambrosino等[55]研究证实,慢性鼻窦炎合并鼻息肉患者的nNO水平较低,且与测试流速呈反比。因此,nNO对伴有鼻息肉、鼻窦炎或窦口阻塞的AR患者的检测准确性有待商榷。其他包括分析仪类型、测定时相关参数及方式、哮喘、年龄和吸烟等因素均不会影响nNO测定结果。
左旋精氨酸(L-arginine, L-Arg)可被体内的一氧化氮合酶(nitric oxide synthase, NOS)催化生成NO。NOS分为结构型NOS(constitutive NOS,cNOS)和诱导型(inducible NOS,iNOS)两种亚型。位于上皮细胞和神经元细胞的cNOS主要受细胞内钙离子调控,维持NO水平正常并参与体内生理活动[56]。iNOS主要存在于各类炎症细胞(如巨噬细胞、中性粒细胞等)、内皮细胞以及血管平滑肌细胞中,受IL-4、IFN-γ以及TNF等炎性因子调控。体内氧化应激反应(活性氧,reactive oxygen species, ROS)也可激活其转录因子,从而参与病理生理过程[57]。早在1999年,Kawamoto等[58]发现AR患者体内大量的NO可刺激鼻腔黏膜分泌大量黏液,造成黏膜损伤。有相关研究指出,NO可导致鼻黏膜上皮细胞纤毛运动弱化、某些细胞间连接缺失、间距增加,从而促使基底膜中断[59]。NO可抑制嗜酸性粒细胞凋亡[60],促进鼻腔黏膜血管扩张、血管通透性增加[61],导致更多炎症细胞浸润释放大量炎性因子,可进一步激活iNO表达释放NO,从而产生循环放大效果。过多的NO参与合成活性氮氧化物(reactive nitrogen oxide species,RNOS),RNOS可与含巯基的氨基酸(半胱氨酸、蛋氨酸)发生不可逆结合后使其灭活[62]。巯基是良好的还原剂,其大量的灭活促使体内更多ROS积聚,影响ATP的生成及相关细胞信号通路,导致呼吸道黏膜炎症反应等病理改变。由此可见,NO在体内参与并调控重要的炎症相关通路。
本研究也有一些局限性。纳入研究采用多种nNO测量技术,与评估哮喘的FeNO测试相比,目前还没有明确的测定nNO的标准化方法。因此,在数据统计过程中,本研究采用了不同的分析方法。通过使用SMD(Std. mean difference)代替MD(mean difference),采用RE(random effects)分析模式,而并非FE(fixed effects)模式,但异质性依然存在。异质性显著影响结果,虽然很难确定异质性的确切来源,但本研究推测了一些可能的来源:纳入的研究在不同国家进行,并设置了不同的纳入和排除标准,导致了不同的人口统计学和临床特征;很少有研究详细描述AR患者的症状;没有系统地进行皮肤点刺试验或特异性IgE试验区分病例与对照组;测定的仪器品牌及种类也不尽相同,测试持续时间也存在差异;nNO测定值与年龄也具有相关性。这些均可能导致结果的高度异质性。本研究发现可以显著影响nNO水平的因素是经鼻测定气流流速,不同的测定气流流速得到不同的nNO值,两者具有良好的相关性。因此认为经鼻气流流速可能会影响研究结果。回归分析结果表明随着测定时气体流速的增加,AR患者与对照组之间nNO水平的差异随之增加。提示需要适当的测定流速以体现AR患者和健康个体之间nNO值的差异。值得注意的是,Nesic等[63]发现测试流速在169.4 mL/min时测试结果具有较好的特异性及敏感度。相似的是,Wen等[53]认为测试流速在161.4 mL/min时可保证结果具备良好的特异性及敏感度。虽然存在仪器品牌及种类差异,但是否可以考虑对不同仪器设定正常参考值范围,以便于将数据转化为二分类变量,从而更好的用于研究和临床应用,这也可成为未来研究中一个待完善的领域。
综上所述,AR患者的nNO水平明显高于健康对照组,并且不受某些个体因素(如哮喘病史、吸烟史、年龄、地域种族等)的影响,因此具有无创、便携、相对稳定等优势的nNO测定技术值得推广应用。nNO可作为鉴别AR的参考指标,但测试之前应考虑鼻息肉、鼻窦炎和窦口阻塞等因素对测定结果的影响。nNO测定可用于AR的初筛。但其对AR病因的确定、对鼻喷糖皮质激素等抗炎药物有效性的判断和指导抗炎药物剂量的调整以及对AR病情和转归评估等潜在作用价值需要未来通过大量临床试验证实,以便于扩大其临床应用范围。
