浅谈溶液
2021-03-12叶建兴

摘要:溶液是生活中最常见的一种液体,本文主要通过介绍溶液的形成,溶液的浓度和溶解度以及电解质溶液来让人们对溶液有更深一层的了解和认识。
关键词:溶液 浓度 溶解度 电解质
我们在日常生活或化学实验活动中经常用到溶液,溶液是生活中最常见的一种液体。如果你去海里游泳的话,你会发现海水又苦又咸,因为海水中溶解了许多物质,它是一种溶液。
一、溶液的形成
许多物质在水中会分散开,溶解就是最常见的物质分散现象。如果我们把食盐放入水中,它会逐渐消失。为什么会出现这种情况呢?原来,食盐(主要成分是氯化钠)在水分子的作用下,会逐渐溶解并向水里扩散,最终均一地分散到水分子中,形成氯化钠溶液,这时氯化钠是以氯离子和钠离子的形式存在于水中。我们喝盐水的时候,发现它任意一部分的味道都是一样的,而且过了很长时间盐和水都不会分离,说明溶液是均一,穩定的混合物。溶液是由溶质和溶剂组成的,能溶解其他物质的物质叫溶剂,被溶解的物质叫溶质。例如刚提到的盐水,氯化钠被水给溶解掉,所以氯化钠是溶质,水是溶剂。溶质可以是固体,液体或者气体。水是重要的溶剂,但并不是唯一的溶剂,生活中常见的酒精,汽油也可以作为溶剂。
二、溶液的浓度
广义的浓度定义是溶液中的溶质相对于溶液的相对质量。在历史上由于不同的实践需要形成了名目众多的浓度表示方法。近年来,趋向于仅用一定体积的溶液中溶质的“物质的量”来表示浓度,即以mol(溶质)/L(溶液)为单位,称为“物质的量浓度”,并简称为“浓度”,可认为是浓度的狭义定义。然而,在目前的实践工作中,我们仍不能避免不同浓度表示法之间的互相换算。我们已经学过的浓度表示法有:
(1)“物质的量浓度”——每升溶液中溶质的“物质的量”,单位为mol/L,符号为c。
(2)质量分数,即溶质的质量对于溶液的质量的分数,符号为w。过去长期称为质量百分浓度,现正命名为质量分数。溶质的质量分数=溶质的质量/溶液的质量 X 100%
(3)摩尔分数——溶质B“物质的量”与溶液中溶质与溶剂总“物质的量”之比。即n(B)/n(总),符号用x(B)表示。
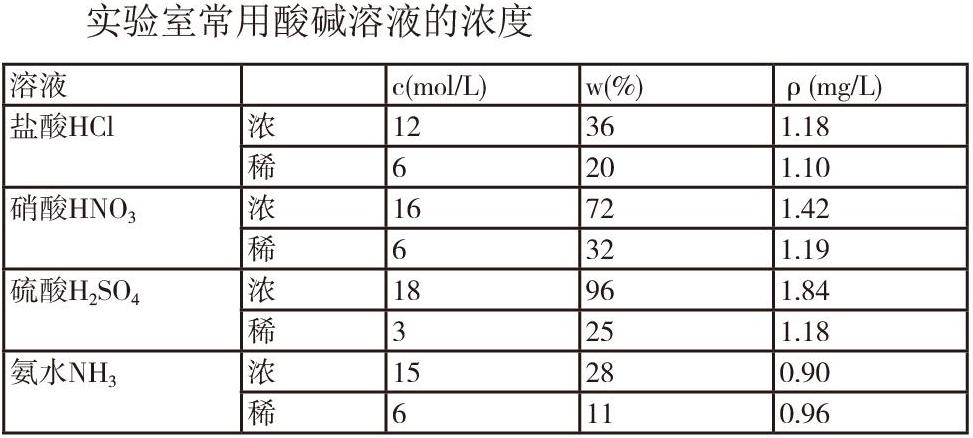
实验室常用酸碱溶液的浓度列在下表中:
三、溶解度
一定温度和压强下溶质在一定量溶剂中形成饱和溶液时,被溶解的溶质的量称为该溶质的溶解度。由于物质有不同的状态,固体的溶解度表示在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量。如果不指明溶剂,通常所说的溶解度是指物质在水里的溶解度。用实验的方法可以测出物质在不同温度时的溶解度。如下表:
气体的溶解度一般用单位体积的溶液中气体溶解的质量或物质的量表示,如用质量分数w,物质的量浓度c,质量摩尔浓度m表示。气体的溶解度与气体的分压明显有关,随气体分压增大,溶解度增大。因此,讨论气体溶解度时必须注明溶液的温度和气体的压强。
相似相溶原理
由于溶质与溶剂的品种繁多,性质千差万别,导致溶质与溶剂相互关系的多样性,因此,想得到溶解度的普遍规律是困难的。不过,溶解过程的一般规律是相似相容。具体的说:溶质分子与溶剂分子的结构越相似,相互溶解越容易。例如甲醇(CH3OH)和乙醇(C2H5OH)和水(HOH)都可以看做是羟基(—OH)和一个不大的基团联结的分子,结构相似,因此,它们之间可以互溶。而戊醇在水中几乎不溶,因为戊醇虽然也有羟基,却在分子结构中的地位下降,戊醇分子的另一半“CH3CH2CH2CH2CH2—”与水毫无相似之处。
四、电解质
我们曾经见过酸,碱,盐在水溶液中导电的实验现象,不仅如此,如果将氯化钠,硝酸钾,氢氧化钠等固体分别加热至熔化,它们也能导电。这种在水溶液里或熔融状态下能够导电的化合物叫做电解质。酸碱盐在水溶液能够导电,是因为它们在溶液中发生了电离,产生了自由移动的离子。例如,将氯化钠放入水中,在水分子的作用下,钠离子和氯离子脱离NaCl晶体表面,进入水中形成能够自由移动的水合钠离子和水合氯离子,这时氯化钠发生了电离。这一过程可以用电离方程式表示:NaCl == Na++ Cl-。同理,HCl与KOH的电离也可以用电离方程式表示:HCl==H++Cl-,KOH==K++OH-。
1887年,瑞典化学家阿伦尼乌斯根据电解质溶液对非电解质溶液的依数性的偏差和溶液导电性的实验事实提出了电离理论,其要点是:
(1)电解质在溶液中会自发电离成带电粒子,即离子。
(2)正负离子不停运动着,又会结合成分子。电解质只发生部分电离,电离的百分率称为电离度。
(3)溶液导电是由于离子迁移引起的,溶液中的离子越多,导电性越强。
广东省阳江市阳江职业技术学院附属阳东学校 叶建兴
