两步电沉积构建NiFe/Ni3S2/NF分级异质电极用于大电流密度析氧反应
2021-03-12张议洁刘乐然李晋平
张议洁 刘乐然 武 昀 赵 斐 刘 光 李晋平
(太原理工大学化学化工学院,气体能源高效清洁利用山西省重点实验室,太原 030024)
0 引言
利用太阳能、风能等可再生能源电解水制取氢气是将可再生能源转化为绿色氢能的有效手段,被认为是解决人类社会面临的能源危机和环境污染的终极解决方案之一[1-4]。电解水制氢具有零污染、低成本、所得氢气纯度高等优点,但其阳极析氧反应(OER)由于涉及复杂的4H+/4e-的转移和O—O键的形成,往往反应速率缓慢且需要较高的过电位[5],从而严重限制了整体电解水制氢效率,增大了能耗。目前,理想的OER电催化剂是贵金属氧化物IrO2和RuO2,但有限的储存、昂贵的价格及长程催化稳定性差限制了其广泛的应用[6-8]。因此,研发地球含量丰富、成本低、本征活性高的铁系金属(Fe、Co、Ni)催化剂是解决此类难题的关键[9-10]。然而,这些催化剂大多数只能驱动小电流密度的OER过程,大规模电解水制氢过程中需要更低过电位驱动更高的电流密度并具有长期稳定性的催化剂[11-13]。因此,如何实现廉价铁系金属在大电流密度下稳定催化OER仍是一个挑战。
铁系金属羟基氧化物(MOOH)由于具有化学稳定性好、组分可调以及廉价易得、环境友好等优点,已被广泛应用于OER催化电极的制备[9,14],其中NiFe双金属羟基氧化物由于金属中心间的强协同作用已被证明是最有效的电催化剂之一[15-16]。然而由于导电性能差、表面OER活性位暴露较少,限制了其大电流OER催化活性[17]。为了克服这些限制,目前科学家们已经采取了很多策略:(1)原位自生长NiFe基纳米材料,从而提高其结构稳定性[7,13,18];(2)引入晶格缺陷,使电催化剂表面富集暴露的活性位点、提高导电性能,进而提高其OER活性[19-22];(3)将NiFe基材料与导电材料复合[6-7,20]构建三维分级异质电极[23-25],也是直接提高其导电性、稳定性和活性表面积的一种简单而经济的方法[26]。另外,由于Ni3S2具有优异的导电性能[27],已被证明在小电流密度下对OER有效[28],其可以作为一种合适的三维导电基底来支持一些导电性较弱的催化活性相(如本文中的NiFe)[6]。此外,非晶态Ni3S2由于具有独特的无序结构和高密度的活性中心,从而表现出更优异的导电性和OER催化活性[19,29]。然而,目前报道的Ni3S2大多为晶态材料且合成过程复杂[27,29],因此采用更简便的方法制备非晶态Ni3S2材料并将其应用于OER电极仍有待研究。
因此,我们采用简单可控的一步电沉积法在泡沫镍(NF)上合成非晶态Ni3S2材料,进一步原位沉积富缺陷的NiFe双金属羟基氧化物(NiFe),从而构建了三维分级纳米异质电极(NiFe/Ni3S2/NF)。得益于非晶态Ni3S2和富缺陷NiFe双金属羟基氧化物的结构和催化优势及其界面协同效应,所制备的NiFe/Ni3S2/NF电极在1 mol·L-1KOH溶液中表现出优异的大电流OER催化性能。
1 实验部分
1.1 材料与试剂
硫脲 (CH4N2S,AR)、六水合氯化镍 (Ⅱ) (NiCl2·6H2O,AR)、九水合硝酸铁(Ⅲ)(Fe(NO3)3·9H2O,AR)、六水合硝酸镍(Ⅱ)(Ni(NO3)2·6H2O,AR)、氢氧化钾(KOH,AR)购自国药集团化学试剂有限公司。所有的化学物质均购买后直接使用,没有经过任何提纯处理。
1.2 Ni3S2/NF的制备
首先,将NF(厚度:2 mm)剪成3 cm×1 cm大小的薄片,用盐酸(1 mol·L-1)、去离子水和乙醇分别超声处理20 min,除去表面杂质,然后在80℃下烘干。处理后的NF、Ag/AgCl(饱和KCl溶液)和Pt柱分别作为工作电极(工作面积1 cm2)、参比电极和对电极,每次反应量取100 mL电解液,其中NiCl2·6H2O和硫脲的浓度分别为0.02和1 mol·L-1。采用循环伏安(CV)法在-1.2~0.2 V的范围内扫描30个循环,所得材料记为Ni3S2/NF。在电化学沉积后,将所制备材料用超纯水和乙醇多次洗涤,自然干燥备用。为了探索不同制备条件对材料的影响,还制备了一系列不同循环圈数(15、20、40)的催化剂,分别记为Ni3S2/NF-15、Ni3S2/NF-20、和Ni3S2/NF-40。
1.3 NiFe/Ni3S2/NF的制备
以Ni3S2/NF(循环30圈)为工作电极,每次反应量取 100 mL电解液,其中 Ni(NO3)2·6H2O 和 Fe(NO3)3·9H2O的浓度均为15 mmol·L-1。采用阴极恒电位法在-1.0 V的电压下沉积300 s,所得材料记为NiFe/Ni3S2/NF。在电化学沉积后,将所制备材料用超纯水和乙醇多次洗涤,自然晾干备用。为了探索不同制备条件对材料的影响,在保持金属总量不变的情况下,还制备了一系列不同镍、铁物质的量之比(nNi∶nFe=1∶2、2∶1)的催化剂(沉积时间 300 s)及一系列不同沉积时长(200、250、350 s)的催化剂(nNi∶nFe=1∶1),分别记为NiFe/Ni3S2/NF-200s、NiFe/Ni3S2/NF-250s和NiFe/Ni3S2/NF-350s。此外,根据反应前后NF的质量差计算得到电沉积NiFe/Ni3S2的质量密度为3.4 mg·cm-2。
1.4 参比样品的制备
Ni3S2/NiFe/NF电极:与NiFe/Ni3S2/NF制备方法相同,以NF为工作电极电沉积NiFe,沉积时间300 s;同上述制备方法,先在NF上电沉积NiFe,沉积时间300 s,再以NiFe/NF为工作电极通过CV法沉积Ni3S2(30个循环);RuO2/NF电极:通过Nafion粘合剂将3.4 mg RuO2涂覆在NF上。
1.5 材料的结构表征
本实验所制备样品分别通过X射线衍射仪(XRD,Bruker D8 Advance,CuKα射线,λ=0.154 18 nm,管电压 40 kV,管电流 40 mA,扫描范围 20°~80°)、拉曼光谱仪(InVia 1WU072,λ=532 nm,扫描范围100~1 500 cm-1)、扫描电子显微镜(SEM,SU8010,电压3.0 kV)、透射电子显微镜(TEM,JEOL 2010FEF,场发射电压200 kV)、X射线光电子能谱仪(XPS,VG ESCALAB250,AlKα射线,电压和电流分别为12.5 kV和16 mA)进行表征。
1.6 OER性能测试
OER电化学性能通过三电极体系进行测试,以1 mol·L-1KOH(pH=13.6)作为电解液,所制得电极作为工作电极,Ag/AgCl(饱和KCl溶液)电极作为参比电极,Pt柱作为对电极。极化曲线(LSV)测试窗口为0~2 V(vs RHE),扫速为1 mV·s-1。此外,电化学阻抗谱(EIS)测试的电位为1.6 V(vs RHE),频率设置为106~0.05 Hz。计时电位曲线测试选取电流密度为1 000 mA·cm-2,时间为27 h。上述电化学测试的电位均需校正为标准氢电极,并进行电位补偿:E(vs RHE)=E(vs Ag/AgCl)+0.059pH+0.197,E=E(vs RHE)-0.95iR,式中E为iR补偿后的电位(V),i为电流(A),R为溶液阻抗(Ω)。Tafel曲线是由LSV曲线线性拟合所得。
2 结果与讨论
如图1A所示,首先采用CV法在三维多孔的NF表面原位沉积Ni3S2作为导电基底(Ni3S2/NF),之后在Ni3S2/NF表面原位生长NiFe双金属羟基氧化物(NiFe)作为OER活性相,从而构建了NiFe/Ni3S2/NF三维分级纳米异质电极。为了系统地探讨各纳米材料在OER催化中的作用,还制备了Ni3S2/NF、NiFe/NF及Ni3S2/NiFe/NF电极。
首先通过SEM和TEM对NiFe/Ni3S2/NF的形貌进行研究。如图1B所示,可以明显看到第一步电沉积后NF表面成功负载了垂直生长且相互交联的Ni3S2纳米片(厚度约10 nm),相互连接的Ni3S2纳米片进一步聚集成直径约为1 μm的微球。由于纳米片的相互交联,形成了多孔的3D网状结构,值得注意的是,材料表面还存在着许多纳米级裂缝。这些独特的纳米结构不仅有利于电子和质量的快速传递[27,29-30],增强其稳定性,同时增大了材料的比表面积,从而为表层材料的生长提供了更大的表面积[6,31]。在Ni3S2/NF催化电极表面沉积NiFe后(图1C),可以看到Ni3S2/NF催化电极的独特纳米结构完全保留,且细小的NiFe纳米颗粒均匀地分散在相互交联的Ni3S2纳米片的表面。从而构成了独特的多孔三维分级电极,该结构不仅提高了电极的化学和结构稳定性,还有助于增加电极表面的粗糙度,从而加速电解质的扩散和气体产物的脱附[19-20,32]。

图1 (A)构建NiFe/Ni3S2/NF分级异质电极的流程示意图;(B)Ni3S2/NF和(C)NiFe/Ni3S2/NF的SEM图Fig.1 (A)Schematic for fabrication process of NiFe/Ni3S2/NF hierarchical heterogeneous electrode;SEM images of(B)Ni3S2/NF and(C)NiFe/Ni3S2/NF
TEM图(图2A)进一步证实该电极为分级结构,并且可以清晰地看到NiFe纳米颗粒由多层超薄纳米片构成[33]。且在放大的TEM图中(图2B),可以看到清晰的界面,分别对应为外层NiFe羟基氧化物(图2D)和内层Ni3S2(图2E)。值得注意的是,外层所测晶格间距0.149、0.209和0.242 nm分别对应NiOOH的(310)、(210)和(101)晶面,同时可以看到其晶格条纹不连续(例如图2D红色圈中),表明存在非晶区域及较多空位缺陷和较多不饱和键[20,34],从而增加了暴露活性中心的数量,显著提高了催化活性[21]。内层所测晶格间距0.250 nm对应为NiO的(111)晶面。没有出现明显的Ni3S2晶格条纹,表明成功合成了非晶态Ni3S2材料,且相对应的选区电子衍射(SAED)图(图2C)再次验证其为多晶材料。此外,X射线能谱分析(EDS)(图S1,支持文件)和元素映射(图 2F)进一步表明该化合物中存在 Ni、Fe、O、S 元素,且S元素主要存在于内部区域,而Ni、Fe和O元素均匀地分散在整个分级结构中,表明了外层NiFe完全包裹了Ni3S2纳米片,最终形成了分级核壳结构。
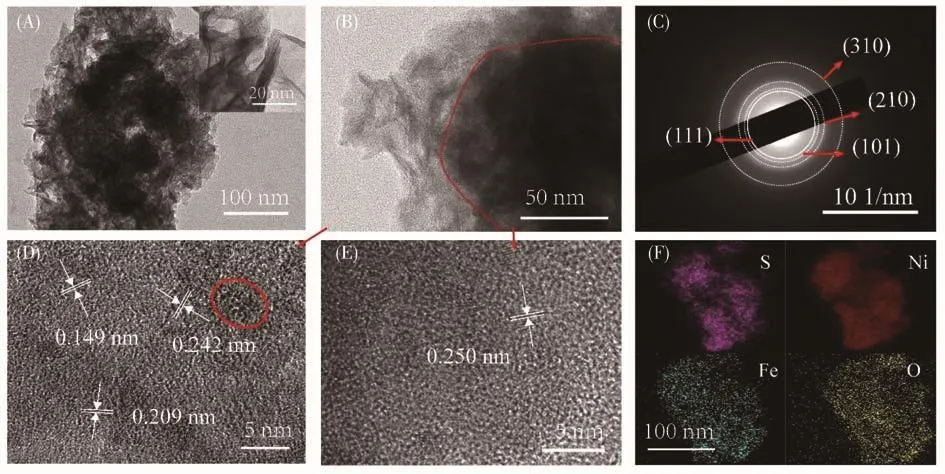
图2 (A、B)NiFe/Ni3S2/NF不同放大倍数的TEM图(标尺:100和50 nm);(C)NiFe/Ni3S2/NF的SAED图(标尺:10 nm-1);(D)外层NiFe和(E)内层Ni3S2的HRTEM图(标尺:5 nm);(F)S、Ni、Fe和O的元素映射图(标尺:100 nm)Fig.2 (A,B)TEM images of NiFe/Ni3S2/NF at different magnifications(scale bar:100 and 50 nm);(C)SAED image of NiFe/Ni3S2/NF(scale bar:10 nm-1);HRTEM images of(D)outer NiFe and(E)inner layer Ni3S2(scale bar:5 nm);(F)Element mappings of S,Ni,Fe and O(scale bar:100 nm)
对样品进行了XRD及拉曼光谱分析以研究其物质组成。如图3A所示,XRD图中主要的3个衍射峰 44.62°、51.97°和 76.48°与镍的标准卡片(PDF No.04-0850)匹配,并没有出现其他衍射峰,这可能是由该材料存在的富缺陷及无序结构引起的[20,33]。图3B显示了NiFe/Ni3S2/NF的拉曼光谱图,可以看到Ni3S2/NF的拉曼光谱图上有明显的8个峰,其中位于188、201、219、305、322和350 cm-1处的拉曼峰对应Ni3S2的特征峰[6,19],证明了Ni3S2材料的成功制备。对比晶态Ni3S2,可能由于无序结构的存在,使得其特征峰红移[19]。另外,在514和1 065 cm-1处的拉曼峰为NiO的特征峰[35],这是由CV电沉积过程中阳极氧化所产生的[36]。NiFe/NF的拉曼光谱图上有明显的3个峰,其中685 cm-1处的拉曼峰归因于FeOOH中的Fe—O振动[37-38],477和561 cm-1处的拉曼峰归因于NiOOH中的Ni—O振动[35-36,39],可能由于Fe的存在,极大地改变了Ni—O的局部环境,使得Ni—O峰蓝移[39]。在Ni3S2/NF上沉积NiFe后有明显的4个拉曼峰,分别对应NiOOH(2个峰)、FeOOH和NiO。相较于NiFe/NF,发现NiFe/Ni3S2/NF中NiOOH峰变强,推测是由异质界面的相互作用促进NiOOH的生成所引起的[19,35,39]。以上结果充分表明该材料外层主要由富缺陷NiOOH和非晶态FeOOH组成,内层主要由非晶态Ni3S2及微量NiO组成,从而形成了分级异质电极。值得注意的是,NiO也被认为具有OER活性[35,40],且有研究表明FeOOH的存在有助于低价Ni转化为活性相NiOOH[35,41-42],这可能有助于提高NiFe/Ni3S2/NF电催化剂的OER性能。
由于OER过程主要发生在电极表面,对NiFe/Ni3S2/NF进行了XPS分析(图3C~3F),表明电极表面存在Ni、Fe、O、S元素且原子比为20.68∶12.34∶64.22∶2.76(图 S2)。Ni2p的光谱图(图 3C)可分为7个峰,其中位于852.3 eV处的峰对应Ni0,855.2和872.8 eV处的峰对应Ni2+,而856.6和874.6 eV处的峰对应Ni3+,表明电极表面存在多种价态的Ni。在Fe2p光谱图中(图3D),位于712.3和724.9 eV处的峰对应Fe3+,而710.3和723.5 eV处的峰对应Fe2+,可以看出Fe主要以Fe3+形式存在。此外,图3E为O1s的光谱图,位于529.6、530.9和532.5 eV处的峰可分别归属于M—O、不饱和配位氧[43-44]和O—H[19,45],从而表明富氧空位的MOOH的合成。在S2p光谱图中(图3F),位于161.6、163.0和168.2 eV处的峰分别对应S2-和SOmn-,其中 SOm n-的存在可能是由表面氧化所引起的[46-47]。

图3 Ni3S2/NF、NiFe/NF和NiFe/Ni3S2/NF的(A)XRD图和(B)拉曼光谱图;(C)Ni2p、(D)Fe2p、(E)O1s和(F)S2p的XPS谱图Fig.3 (A)XRD pattern and(B)Raman spectra of Ni3S2/NF,NiFe/NF and NiFe/Ni3S2/NF;XPS spectra of(C)Ni2p,(D)Fe2p,(E)O1s and(F)S2p
接下来,我们研究了NiFe/Ni3S2/NF、Ni3S2/NiFe/NF、NiFe/NF、Ni3S2/NF 和纯 NF 电极在 1 mol·L-1KOH碱性电解液中的OER性能,同时对比了商用OER催化电极RuO2/NF的性能。NiFe/Ni3S2/NF、Ni3S2/NiFe/NF、NiFe/NF、Ni3S2/NF、RuO2/NF和NF电极的LSV曲线均表现出显著的OER催化活性(图4A),其中NiFe/Ni3S2/NF的催化活性最好。经对比可知(图4B),NiFe/Ni3S2/NF仅需273 mV的过电位可达到100 mA·cm-2的电流密度,而其他催化电极分别需要281、289、364、407和559 mV的过电位。值得注意的是,NiFe/Ni3S2/NF可以在较低过电位下驱动更高的电流密度 (η1000=372 mV)。 NiFe/Ni3S2/NF、Ni3S2/NiFe/NF、NiFe/NF、Ni3S2/NF、RuO2/NF和NF催化电极的 Tafel斜率分别为 48.33、63.75、69.00、122.96、158.00和339.98 mV·dec-1(图4C),其中NiFe/Ni3S2/NF的Tafel斜率最小。分析OER机理可知,OER过程按照*OH→*O→*OOH→O2的顺序,通过与活性位点相关的4个基本步骤进行,其中*代表活性位点[48]。且根据之前的研究发现,当Tafel斜率的值在30~80 mV·dec-1时,更有利于在催化剂表面形成*OH[6,49]。由此可知,其相对较小的Tafel斜率可能是由于催化剂表面的无序和缺陷提高了羟基的吸附能力[22,44,49]。同时,图4D显示了各催化电极的Nyquist图,其中NiFe/Ni3S2/NF的电荷转移电阻(Rct)仅为0.27 Ω,明显低于其他电极,表现出理想的电子传输能力和催化动力学,从而导致其具有更小的Tafel斜率。
上述结果充分证明NiFe双金属羟基氧化物具有非常高的本征OER催化活性,但是其差的导电性限制了内部电子结构的调节,从而限制了其催化活性,而Ni3S2的存在能弥补这一缺陷。比较本文中构造的3个基于NiFe的催化电极(图4A、4E),发现在相对较小的电流密度(100、500 mA·cm-2)下,过电位大小顺序为 NiFe/Ni3S2/NF<Ni3S2/NiFe/NF<NiFe/NF;然而,在较高电流密度(1 000 mA·cm-2)下,过电位大小顺 序 为 NiFe/Ni3S2/NF<NiFe/NF<Ni3S2/NiFe/NF。 这是因为在低电流密度下,NiFe与Ni3S2的强电子相互作用[19],使得其OER活性得到提升。但随着电流密度的增加,由于Ni3S2位于OER活性相NiFe的表层,覆盖了其催化活性位点,降低了其OER性能。然而,Ni3S2作为三维分级异质电极的基底时,其独特的纳米结构为活性相NiFe材料的生长提供了更大的表面积,从而增加了表面暴露的活性位点;同时其良好的导电性有助于快速的电子和质量传递,从而大大地提高了NiFe羟基氧化物的OER催化活性[6,31]。
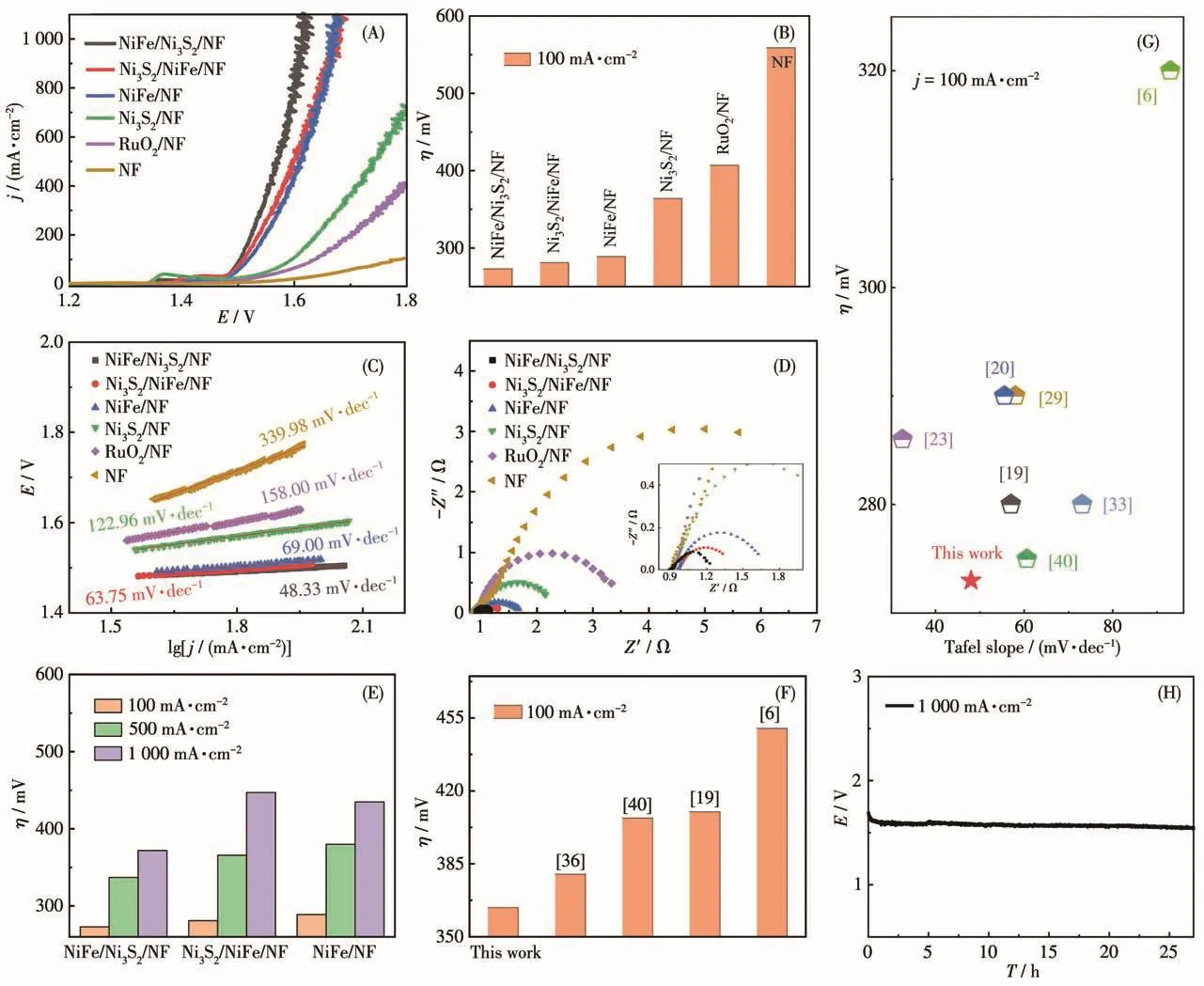
图4 (A)催化电极在1 mol·L-1KOH中的LSV曲线;(B)在100 mA·cm-2电流密度下过电位的比较;(C)Tafel斜率;(D)Nyquist图;(E)NiFe/Ni3S2/NF、Ni3S2/NiFe/NF和NiFe/NF催化电极的OER性能比较;(F)不同制备方法所得的Ni3S2/NF催化剂的OER性能比较;(G)NiFe和Ni3S2复合材料的OER性能比较;(H)NiFe/Ni3S2/NF在1 000 mA·cm-2电流密度下的稳定性测试Fig.4 (A)LSV curve of each catalytic electrode in 1 mol·L-1KOH;(B)Comparison of overpotential at a current density of 100 mA·cm-2;(C)Tafel slope;(D)Nyquist polts;(E)Comparison of OER performance of NiFe/Ni3S2/NF,Ni3S2/NiFe/NF and NiFe/NF catalytic electrodes;(F)Comparison of OER performance of Ni3S2/NF catalysts obtained by different preparation methods;(G)Comparison of OER performance NiFe and Ni3S2composites;(H)Stability test of NiFe/Ni3S2/NF under 1 000 mA·cm-2current density
此外,我们还探索了不同CV圈数对Ni3S2/NF材料在100 mA·cm-2电流密度下的过电位的影响(图S3),发现循环30圈时Ni3S2/NF电极的OER性能(η100=364 mV)明显优于 Ni3S2/NF-15(η100=398 mV)、Ni3S2/NF-20(η100=381 mV)和 Ni3S2/NF-40(η100=371 mV)电极。为探索该情况出现的原因,对其进一步表征,发现不同循环圈数对应的材料组成无明显差异(图S4),但其形貌存在明显差异。如图S5所示,随着循环的增加,Ni3S2纳米片之间不断填充新生成的Ni3S2,从而形成更多孔致密的三维网状结构。当循环圈数增加到40圈时,Ni3S2的纳米片结构已完全消失,相互交联的三维网状结构转变为存在裂缝的膜层结构。由此可知,循环30圈时,Ni3S2/NF电极表面具有最多的活性中心,同时保留了多孔三维网状结构,因此具有最优异的OER性能。同时比较了我们采用CV法制备的Ni3S2与近期报道的水热-电沉积-硫化法[36]、溶剂热法[40]、恒电流电化学沉积法[19]和传统水热法[6]所得Ni3S2催化剂的OER性能(图4F)。在100 mA·cm-2电流密度下,我们制备的Ni3S2/NF电极的过电位为364 mV,其他方法所得Ni3S2/NF催化剂的过电位分别为380、407、410和450 mV,上述结果充分说明我们所制备的非晶态Ni3S2/NF催化剂的性能更为优越。
以OER性能最优的Ni3S2/NF为基底(循环30圈),研究不同nNi∶nFe和沉积时长对材料的影响。如图S6a所示,通过LSV曲线可以看出nNi∶nFe=1∶1时具有最优的OER催化性能,且发现沉积时长为300 s时NiFe/Ni3S2/NF的OER性能(η100=273 mV)明显优于 NiFe/Ni3S2/NF-200s(η100=295 mV)、NiFe/Ni3S2/NF-250s(η100=283 mV) 和 NiFe/Ni3S2/NF-350s(η100=277 mV)(图S6b)。进一步表征表明,nNi∶nFe为1∶1且沉积时长为300 s时,NiFe/Ni3S2/NF表面具有最均匀且完全的覆盖,同时保留了多孔三维分级结构(图S7、S8)。因此,NiFe/Ni3S2/NF分级异质电极具有更低的过电位和 Tafel斜率(图 4G)[6,19-20,23,29,33,40]。
此外,电催化剂的稳定性直接决定了催化剂能否在实际中得到应用。如图4H所示,通过观察在1 000 mA·cm-2固定电流密度下的电位波动来测试其稳定性。经过一段时间的测试后,其OER电位趋于稳定,并在1.6 V下持续稳定运行。经过27 h的稳定性测试后,只检测到极小的电位下降,表明所制备的NiFe/Ni3S2/NF电极具有良好的稳定性。
为了进一步证实NiFe/Ni3S2/NF催化电极的稳定性,在稳定性测试后对其进行了组成和结构表征。图5A和5B显示了稳定性测试前后的XRD图和拉曼光谱图,发现NiFe/Ni3S2/NF催化电极在稳定性测试前后的成分并无明显变化。其中NiO拉曼峰变弱可能是由于FeOOH的存在,使得NiO在OER过程中转化为活性相NiOOH[35,41],这与计时电位法测试(图4H)过程中观察到的电位下降相一致。另外,从OER稳定性测试后的SEM图(图5C、5D)中可以明显看到,材料表面聚集的微球消失,其形貌变成了多孔交织的纳米棒结构,从而暴露出更多的OER活性位点[11]。TEM图进一步表明该电极仍为分级结构(图5E),且对应区域的SAED图(图5F)表明稳定性测试后存在的晶体成分主要为NiOOH,且(210)晶面的对应衍射环变强,进一步表明OER过程中促进了活性相NiOOH的生成。

图5 NiFe/Ni3S2/NF稳定性测试(A)前(B)后的XRD图和拉曼光谱图;(C、D)NiFe/Ni3S2/NF稳定性测试后不同放大倍数的SEM图(标尺:5和1 μm);(E)NiFe/Ni3S2/NF稳定性测试后的TEM图;(F)NiFe/Ni3S2/NF稳定性测试后的SAED图(标尺:10 nm-1)Fig.5 XRD pattern and Raman spectra of NiFe/Ni3S2/NF(A)before and(B)after stability test;(C,D)SEM images of NiFe/Ni3S2/NF after stability test in different magnifications(scale bar:5 and 1 μm);(E)TEM images of NiFe/Ni3S2/NF after stability test;(F)SAED image of NiFe/Ni3S2/NF after stability test(scale bar:10 nm-1)
此外,通过XPS对NiFe/Ni3S2/NF的表面元素组成及化合态的变化进行了分析,如图6A所示,稳定性测试后S的XPS特征峰明显变弱,推测其可能是由OER过程中近表面硫化物转化为活性相NiOOH引起的[50]。在Fe的XPS谱图中(图6B),可以看到Fe2p峰发生了明显的偏移,表明Fe向更高的价态发生了转化[31],同时发现Fe2p特征峰变弱,表明OER过程中FeOOH部分溶解,从而导致其形貌转变为多孔交织的纳米棒阵列,这与之前的报道相同[11]。而Ni2p特征峰(图6C)也发生了微弱的变化,同时发现Ni0峰消失,表明OER过程中近表面的低价Ni向活性相NiOOH原位发生了转化,这与前面的结论相一致。
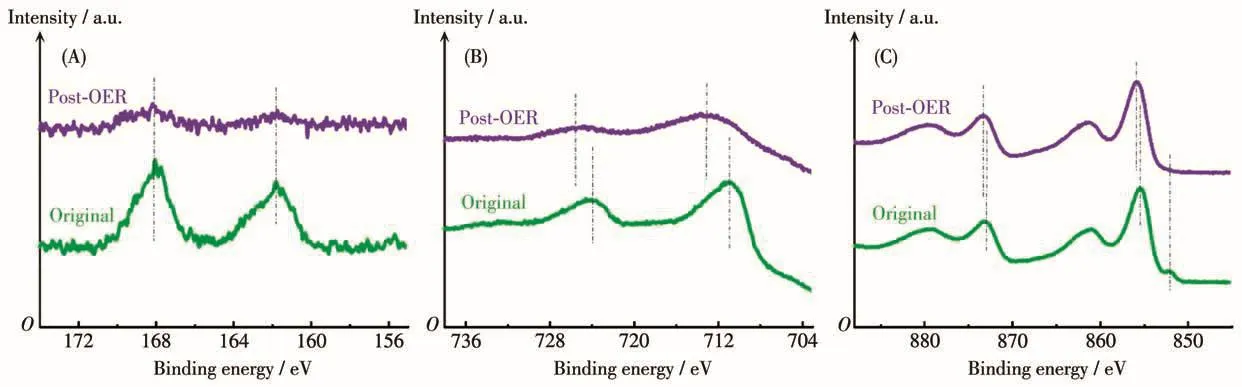
图6 NiFe/Ni3S2/NF稳定性测试前后(A)S2p、(B)Fe2p和(C)Ni2p的XPS谱图Fig.6 XPS spectra of(A)S2p,(B)Fe2p and(C)Ni2p of NiFe/Ni3S2/NF before and after stability test
综上所述,构建的NiFe/Ni3S2/NF三维分级异质电极的优异OER性能可归因于以下几个方面:(1)外层富缺陷NiOOH及非晶态FeOOH作为所构建催化电极的活性相具有高本征OER催化活性,同时具有化学稳定性好、活性位点丰富等优点;(2)非晶态Ni3S2具有的高导电率有利于电子和质量的快速传递,从而大大地提高了NiFe材料的OER催化活性;(3)独特的多孔三维分级结构有助于电解质的扩散和气体产物的脱附,从而提高了电极的化学和结构稳定性;(4)异质界面的强电子相互作用促进了OER活性相NiOOH的生成;(5)OER过程中原位生成的NiOOH进一步提高了该电极的OER活性。
3 结论
通过简便的两步电沉积法在泡沫镍表面将非晶态Ni3S2材料与富缺陷的NiFe双金属羟基氧化物有效复合,从而构建了NiFe/Ni3S2/NF三维分级纳米异质电极。受益于非晶态Ni3S2和富缺陷NiFe的结构和催化优势,使得所构建的NiFe/Ni3S2/NF三维分级异质电极具有更多暴露的OER活性位点、高本征活性、快速转移电子和质量能力及足够的化学和结构稳定性。同时异质界面的协同作用以及OER过程中原位生成的NiOOH进一步提高了该电极的OER活性:在1 mol·L-1KOH溶液中,NiFe/Ni3S2/NF电极达到100 mA·cm-2时的过电位仅为273 mV,更重要的是该电极可以在372 mV过电位下驱动1 000 mA·cm-2的电流密度达27 h以上。这种快速、易得的纳米异质结构OER电极的制备策略将为廉价铁系金属催化材料实现大电流电解水提供重要的技术依据。
Supporting information is available at http://www.wjhxxb.cn
