Argonaute蛋白在植物逆境胁迫响应中的功能
2021-03-12蒲伟军谭冰兰朱莉
蒲伟军, 谭冰兰, 朱莉
(中国农业科学院生物技术研究所, 北京 100081)
Argonaute (AGO)蛋白是一类RNA结合蛋白,在sRNA介导的基因沉默中起关键作用。其在转录及转录后水平参与基因表达的调控,维持基因组完整性。作为RNA 诱导沉默复合体(RNA-induced silencing complex, RISC)的核心蛋白,AGO蛋白是表观遗传调控的主要参与者,在RNAi 中通过剪切靶向mRNA、翻译抑制、DNA 甲基化等方式发挥作用[1]。近年来,有关植物中AGO 蛋白的研究日益增多,主要集中在AGO 蛋白的生物学功能及其结合的sRNA 类型等方面。不同类型sRNA 结合特定的AGO蛋白,在植物生长发育和逆境胁迫响应中发挥重要作用。本文综述了AGO 蛋白的结构特征、分类、作用模式及其在植物逆境响应中的生物学功能,旨在为今后深入研究植物AGO功能提供理论基础。
1 植物Argonaute蛋白结构特点和分类
AGO蛋白在拟南芥突变体ago1中首次被发现,因突变株形状如“八爪鱼”,故命名为Argonaute[2]。该蛋白普遍存在于生物有机体中,相对分子质量较大(约为105)、家族成员庞大,是sRNA介导的沉默复合体(RISC)的核心元件。AGO蛋白属于多结构域蛋白,由可变N端、PAZ(PIWI Argonaut and Zwille)、MID和PIWI(P-element induced wimpy testis)等结构域组成(图1)。其中,PAZ结构域是sRNA的结合位点,识别并结合sRNA突出的2 nt的3’-端;MID形成像“口袋”一样的结构,结合sRNA 5′-磷酸端,将sRNA 锚定在AGO蛋白上;PIWI结构域具有内切酶的活性,能够切割并降解靶mRNA,PIWI内存在保守的活性位点Asp-Asp-His (DDH motif),可能与其催化活性有关[1]。此外,在AGO蛋白结构中还发现存在其他较为保守的基序(motif)如ArgoL1(argonaute linker 1)、ArgoL2(argonaute linker 2)以及Gly-rich_Ago1(glycine-rich region of Ago1)等,这些基序在不同AGO蛋白中的位置、有无及功能间存在差异。有研究表明,SiAGO1b的C端基序是调控谷子生长发育和应激反应所必需的[3]。

注:Gly-rich—富含甘氨酸的区域;ArgoN—N末端结构域; L1—连接肽1结构域;PAZ—PAZ结构域;L2—连接肽2结构域;Mid—中间结构域;PIWI—PIWI结构域; ◆—预测活性位点。Note: Gly-rich—Glycine-rich region; ArgoN—N-terminal domain; L1—Argonaute linker 1 domain;PAZ—PAZ domain;L2—Argonaute linker 2 domain; Mid—Mid domain of argonaute;PIWI—PIWI domain; ◆—Predicted active site.图1 Argonaute蛋白结构Fig.1 Structure of Argonaute protein
目前,除了酿酒酵母外,AGO蛋白在所有真核生物、细菌和古细菌中均存在,是一类数目庞大的家族。编码AGO蛋白的基因在不同物种中差异很大,从粟酒裂殖酵母(Schizosaccharomycespombe)中的1个到秀丽隐杆线虫(Caenorhabditiselegans)的27个[1]。目前,已经在18个植物物种中鉴定到不同数量的AGO家族成员,其中,黄瓜(Cucumissativus)中数量最少,只有7个,拟南芥 (Arabidopsisthaliana)中有10个,油菜(Brassicanapus)中最多,有27个, 表明植物中AGO家族成员的数量在物种间存在差异[4-6]。
根据系统进化以及AGO蛋白结合的sRNA 类型可将AGO家族分为3 个亚族,即AGO-like、PIWI-like 和Group 3,目前植物中发现的AGO蛋白均属于AGO-like亚家族[7]。从系统发育的角度又将这些蛋白分成3个主要的亚类:AGO1/5/10、AGO2/3/7和AGO4/6/8/9[8]。其中,AGO18b是禾本科植物所特有的,在花序分生组织发育和病毒防御方面发挥着重要作用[9-10]。
2 植物AGO蛋白作用模式
由于植物AGO基因序列在进化过程中发生大量重复和缺失,导致该家族不断扩大,功能呈现多样化[7]。AGO蛋白的功能多样化很有可能与内源性sRNA介导的RNA沉默通路的特化和进化过程有关。植物AGOs与sRNA的关联主要是基于sRNA的5’-核苷酸序列和/或sRNA双链和AGO蛋白PIWI结构域的序列和结构特征。植物AGO-sRNA复合物可通过不同的方式沉默与之互补的DNA或RNA,发挥其生物学作用。不同AGO蛋白和特定sRNA之间的互作可将植物RNAi通路分为转录基因沉默(transcriptional gene silencing, TGS)和转录后基因沉默(post-transcriptional gene silencing, PTGS)。其中,AGO4/6/9主要参与TGS, 而AGO1/2/3/5/7/10则主要参与PTGS[11-12]。
植物AGOs的作用模式可归纳为七种(图1)[1]:① 核苷酸内切。AGO蛋白的PIWI结构域可利用内源性类RNAse H活性来切割靶向RNA。现已发现几种,如拟南芥 AGO1、AGO2、AGO4、AGO7和AGO10均可结合sRNAs并切割与之序列高度互补的靶标RNA,切割产物被内源性降解途径的组分降解。此外,植物AGOs的切割活性也是触发某些目标转录本中phasiRNAs(phased small-interfering RNAs)扩增的必要条件。② 翻译抑制。拟南芥AGO1和AGO10等与miRNA结合,并以序列高度互补的RNA为靶点,抑制其翻译。近期研究表明,AGO7-miR390如结合到TAS3a非编码转录本中的一个不可切割的miR390靶位点,会导致核糖体堆积,进而抑制翻译延伸。然而,通过结合AGO-miRNA复合体来直接阻断核糖体运行,这种由植物miRNA介导的翻译抑制的贡献似乎有限。③ 典型RdDM(RNA-directed DNA methylation)途径。DNA甲基化可调控基因表达,阻断转座子发生转座,从而维持基因组的完整性。在植物中,典型的DNA甲基化主要是在AGO4-siRNA复合物介导的依赖于RNA的RdDM途径中发挥作用。④ miRNA螯合。研究发现,拟南芥AGO10、水稻AGO18可分别螯合来自AGO1的miR165/166、miR168和miR528,进而调控茎尖分生组织发育和防御病毒。⑤ 双链断裂修复(DSB)。拟南芥AGO2与DSB诱导的siRNAs(diRNAs)结合,介导DSB修复。⑥ siRNA生成不依赖于DCL(dicer-like)蛋白。DCL是siRNA产生的关键因素,而AGO4可以与初生的Pol II RNA结合,再经由3’-5’外切酶剪切产生siRNAs,该过程不需要DCL蛋白的参与。⑦miRNA基因表达的协同转录调控。在盐胁迫下,AGO4指导新生miR161或miR173前体的切割,以协同转录方式调控miRNA的产生。随着研究的不断深入,将进一步发掘出AGO蛋白新的作用模式。
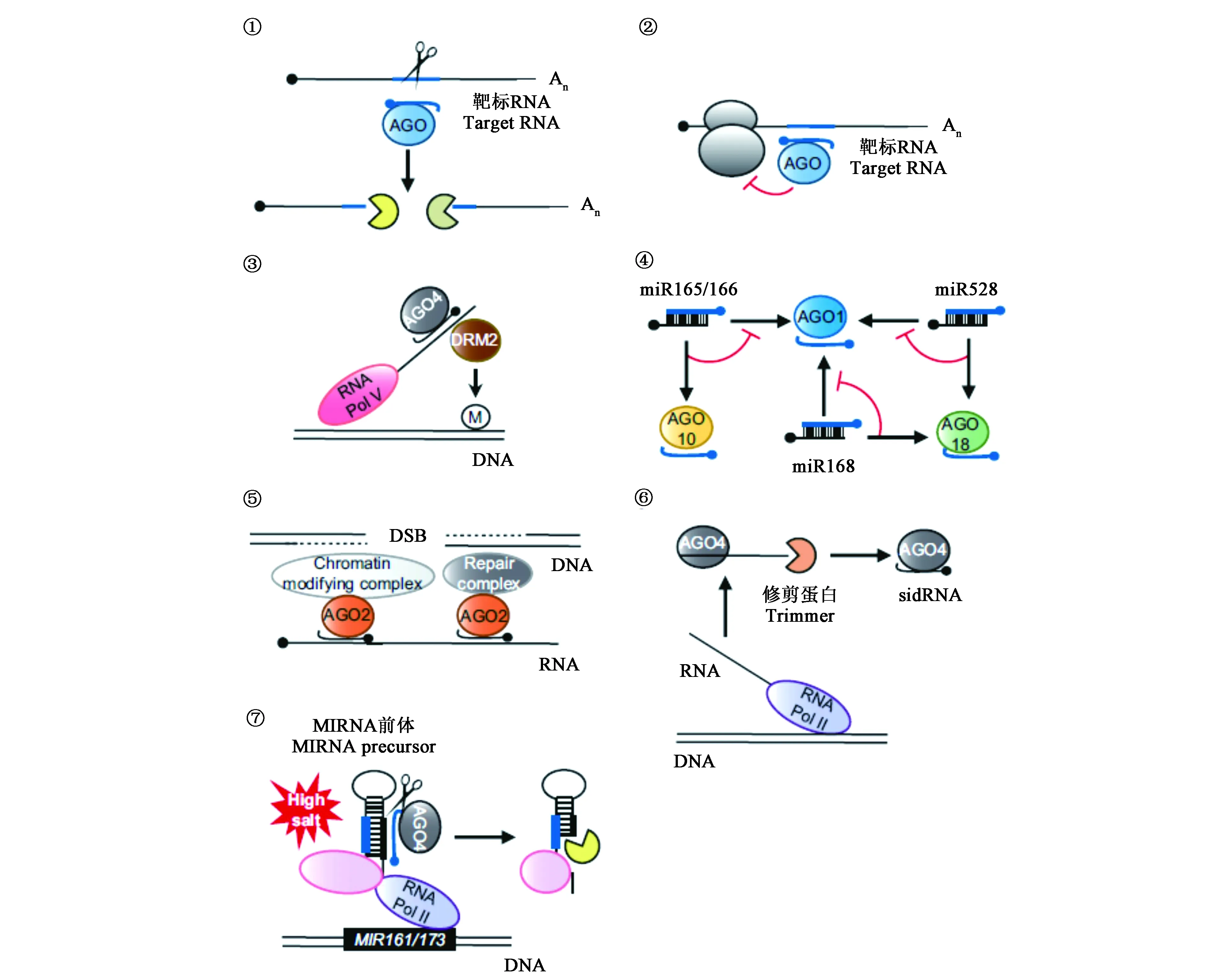
注:①核苷酸内切;②翻译抑制;③经典RdDM途径;④ microRNA螯合;⑤双链断裂修复(DSB);⑥不依赖DCL的siRNA生物发生;⑦ miRNA基因表达的协同转录调控。Note: ① Endonucleolytic cleavage; ② Translational repression; ③ Canonical RdDM pathway; ④ MiRNA sequestration; ⑤ Double-stranded break repair (DSB); ⑥ DCL-independent siRNA biogenesis; ⑦ Cotranscriptional regulation of miRNA gene expression.图2 植物AGO蛋白的作用模式[1]Fig.2 Modes of action of plant AGO protein[1]
3 AGO蛋白在植物逆境胁迫响应中的功能
近年来,有关AGO蛋白在植物逆境胁迫响应中的功能一直是研究热点之一。病虫害、极端温度、盐碱、干旱和营养缺乏等逆境胁迫是限制植物地理分布和作物产量的主要因素。为了减少这些逆境胁迫的不利影响,植物已经进化出了特定的机制得以生存。其中,microRNA (miRNA)介导的基因表达调控是植物应对生物和非生物胁迫的重要机制之一[13]。而AGO蛋白作为RISC的核心元件,是miRNA功能通路的关键组分,不仅参与植物生长发育的调控,还参与调控植物逆境胁迫的应答。植物AGO蛋白的生物学作用简要归纳如表1所示。
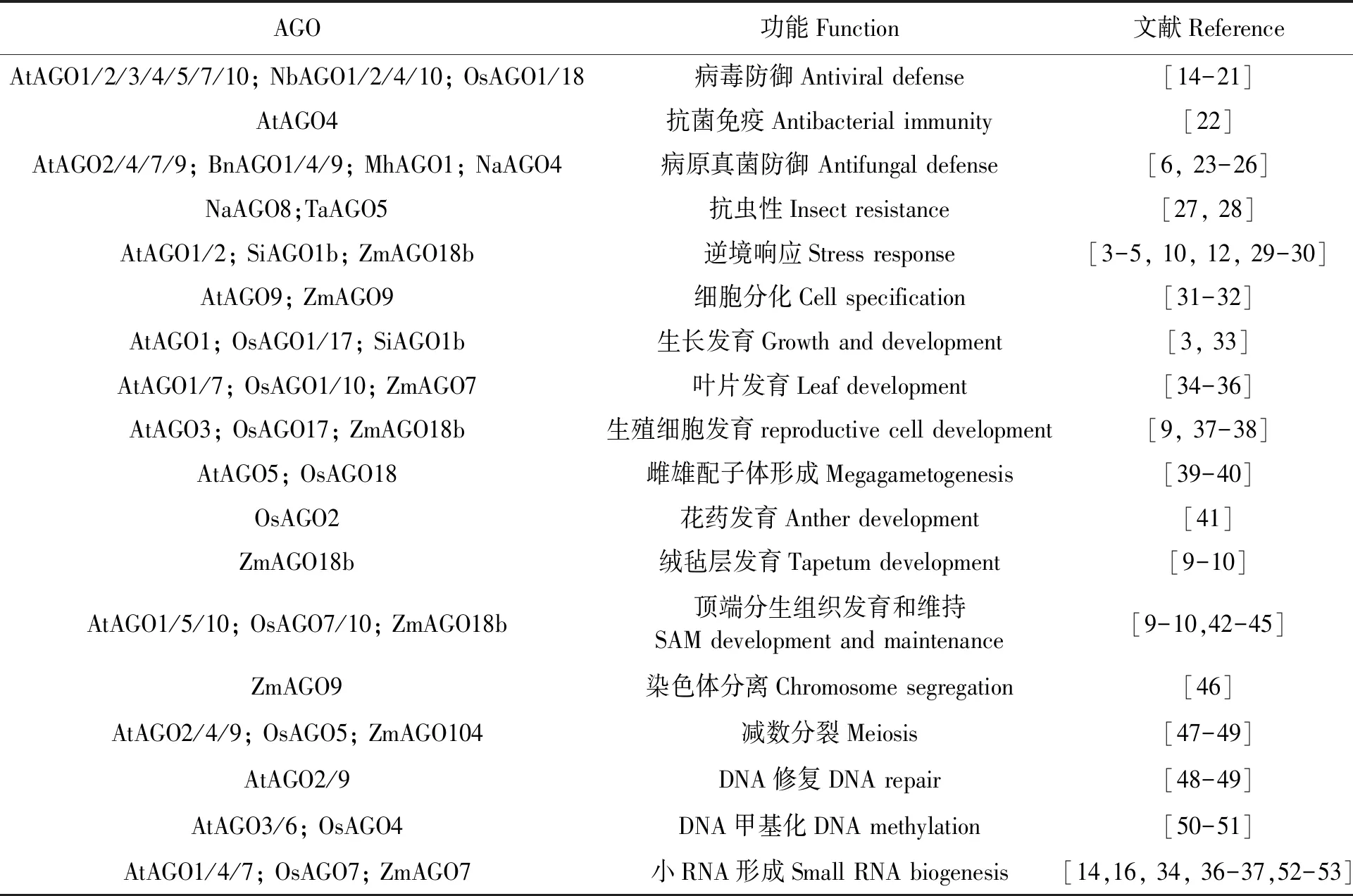
表1 植物AGO蛋白的生物学功能Table 1 Biological functions of plant AGO proteins
3.1 AGO蛋白在植物响应生物胁迫中的生物学功能
自然界中各种生物和非生物逆境胁迫对植物生长、发育和产量产生不同程度的影响。生物胁迫是指对植物生存与发育不利的各种生物因素的总称,通常是由感染和竞争所引起的,如病害、虫害、杂草危害等。已有研究表明,AGO蛋白在植物对生物胁迫的响应中发挥重要作用。
3.1.1防御病毒 病原微生物可导致作物的产量和品质受到严重的损失,植物会通过各种途径来抵御病毒侵染等逆境胁迫,近年来研究表明,AGO蛋白在植物防御病毒过程中扮演着重要角色[14-21]。至今已发现植物中有很多AGO蛋白具有病毒防御功能,如拟南芥AtAGO1/2/3/4/5/7/10[14-16],烟草NbAGO1/2/4/10[17-20]以及水稻OsAGO1/18[21]。然而,不同AGO蛋白在病毒防御中所发挥的作用不同,如AGO1主要参与miRNA介导的基因沉默和转录后基因沉默[12];AGO2主要参与miRNA介导的基因沉默、翻译抑制,并在免疫应答中发挥作用[54];AGO4主要通过结合24 nt siRNAs形成RNA介导的DNA甲基化复合物(RdDM),参与DNA甲基化和转录基因沉默[47, 50];AGO5可结合21~24 nt siRNAs,参与转录后基因沉默和系统抗性[55]。
不同的病毒侵染会诱发宿主植物产生不同的对抗机制,AGO蛋白在植物病毒防御机制中可能通过结合病毒产生的siRNA来抑制病毒自身RNA的表达。vsiRNA(virus-derived small interfering RNAs)是病毒来源的RNA 或dsRNA被植物DCL(dicer-like)加工成的21~24 nt siRNA,与AGO蛋白特异性结合后,通过剪切或翻译抑制等方式靶向和抑制同源病毒RNA,从而增强病毒防御能力[56]。AGO蛋白也可能通过调控防御基因的表达来间接影响病毒的复制,如水稻植株受到RSV(rice stripe virus)侵染后,OsAGO18基因被诱导性表达,分别通过竞争性结合miR168和miR528解除OsAGO1的负调控和释放miR528对AO(抗坏血酸氧化酶)的负调控,AO 通过氧化抗坏血酸调节植物体内的氧化还原稳态,促进植物体内活性氧(ROS) 的积累,从而达到病毒防御的效果[57]。在烟草中发现,AGO4 蛋白对病毒转录本翻译的调控可能是R基因(NB-LRR) 介导的抗病毒机制中的一个关键因素[58]。此外,AGO蛋白还有可能通过调控其他AGO蛋白的功能来影响其抗病毒防御功能,如AGO1 和AGO2以非冗余和合作的方式抵御病毒侵染[59],而拟南芥DRB4、AGO1、AGO7和RDR6共同参与DCL4启动的被DCL1负调控的抗病毒RNA沉默通路[60]。以上研究表明植物抗病毒防御网络的复杂与多样性。
3.1.2防御细菌 AGO蛋白在植物抵御细菌侵染方面具有重要作用,如AGO1依赖型的miRNA正调控PAMP(pathogen-associated molecular pattern)诱导的胼胝质沉积和细菌抗性。细菌鞭毛蛋白来源的多肽flg22可触发AGO1结合,促进先天免疫系统和几丁质应答基因的转录[29]。衍生肽诱导的miRNAs (miR393)可通过两种不同的AGOs蛋白在抗菌免疫中发挥作用。其中与AGO1相关的miR393和与AGO2相关的miR393*分别与PTI(PAMP-triggered immunity)和ETI(effector-triggered immunity)有关[61]。番茄细菌性叶斑病是由Pseudomonassyringaepv.tomato引起的一种世界范围内广泛发生的植物细菌性病害, AGO4作为RdDM通路的重要组成部分,在调节植物病原细菌DC3000抗性中发挥独特功能。若RdDM通路组分的功能缺失,会导致AGO4的上游或下游都不利于对P.syringae的抗性。因此,在细菌感染后,AGO4下调表达,抑制RdDM通路,进而抑制转录基因沉默(TGS)[62]。以上研究表明,RNAi机制是植物抵御各种病原菌的一种常见的内源性防御机制,其中AGO蛋白作为重要核心元件发挥着重要的作用。
3.1.3防御病原真菌 除了在病毒防御方面的功能外,植物和植物真菌病原体具有相似的RNAi机制,一方面被宿主用来防御病原体,另一方面被入侵生物利用来生长、发育和致病。真菌DCLs产生sRNAs,通过与植物AGO1蛋白结合,劫持RNAi机制,沉默宿主免疫系统[63]。研究发现,植物RNAi组分在不同寄主植物中的直接参与和差异表达对真菌病原的影响存在矛盾。拟南芥突变体dcl4、ago1、ago2、ago7、ago9等对大丽轮枝菌(VerticilliumdahliaKleb.)、菌核病菌(Sclerotiniasclerotiorum)和疫霉菌(Phytophthoraspecies)感染更敏感,表现出增强的症状[6]。而油菜(Brassicanapus)AGO1蛋白的敲除则增强了对大丽轮枝菌(V.dahlia)和长孢黄萎病菌(Verticilliumlongisporum)的抗性[24]。VmAGO2是苹果腐烂病菌(Valsamali)致病力的关键因素,可导致苹果叶片和嫩枝患病[64]。最新研究发现,NaAGO4可通过调节茉莉酸信号途径调节对短枝镰刀菌(Fusariumbrachygibbosum)的抗性[26]。下一步的研究需要了解RNAi通路各组分的确切机制和协同策略,有望解决植物对各种病原体的复杂的防御系统。
3.1.4防御害虫AtAGO8在拟南芥所有组织中表达量均较低,曾被认为是一个假基因,然而,在烟草中研究发现,NaAGO8基因沉默的烟草会使烟草天蛾生长加快,NaAGO8蛋白是通过结合的sRNA 调控MYB转录因子的表达,进一步调节尼古丁、芬妥胺类和二萜苷类物质的合成与代谢途径来诱导抗性响应。此外,NaAGO8基因沉默还会影响植物激素(例如JA和ABA) 的信号转导,表明NaAGO8可通过调节草食动物反应中防御信号网络的几个调控节点,在诱导直接防御中发挥核心作用[27]。近期也有研究发现,小麦TaAGO5在调节对麦双尾蚜(Diuraphisnoxia)侵染的反应中至关重要。在麦双尾蚜抗性小麦中,TaAGO5基因被敲除22%导致完全敏感,表明TaAGO5在小麦蚜虫取食过程中防御反应很关键,同时还发现,TaAGO5可能在小麦病毒侵染过程中发挥作用。众所周知,AGO5蛋白主要是在双子叶植物对节肢动物草食和病毒感染的反应中发挥作用,而TaAGO5的这一作用可能在小麦等单子叶植物中也是保守的[28]。
3.2 AGO蛋白在植物响应非生物逆境胁迫中的生物学功能
已有研究表明,植物中不同AGO基因在不同逆境胁迫下(冷、热、激素、盐、干旱等)呈现出不同程度的表达差异,但其表达模式既具有保守性,也具有物种的特异性,并且每种AGO蛋白所发挥的功能也不尽相同[4, 65-66]。
AGO1是目前AGO蛋白家族研究中所发现的参与通路最多、功能最丰富的一类,研究表明,AGO1蛋白主要通过sRNAs-AGO1-miRNAs所形成的调控网络在植物生长发育、逆境胁迫响应等生物学过程中发挥重要的调控作用[29, 67]。AGO1功能缺失通常会导致植株表现出矮秆、窄叶、花序不育、叶片早衰、结实率低等发育异常表型[3]。AGO1在调控miRNA介导的耐旱机制方面起着关键性作用[67-68]。在ABA和干旱处理下,拟南芥中AGO1转录活性增加,在胁迫反应期间,miR168a转录水平的升高是维持稳定的AGO1转录水平所必需的。表明miR168a的转录调控和AGO1稳态的转录后调控在植物响应非生物胁迫和信号转导中发挥重要而保守的作用[67]。进一步研究发现,拟南芥中AGO1功能缺失不仅促进叶片气孔关闭,从而导致耐旱性提高,而且可改变拟南芥对ABA和其他非生物胁迫的响应,表明AGO1可能是拟南芥ABA信号通路和胁迫响应的负调控因子[68]。小RNA测序和降解组分析表明,miRNA及其特异性靶标包括miRNA效应蛋白AGO1、干旱信号相关受体和酶、转录因子以及其它结构和功能蛋白在茶树抗旱反应中发挥重要作用[69]。NAC转录因子衍生的阶段性小干扰RNA (phased secondary small interfering RNA,phasiRNA)受miR1514a调控,AGO1通过与phasiRNA结合在豆科植物干旱胁迫响应中发挥功能[70]。近年来研究发现,AGO1不仅作为RNA结合蛋白,还作为DNA结合蛋白,在植物响应激素和逆境胁迫过程中结合染色质并促进茉莉酸等信号通路的基因表达,表明AGO1在植物响应不同内外源信号过程中具有异于经典RNA干扰而激活基因表达的调控功能[29]。AGO蛋白的稳定性是其行使生物学功能的前提,有研究发现,重金属铯Cs毒性可破坏miRNAs前体的加工过程和AGO1蛋白的稳定性,影响miRNA和AGO1蛋白介导的基因沉默,进而导致发育紊乱[71]。
AGO2可以通过结合多种miRNA靶区(ORF, 3’-UTR)行使其催化裂解活性、翻译抑制潜能和抗逆境活性[1]。当细胞响应逆境胁迫时,AGO2与mRNA的相互作用会发生重构,并与翻译效率的改变相关[54]。RNA诱导的沉默复合体RISCs(RNA-induced silencing complexes)可能通过竞争性结合介导RNA干扰,阻止AGO2的募集而抑制应激颗粒(stress granule)的形成,表明AGO2在响应逆境胁迫中具有重要的调控作用[72]。
RNA介导的DNA甲基化(RdDM)途径在调控生物和非生物的应激反应方面发挥重要作用。研究发现,AGO4、AGO6可以通过RdDM途径参与基因和转座子的转录沉默[50]。通过对拟南芥中AGO4相关的长链非编码RNA(lncRNAs)的分析发现,AGO4可能通过RdDM引导基因核染色质修饰、阻止隐性转录而维持或激活胁迫响应相关基因的表达,表明植物AGO蛋白在RdDM调控植物响应逆境胁迫过程中起着非常重要的作用[51]。
AGO5通过与拟南芥miR156的互作可抑制衰老诱导的开花过程。研究发现,AGO5可通过光照、环境因素等调控SPL(SQUAMOSA-PROMOTER BINDING LIKE)转录因子的表达进而调控开花时间。AGO5主要是在分生组织(而非营养器官)中介导了miR156的活性,表明miR156衰老途径的时空调控是通过不同组织中不同的AGO蛋白介导的[43]。
种子休眠期短是导致种子在穗收获前萌发的最重要的方面,受各种环境因素的影响,包括光、温度等。研究表明,作为RdDM途径关键因子,AGO4_9类蛋白可能参与调控植物种子休眠和萌发的生物学过程,AGO802-B可能通过调节DNA甲基化在种子休眠和收获前萌发(pre-harvest sprouting,PHS)抗性方面发挥作用[73]。以上研究表明,不同AGO蛋白在响应逆境胁迫中其表达模式及生物学功能存在差异。
此外,在同一逆境胁迫下,不同AGO蛋白响应特点及作用机制会有所不同。比如在盐胁迫下AGO1可通过协同转录调控细胞核中miR161和miR173的表达来做出响应[12]。而AtAGO2对盐胁迫的调控作用则依赖于一个RNA结合蛋白MUG13.4,并在转录水平通过影响SOS级联信号传递途径,提高拟南芥对盐胁迫的耐受性[30]。环型泛素连接酶McCPN1在盐生植物中可催化UBC8依赖性蛋白泛素化并与AGO4相互作用。在盐胁迫下,McCPN1可能参与了AGO4的催化降解[74]。在盐胁迫条件下LBD12-1转录因子通过抑制AGO10的表达来控制根尖分生组织的大小[44]。
以上研究表明,应对不同逆境胁迫,不同的AGO基因表述模式和响应机制有所不同。这些结果为进一步研究AGO蛋白在植物逆境响应中的作用提供了依据。
3.3 辅助AGO作用的蛋白
植物的抗逆性是由多基因控制的复杂性状,涉及到生物个体生长发育的维持、渗透及离子吸收的调节和平衡适应、信号转导和代谢等诸多方面,相关基因之间相互作用使植物的抗逆性得以表现。比如豌豆P68 蛋白(Pisumsativump68,PSP68) 作为非生物氧化和应激反应通路的分子开关,通过与AGO1 蛋白相互作用,可改善作物对逆境的耐受性[75]。原则上,植物AGO蛋白通常需要辅助因子来发挥它们的功能,比如AGO蛋白需要热休克蛋白(Hsp70-Hsp90)来陪伴和水解ATP以完成加载过程和构象变化[76]。然而,迄今为止被鉴定到与植物AGO蛋白相互作用的蛋白质数量有限。目前已知的植物AGO互作蛋白主要有CYP40、HSP90和TRN1,它们与AGO1相互作用在逆境胁迫响应中发挥功能[1, 77]。近期研究,发现拟南芥中一种核定位的内在紊乱蛋白,名为CARP9蛋白(CONSTITUTIVE ALTERATIONS IN THE SMALL RNAS PATHWAYS9),在细胞核中连接HYL1(HYPONASTIC LEAVES1)和AGO1以促进sRNA活性[78]。其他与AGO互作蛋白还有待于进一步发掘、鉴定。
4 结语
近年来,在拟南芥、水稻、烟草等模式作物中有关AGO蛋白家族的结构和功能研究广泛且系统,表明其作为RNA诱导沉默复合体的核心元件,不同家族成员之间的功能既相互联系又相对独立,在植物生长发育和逆境胁迫响应中发挥重要作用。然而目前在植物AGO蛋白研究领域中仍存在如下几个问题:一是AGO蛋白靶标RNA还有待进一步探索;二是AGO蛋白转录调控因子在很大程度上未知;三是AGO蛋白在植物生长发育和逆境响应中的生物学功能及作用机制尚不明确,尤其是在非生物胁迫方面的功能研究相对较少。AGO蛋白的未知新功能值得进一步探索。
未来需要解析AGO蛋白发挥生物学功能的上游调控途径以及互作因子,即不同AGO蛋白在哪些miRNA/siRNA发挥功能时起作用,AGO 蛋白对sRNA的选择机制有待进一步揭示;这些miRNA/siRNA的靶标基因是什么,靶标基因又如何调控AGO蛋白在植物逆境胁迫响应中的作用,以进一步深入解析不同逆境胁迫条件下不同AGO蛋白发挥的具体功能及其作用机制。
