铅、锌、镉胁迫对多年生黑麦草生长及生理生化特性的影响
2021-03-12张茂徐彦红席溢裴应杰黄本用杨克超李金孟
张茂, 徐彦红, 席溢, 裴应杰, 黄本用, 杨克超, 李金孟
(贵州大学动物科学学院, 贵阳 550025)
铅(Pb)、锌(Zn)、镉(Cd)常以工业、农业废弃物的形式进入环境中,并通过食物链流动对人造成威胁[1]。Pb是一种非氧化还原活性重金属,积累过多会破坏植物结构和功能,引起多年生黑麦草蒸腾作用和生长速率的下降[2]。Zn作为植物生长发育的必需元素,具有调节光合作用,控制蛋白合成,促进植物生长等重要功能,植物生理屏障对Zn的毒性具有一定的抵抗力,当Zn过量后植物会调节渗透物质、抗氧化酶、蛋白质等对自身进行解毒[3]。Cd是植物的非必需元素,在根部大量积累,容易造成多年生黑麦草出现绿化现象,阻碍营养元素吸收,进而抑制植物生长[4]。
多年生黑麦草(LoliumperenneL.)为禾本科黑麦草属草本植物,具有分蘖快、生长快、抗性强等优点,且有研究发现,多年生黑麦草可富集多种重金属。多年生黑麦草对Cd2+的吸收作用大于Pb2+,修复轻度Pb2+和Cd2+的污染效果明显[5]。研究表明,多年生黑麦草富集重金属能力顺序为:Zn2+>Cd2+>Pb2+[6]。Zn2+浓度为300 mg·kg-1时,能促进植物的生长,过量Zn2+改变细胞的生理结构和营养价值等,间接威胁人类和动物的健康[7]。
土壤重金属污染已成为生态恢复过程中亟需解决的问题,目前利用植物进行土壤重金属恢复存在研究材料富集能力单一、生长缓慢等问题,本文研究了不同浓度Pb2+、Zn2+、Cd2+胁迫对多年生黑麦草生长发育及生理生化特性的影响,探究多年生黑麦草对不同重金属的耐受性及修复土壤重金属污染的潜力,旨在为生态恢复提供理论支撑和数据支持。
1 材料与方法
1.1 供试材料
供试草种为黑麦草品种‘雅晴’(Yatsyn),购于北京正道生态科技有限责任公司。供试重金属为Pb(NO3)2、Zn(NO3)2·6H2O、Cd(NO3)2·4H2O,购于成都金山化学试剂有限公司。
1.2 试验设计
试验在贵州大学西校区崇学楼开展。挑选饱满、健康的种子,采用双层滤纸法培养。待出现2片真叶时,挑选长势相近的幼苗移栽至直径29.5 cm、高21.5 cm的塑料花盆中,每盆5株。砂培法栽种,每盆石英砂重8 kg,每周定期浇灌Hoagland营养液。根据中华人民共和国国家标准土壤环境质量三级标准[8],并结合前人研究,Pb2+设0(CK)、500(Pb500)、1 000(Pb1 000)、2 000(Pb2 000)mg·kg-1四个处理,Zn2+设0(CK)、500(Zn500)、1 000(Zn1 000)、2 000(Zn2 000)mg·kg-1四个处理,Cd2+设0(CK)、10(Cd10)、20(Cd20)、50(Cd50)mg·kg-1四个处理,每个处理4次重复。移栽后第14 d(2017年12月13日)开始测量株高和叶宽,此后每2周测量一次。第127 d收获植株,进行生理指标测定。
1.3 测定指标和方法
生理指标检测均参考张蜀秋等[9]方法,株高测定垂直高度,叶宽测定叶片最宽处,活性愈创木酚法测定过氧化物酶(peroxidase,POD)活性;氮蓝四唑(NBT)法测定过氧化物歧化酶(superoxide dismutase,SOD)活性;脯氨酸(proline,Pro)含量采用磺基水杨酸提取,茚三酮比色法测定;硫代巴比妥酸显色法测定丙二醛含量(malondialdehyde,MDA),蒽酮法测定可溶性糖含量;95%乙醇浸提法测定叶绿素a、叶绿素b和类胡萝卜素含量。
应用Fuzzy隶属函数法[10]进行综合评价,与多年生黑麦草重金属抗逆性呈正相关的参数用式(1),呈负相关的参数用式(2)。
U(X)=(X-Xmin)/(Xmax-Xmin)
(1)
U(X)=1-(X-Xmin)/(Xmax-Xmin)
(2)
式中,U(X)为多年生黑麦草对重金属的隶属度,且0≤U(X)≤1,X为某一指标的测定值。
1.4 数据分析
利用Microsoft Excel 2010进行数据整理和作图,SPSS 20.0对测量指标进行单因素ANOVA检验。
2 结果与分析
2.1 Pb2+、Zn2+、Cd2+对多年生黑麦草株高和叶宽的影响
不同处理多年生黑麦草的株高和叶宽结果(表1)可见,随着Pb2+、Zn2+、Cd2+浓度的增强,多年生黑麦草的株高呈降低趋势,各处理与对照组差异显著(P<0.05);Pb2 000处理14 d时,株高为Pb2+处理的最低值,为4.18 cm,仅为CK的33.71%;Zn1 000处理14 d时,株高为Zn2+处理的最小值,为4.65 cm,仅为CK的37.5%;Cd50处理14 d时,为Cd2+处理的最小值,株高为6.78 cm,为CK的55.4%。随着Pb2+、Zn2+、Cd2+浓度增强,多年生黑麦草的叶宽表现出递减的趋势,Zn1 000处理14 d时,叶宽最小,为0.85 cm,仅为CK的31.84%。Cd2+胁迫对多年生黑麦草的株高和叶宽影响最小,Pb2+和Zn2+胁迫对多年生黑麦草的影响类似。Pb2+、Zn2+和Cd2+显著抑制了多年生黑麦草的生长,且随着种植时间的延长,不同金属离子胁迫处理的株高并没有显著增加,只有叶宽在Pb500、Pb1 000、Cd10处理127 d时显著增加,说明多年生黑麦草体内的重金属并不会降解,重金属对植物生长的抑制作用持续存在。Pb500、Pb1 000、Cd10处理127 d时,叶宽增加可能是因为重金属离子浓度较低或叶片对重金属耐受性高于其他器官等综合作用的结果。

表1 不同浓度Pb2+、Zn2+、Cd2+对多年生黑麦草的株高和叶宽
2.2 Pb2+、Zn2+、Cd2+对多年生黑麦草生物量、根长和分蘖数的影响
由表2可知,Pb2+胁迫时,随浓度增加,地上生物量呈先增加后减小趋势,Pb500胁迫时最大,显著高于其他处理,为对照的1.78倍;地下生物量随浓度增加呈减小趋势,但Pb500处理与CK无显著差异,Pb1 000和Pb2 000处理的地下生物量显著低于CK。Zn2+胁迫下,多年生黑麦草地下生物量随着浓度升高表现为下降趋势,与对照差异显著(P<0.05)。处理Zn500、Zn1 000、Zn2 000和Cd50的根冠比较CK显著增加(P<0.05),说明这些处理对多年生黑麦草的地上部影响更大;而Pb500、Pb1 000、Pb2 000、Cd10和Cd20处理的根冠比与CK处理无显著差异。Pb2+、Zn2+、Cd2+胁迫处理的分蘖数和根长均较CK处理显著降低(P<0.05)。综上,轻度Pb2+、Zn2+、Cd2+处理对多年生黑麦草的影响较小,3个Zn2+处理均显著抑制多年生黑麦草的地上和地下生物量,可能是因为500 mg·kg-1Zn2+已经远远大于多年生黑麦草对Zn2+的耐受阈值。
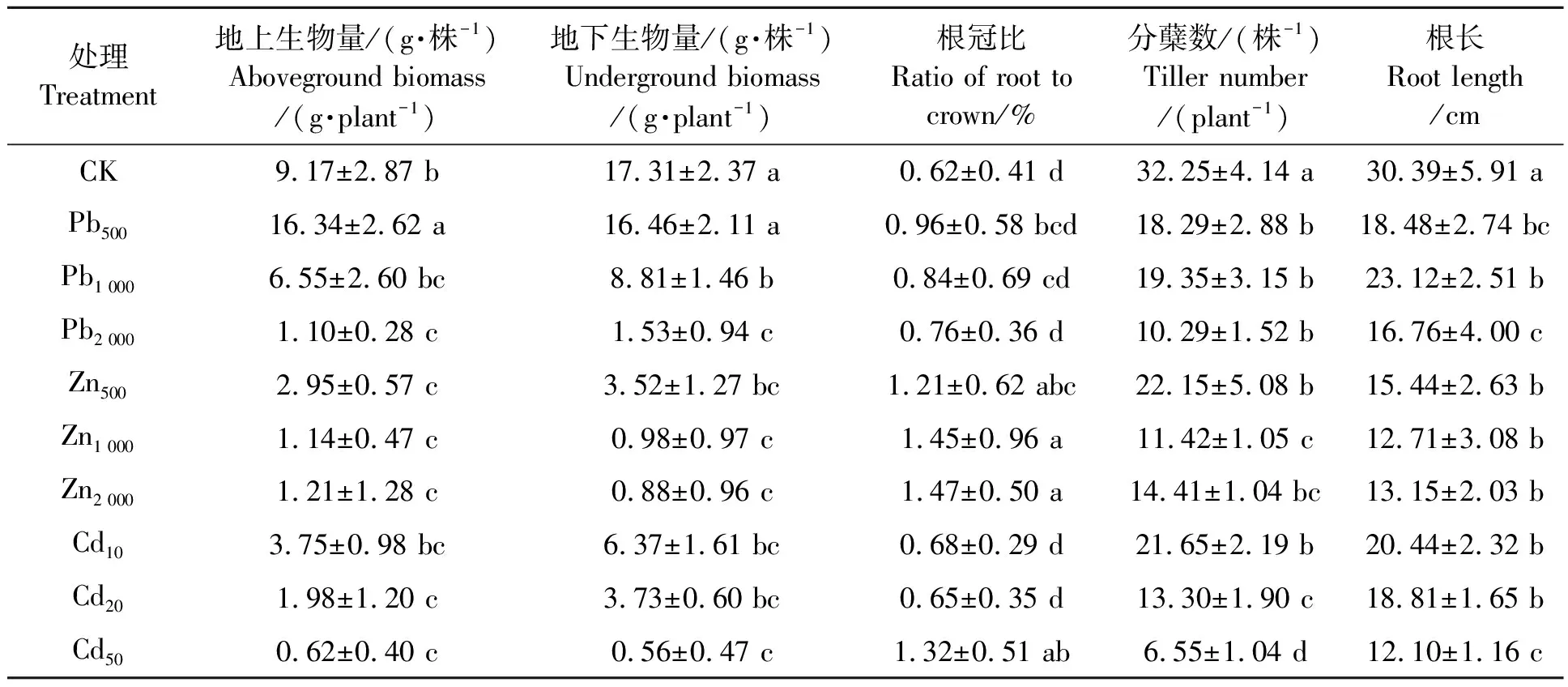
表2 Pb2+、Zn2+、Cd2+胁迫下多年生黑麦草的生物量、分蘖数、根长
2.3 Pb2+、Zn2+、Cd2+对多年生黑麦草光合色素含量的影响
不同Pb2+、Zn2+、Cd2+处理的多年生黑麦草光合色素含量结果(表3)可见,所有处理的叶绿素含量均与对照组无显著差异,Pb2 000处理的叶绿素a含量较CK处理显著降低25%(P<0.05)。Zn500处理的叶绿素a、类胡萝卜素和光合色素含量均较CK显著降低(P<0.05)。Cd50处理的叶绿素b含量较CK处理显著增加96%。Zn500处理的类胡萝卜素、叶绿素和光合色素含量最低,比CK分别降低了32%、21%、23%。
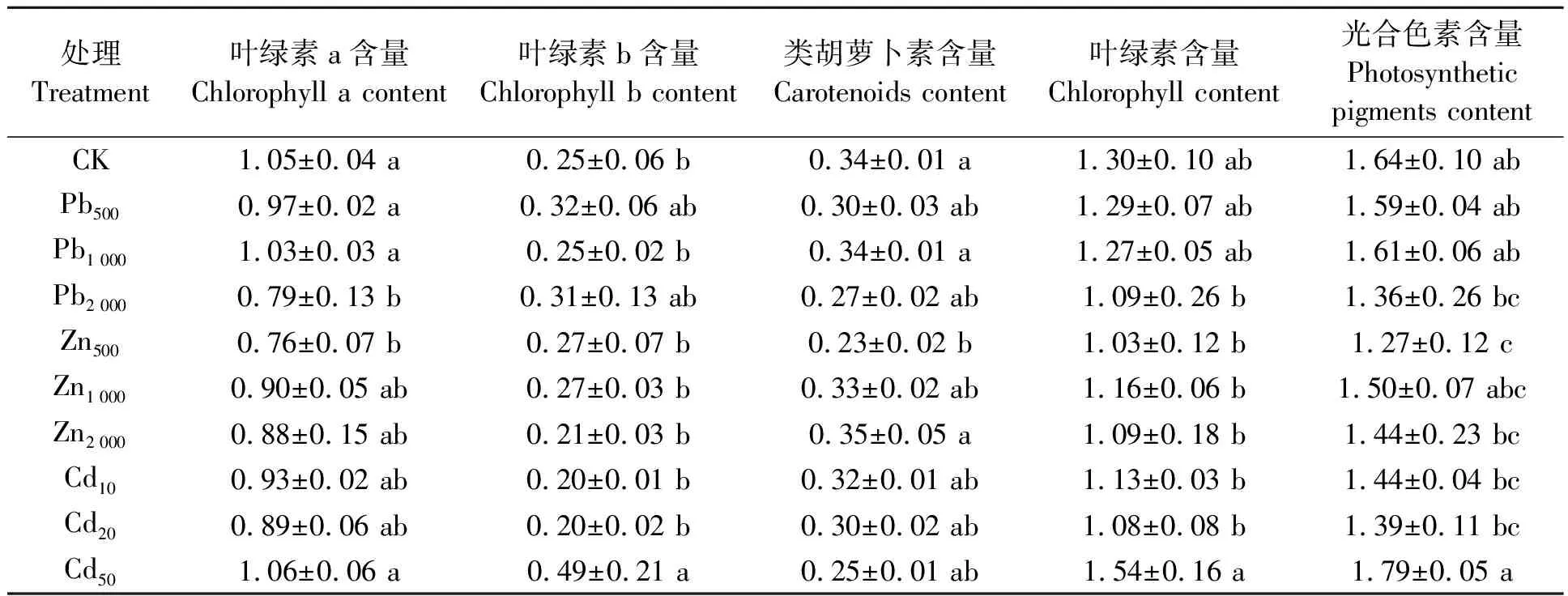
表3 Pb2+、Zn2+、Cd2+对多年生黑麦草光合色素含量的影响
2.4 Pb2+、Zn2+、Cd2+对多年生黑麦草抗氧化酶的影响
由图1可知,在低浓度Pb2+胁迫时,多年生黑麦草SOD活性与对照组差异不显著,随着Pb2+浓度增加,SOD活性显著增强(P<0.05)。Zn2+对多年生黑麦草SOD活性的影响表现为先增加后减少的趋势,仅Zn500处理与CK有显著差异(P<0.05),为CK的4.28倍。Cd10、Cd20、Cd50处理的SOD活性均与CK处理无显著差异。这说明Pb1 000、Zn500处理能激活多年生黑麦草的抗氧化系统进行防御。
Pb2+、Zn2+处理的多年生黑麦草POD 活性均较CK显著增强,Pb500活性最大,为3 262.33 U·g-1,是CK的2.53倍,Cd10、Cd20、Cd50处理的多年生黑麦草POD活性与CK间均无显著差异。说明Pb2+、Zn2+在浓度为500 mg·kg-1时,能激活多年生黑麦草的SOD和POD 活性进行防御,而Cd2+胁迫SOD和POD 活性未被激活。
2.5 Pb2+、Zn2+、Cd2+胁迫对多年生黑麦草MDA含量的影响
由图2可知,多年生黑麦草的MDA含量随着Pb2+浓度增加呈现先下降后增加趋势,Pb500、Pb1 000、Pb2 000三个处理均与CK差异显著(P<0.05),Pb2 000处理的MDA含量最大,是CK的3.60倍。MDA含量随着Zn2+、Cd2+浓度增加呈线性增加趋势,Zn2+、Cd2+胁迫处理均与CK处理差异显著(P<0.05),均在浓度为2 000 mg·kg-1时增加到最大值,分别是CK的4.20、3.55倍。表明随着Pb2+、Zn2+、Cd2+胁迫逐渐增强,加大了多年生黑麦草的膜脂过氧化过程,MDA生成增加。
2.6 Pb2+、Zn2+、Cd2+胁迫对多年生黑麦草渗透调节物质的影响
由图3可知,不同浓度Pb2+处理的多年生黑麦草可溶性糖含量间有显著差异(P<0.05),Pb500、Pb1 000处理均较CK显著降低,Pb500处理达到最小值,为1.76 g·kg-1,Pb2 000处理较CK显著增加,可溶性糖含量达到7.23 g·kg-1。随着Zn2+浓度的增大,多年生黑麦草可溶性糖含量表现为先升高后下降趋势,均与CK差异显著(P<0.05),Zn500处理达到最大值,为7.83 g·kg-1,Zn2 000处理可溶性糖含量最小,为2.65 g·kg-1。Cd2+胁迫下,多年生黑麦草可溶性糖的含量均显著低于CK(P<0.05),Cd10处理的可溶性糖含量降到最小,为1.4 g·kg-1。说明低浓度的Pb2+和Cd2+胁迫会抑制多年生黑麦草可溶性糖的产生,低浓度Zn2+胁迫能促进多年生黑麦草可溶性糖的产生。
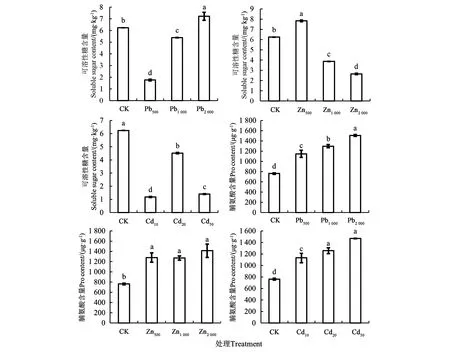
注:不同小写字母表示不同处理间差异在P<0.05水平具有显著性。
多年生黑麦草脯氨酸含量随着Pb2+、Zn2+、Cd2+浓度升高,不同浓度处理的脯氨酸含量均显著高于CK处理(P<0.05),Pb2 000、Zn2 000、Cd50处理分别为Pb2+、Zn2+、Cd2+处理的最大值,脯氨酸含量分别为CK的1.98、1.93、1.93倍。表明Pb2+、Zn2+、Cd2+胁迫能显著促进多年生黑麦草脯氨酸的生成。多年生黑麦草渗透调节物质大量累积,可以减轻或避免重金属对多年生黑麦草的伤害。
2.7 多年生黑麦草对重金属耐受性的综合评价
利用隶属函数法对多年生黑麦草11个抗逆性生理生态指标进行分析,对不同处理进行排序,结果(表4)表明,多年生黑麦草植物对Pb2+、Zn2+、Cd2+的抗逆性由强到弱依次为:Zn500>CK>Zn1 000>Cd10>Pb500>Zn2 000>Cd20>Pb1 000>Pb2 000>Cd50。
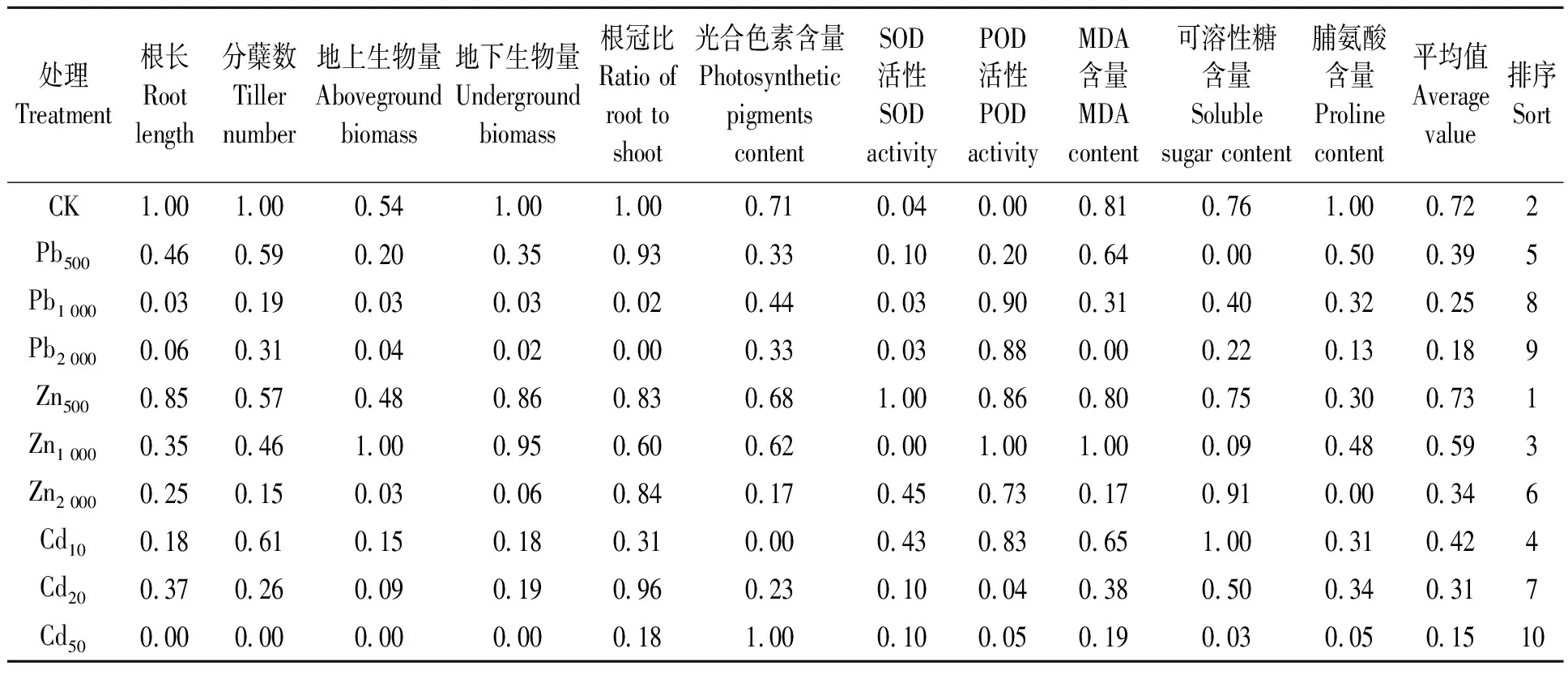
表4 多年生黑麦草对重金属Pb2+、Zn2+、Cd2+耐受性的综合评价
3 讨论
3.1 Pb2+、Zn2+、Cd2+抑制多年生黑麦草的生长
Pb2+、Zn2+、Cd2+是土壤污染中的主要污染物,在植物中积累过量后会严重影响植物生长发育,甚至死亡[11],所有研究材料的株高、分蘖数、地上生物量均呈现先增后减的趋势,地下生物量则逐渐降低[12]。Pb100-400、Zn100-400促进黑麦草幼苗的生长,Cd1-10抑制黑麦草幼苗的生长[13]。在受到Pb2+、Zn2+、Cd2+、Cu2+、Ni2+等重金属污染的环境中,植物的生物量减小,其中Zn2+胁迫下生物量降低最多,与对照植物相比下降了95%[14]。在Zn25、Zn50、Zn100时,水稻(OryzasativaL.)幼苗的生物量降低,生长受阻,且浓度越大抑制作用越显著[15]。本研究结果表明,Pb2+、Zn2+、Cd2+胁迫下多年生黑麦草的株高、叶宽、根长、分蘖数均显著低于对照组,仅有Pb500、Pb1 000、Cd10处理时差异性不显著,Pb500对地下生物量和Pb1 000对地上生物量的影响不显著,其余均显著。重金属被植物吸收并在器官中转移,阻碍根系生长和分蘖能力,且随着时间的增加对多年生黑麦草的抑制作用并未降低。
3.2 Pb2+、Zn2+、Cd2+影响多年生黑麦草的叶片叶绿素含量
光合作用是植物获取能量的一个重要方式,而叶绿素含量与植物进行光合作用有密切关系。在重金属Pb2 +胁迫下,多年生黑麦草的叶绿素a、叶绿素b、叶绿素含量均显著高于对照组,Cd2+的胁迫下,多年生黑麦草的叶绿素a、叶绿素b、叶绿素含量在浓度低于10 mg·kg-1时显著高于对照组,浓度继续增加,植物各叶绿素含量变化不明显[5]。在Zn2+和Mn2+的胁迫下,叶绿素a、叶绿素b、叶绿素含量及叶绿素a/b的比值比对照组均显著降低[16]。随着Cd2+浓度增大,多年生黑麦草叶绿素a、叶绿素b、类胡萝卜素均轻微降低,但并无显著性差异[17]。本研究中多年生黑麦草在低浓度Pb2+胁迫下,叶绿素含量均无显著差异,在浓度大于1 000 mg·kg-1时,叶绿素a显著低于对照组,Zn500胁迫下多年生黑麦草叶绿素a、叶绿素b、光合色素含量均显著低于对照,Cd10胁迫下叶绿素b含量显著高于对照组。与方鑫等[16]研究结果相同,可能是多年生黑麦草对Zn2+比较敏感,对Pb2+有一定的耐受性,对Cd2+有特殊的应激机制[18]。
3.3 Pb2+、Zn2+、Cd2+胁迫引起渗透调节物质积累
脯氨酸和可溶性糖是重要的渗透调节物质,植物体内脯氨酸和可溶性糖的积累能够增强植物的耐受性[19],当Pb2+浓度低于1 000 mg·kg-1时,黑麦草的脯氨酸含量随着Pb2+浓度的增大而增大,Pb2+浓度高于1 000 mg·kg-1时,黑麦草的脯氨酸含量随着Pb2+浓度的增大逐渐减少,在长时间高浓度处理下,可溶性糖含量不成规律性变化最终趋于减少[20]。Zn2+胁迫下小麦(TriticumaestivumL.)幼苗根、叶中的脯氨酸和可溶性糖含量显著增加,根中脯氨酸的增加率大于叶片[21]。当大麦(HordeumvulgareL.)处于Al3+、Cd2+胁迫时,植物叶片的脯氨酸含量显著增加[22]。在本研究中多年生黑麦草脯氨酸含量随着重金属含量增加而增加,可溶性糖含量变化复杂,研究结果与前人研究基本一致,重金属胁迫会打破植物细胞中活性氧与自由基之间的平衡,导致细胞膜结构受到破坏,此时植物细胞通过分泌大量脯氨酸和可溶性糖等逆境保护物质用于缓解重金属的伤害。
3.4 Pb2+、Zn2+、Cd2+胁迫激活抗氧化酶活性
为了抑制逆境胁迫对植物的氧化损伤,植物形成了复杂的抗氧化系统保护植物细胞结构[23],对两个品种高羊茅耐受性的研究发现,在Pb1 000胁迫下,植物的POD、SOD活性显著增加[24],14种禾本科牧草对重金属Pb2+耐受性的研究发现,植物的POD、SOD及CAT活性先增后减[12]。Zn2+处理小麦、玉米(ZeamaysLinn.)研究发现,Zn2+浓度为200、900 mg·kg-1时SOD活性显著低于对照,450 mg·kg-1处理与对照组无显著差异,Zn2+处理的小麦SOD活性在整个试验过程中增加,玉米的SOD活性降低[25]。本研究中,Pb2+胁迫下多年生黑麦草的SOD、POD活性均显著增高,Zn2+胁迫下SOD先增后减、POD活性均显著增高,Cd胁迫下多年生黑麦草SOD、POD活性均有不同程度的升高,但差异性不显著。这与Hu等[24]研究结果一致,与李慧芳等[12]、Alonso-Blázquez等[25]研究结果不同。当重金属进入细胞并引起结构变化时,抗氧化系统发挥了特殊作用,植物通过分泌大量的抗氧化酶来去除有害物质,维持植物的生长,但重金属浓度过大会破坏植物细胞结构甚至导致植物死亡。
3.5 综合评价Pb2+、Zn2+、Cd2+对黑麦草的影响
本研究综合评价表明,多年生黑麦草对Pb2+、Zn2+、Cd2+有一定的耐受性,抗逆性由强到弱依次为:Zn500> CK > Zn1 000> Cd10> Pb500> Zn2 000> Cd20> Pb1 000> Pb2 000> Cd50。前人研究表明,植物在一定范围的Pb2+、Cd2+胁迫下会增加植物的渗透调节物质和抗氧化酶来减小对植物的危害,Cd2+浓度为10 mg·L-1时对植物的根和地上部分的生长有促进作用,大多植物对Pb2+、Cd2+胁迫表现为低促高抑[26-28],重金属对植物的毒性为Pb2+>Zn2+[29]。本研究中,低浓度的Zn2+对多年生黑麦草的抗逆性表现出促进作用,高浓度具有抑制作用,抗逆性由强到弱依次为:Zn2+>Cd2+>Pb2+,这与杨卓等[6]研究结果相似,同时也验证了多年生黑麦草作为重金属修复生物材料的可行性。
