慢病毒介导PTEN基因表达降低的RSC96施万细胞系模型建立*
2021-03-12解笑宸于斐姚粤峰林健静年梦圆曾晖
解笑宸 于斐 姚粤峰 林健静 年梦圆 曾晖
(北京大学深圳医院骨关节科,骨科生物材料国家地方联合工程研究中心,广东深圳 518036)
第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homologue deleted on chro⁃mosome 10,PTEN),位于人染色体10q23.3[1],是一个由8个内含子和9个外显子构成的200 kb的基因,是继p53基因后研究较多的一种具有双特异性磷酸酶活性的抑癌基因,与肿瘤发生密切相关[2]。其翻译后产生的蛋白质属于酪氨酸磷酸酶家族成员,分子量58~60 kDa,由N末端、C2结构域及C末端组成[3]。PTEN基因的最初发现是因为其通过磷酸酯酶作用行使抑癌基因的功能,从而调控细胞周期,影响到细胞的生长与分裂,并抑制其过快的增殖分裂[4]。随着研究的深入,研究者发现PTEN基因在骨关节炎[5]、周围神经损伤[6]、骨肉瘤[7]及软骨发育不全[8]等疾病中起重要作用,其可以通过Wnt[9]、PI3K/AKT[10]、NF-κB[11]等信号转导通路影响机体中细胞炎性因子相关免疫反应[12]、细胞凋亡[13]、神经元轴突再生[14]等过程参与到骨科疾病[15]的病理生理过程中,也因此PTEN基因受到骨科医师的重视。
RSC96施万细胞系是由原代培养的大鼠施万细胞经过长时间培养后自发转化形成的,传代次数较多,该细胞在特定因子的刺激下能够表现出原代施万细胞的特性,并且能够快速的分裂增殖,满足细胞实验中细胞量使用较大的需求,在创伤骨科、脊柱外科等领域的神经相关疾病的研究中应用广泛[16,17],比如在脊髓损伤[18]、周围神经缺损[19]研究中受到青睐。
目前,慢病毒转染敲减细胞中的基因表达是研究中比较新颖并且可靠的方法。通过细胞模型的建立,能够在细胞层面结合功能及机制检测方法解释疾病发生发展的原因,从而为实验研究提供便利,为临床治疗提供相应靶点。查阅文献发现,PTEN基因表达降低的RSC96施万细胞系模型鲜有报道,通过建立该细胞模型,结合细胞系可以多次传代的优势,我们可以在施万细胞系中探讨PTEN基因敲减通过相关信号通路如PI3K/AKT/mTOR、wnt/β-catenin等影响施万细胞的增殖及凋亡情况,进而解释脊髓损伤、周围神经缺损的发生发展原因,寻找促进损伤修复的方法及可能机制。因此,本研究应用慢病毒转染技术敲低了RSC96施万细胞系中PTEN基因的表达,为研究骨科疾病提供方法学基础。
1 材料与方法
1.1 材料
RSC96施万细胞系(中科院上海细胞库提供),质粒提取试剂盒(TIANGEN公司提供),引物(上海吉凯基因科技有限公司、GeneRay公司提供),Taq Plus DNA聚合酶(Vazmye公司提供),NormalRunTM250 bp-II DNA Ladder(GeneRay公司提供),Top10感受态细胞(Genechem公司提供),T4 DNA连接酶(Thermo Scien⁃tific公司提供),限制性核酸内切酶(NEB公司提供),GeneRuler 1 kb DNA Ladder(Thermo Scientific公司提供),293T细胞(上海细胞所提供),HIV-1 p24 Antigen ELISA 2.0试剂盒(北京达科为生物技术有限公司提供),吉凯转染试剂(上海吉凯基因科技有限公司提供),DMEM(Corning公司、Hyclone公司提供),胎牛血清(Ausbian公司、上海微科生化试剂有限公司提供),嘌呤霉素(Clontech公司、Sigma公司提供),胰酶(生工生物工程(上海)股份有限公司提供),DMSO(上海试一化学试剂有限公司提供),台盼兰(Sigma公司提供),D-Hanks(上海吉凯基因科技有限公司提供),SYBR Master Mixture(TAKARA公司提供),RNA酶抑制剂(Promega公司提供),oligo dT(上海生工提供),M-MLV试剂盒(Promega公司提供),Bulge-LoopTM miRNA qPCR Primer试剂盒(广州锐博公司提供),dNTPs(pro⁃mega公司提供),Trizol(上海普飞公司提供)。
1.2 RNAi慢病毒载体构建
引入吉凯基因的AgeⅠ、EcoRⅠ两个酶切位点(酶切体系见表1),体系配好吹打均匀并短暂离心,37℃反应3 h或过夜,产物行琼脂糖凝胶电泳后回收目的条带。针对PTEN基因序列,根据RNAi序列设计原则,设计一条大鼠PTEN-RNAi靶点序列AACCCACCACAGCTAGAACTT,GC含量47.62%,Start Pos.为280;对照插入序列TTCTCCGAACGTGT⁃CACGT。采用吉凯基因GV248(框架结构hU6-MCSUbiquitin-EGFP-IRES-puromycin)载体构建PTENRNAi-a和PTEN-RNAi-b两条目的基因框架,以及CON-RNAi-a和CON-RNAi-b两条对照基因框架(表2)。合成好的引物干粉溶于退火液,90℃水浴15 min,冷却至室温。T4DNA连接酶于16℃1~3 h或过夜连接退火双链DNA和载体。产物加入感受态细胞,阳性克隆的菌落通过PCR进行鉴定(PCR引物:+5’CCATGATTCCTTCATATTTGC3’;-5’ AT⁃GTCCTTCTGCTGATACTGGG 3’)。测序后进行质粒抽提,合格的质粒用于后续实验。

表1 酶切体系
1.3 RNAi慢病毒包装
取培养于10 cm培养皿中的生长良好的293T细胞,于转染前2 h更换为无血清培养基;无菌离心管中加入制备的各DNA溶液(含有GV载体质粒20 μg、pHelp1.0载体质粒15 μg、pHelp2.0载体质粒10 μg),与一定体积的吉凯转染试剂相混合,调整总体积为1 ml,室温温育15 min;滴加至293T细胞中混匀,于5%CO2、37℃下培养6 h;PBS洗涤转染混合物;10%FBS、5%CO2、37℃下培养2~3 d;收集细胞上清液于4℃、4000g离心10 min;0.45 μm滤器过滤;含病毒的上清液于Beckman超速离心机中4℃、25000 rpm离心2 h;弃上清加病毒保存液重悬;10000 rpm离心5 min后分装;对慢病毒进行物理状态、无菌、病毒滴度检测。病毒滴度计算公式为:病毒滴度=荧光细胞数/病毒原液量。

表2 PTEN-RNAi及对照构建框架
1.4 细胞感染
取生长状态良好的RSC96细胞,铺12孔板,3~5×104个细胞/孔,待细胞长至20%时进行转染,细胞分为空白组、阴性对照慢病毒转染组、PTEN-RNAi慢病毒转染组3组,感染复数(multiplicity of infection,MOI)为5或10,感染增强液Eni.S辅助感染。感染16 h时换液,感染72 h时进行荧光拍照。
1.5 荧光定量PCR反应检测RSC96细胞中慢病毒转染后PTEN基因mRNA的表达情况
以GAPDH为内参基因,收集细胞用Trizol裂解液裂解,加入氯仿静置10 min,12800 rpm、4℃离心15 min,取上层液体加入异丙醇4℃静置10 min,12800 rpm、4℃离心15 min弃上清,75%乙醇洗涤,11800 rpm、4℃离心5 min弃上清,11800 rpm、4℃离心5 min再次弃上清,室温干燥,RNA-free水溶解沉淀,分光光度计测RNA质量及浓度。1 μl Oligo dT(0.5 μg/μl)和2 μg总RNA加RNA-free水配成10 μl溶液,离心后于70℃温育10 min,冰育退火,用Promega M-MLV试剂盒配置反转录体系,42℃水浴1 h,70℃水浴10 min,cDNA产物-20℃保存备用。按RNA PCR体系配置溶液,二步法完成扩增,采用2-ΔΔCt法开展数据分析,引物序列见表3。

表3 PTEN及GAPDH引物序列
1.6 统计学方法
所有计量资料采用均数±标准差表示,不同组别样本之间采用独立样本t检验,P<0.05说明差异有统计学意义,数据分析应用SPSS 21.0软件。
2 结果
2.1 PTEN基因RNAi慢病毒载体的制备及鉴定
转化感受态细胞后的阳性克隆菌落PCR电泳结果见图1。在本模型建立过程中,连接入慢病毒短发夹状RNA(vshRNA)片段的阳性克隆PCR片段大小为534 bp,空载体克隆PCR片段大小为500 bp,通过软 件 读 取 可 知,ccggAACCCACCACAGC⁃TAGAACTTttcaagagaAAGTTCTAGCTGTGGT⁃GGGTTtttttg序列插入正确,PTEN-RNAi框架可用。
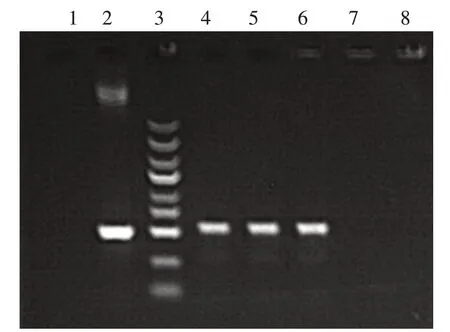
图1 阳性克隆电泳鉴定
2.2 携带PTEN基因的慢病毒包装及滴度鉴定
将PTEN-RNAi慢病毒质粒转染293T细胞,作用1 d后,荧光显微镜下观察293T细胞中荧光表现情况(图2)。根据病毒滴度计算公式得,该慢病毒的滴度为8E+8TU/mL。
2.3 携带PTEN基因的慢病毒的质量检测
细胞中若存在支原体、衣原体、细菌、真菌或内毒素等病原微生物时,会对细胞产生不利影响,从而影响实验结果。为了避免这些病原微生物的作用,我们采用NESTPCR检测支原体,采用培养法检测衣原体、细菌和真菌,采用LAL法检测内毒素,结果显示PTEN-RNAi慢病毒中支原体、衣原体、细菌、真菌和内毒素均为阴性,可以用于后续实验。
2.4 携带PTEN基因的慢病毒感染RSC96细胞

图2 PTEN-RNAi慢病毒转染293T细胞(200×)
RSC96施万细胞铺12孔板后,当细胞长到20%进行转染。用病毒滴度为8E+8TU/ml的PTEN-RNAi慢病毒转染,当MOI为10时,使用慢病毒1.25μl;当MOI为5时,使用慢病毒0.625 μl。用病毒滴度为1E+9TU/mL的阴性对照慢病毒转染,当MOI为10时,使用慢病毒1μl;当MOI为5时,使用慢病毒0.5 μl(图3、4)。转染后的RSC96施万细胞生长状态良好,无污染,可用于后续实验。
2.5 携带PTEN基因的慢病毒感染RSC96细胞后细胞中PTEN基因mRNA的表达情况
通过RT-PCR检测RSC96施万细胞中PTEN基因的敲减情况。阴性对照慢病毒转染组和PTENRNAi慢病毒转染组均感染3次,阴性对照慢病毒转染组PTEN基因mRNA的表达情况分别为1.0067±0.1370、1.0023±0.0886、1.0043±0.1141,PTEN-RNAi慢病毒转染组PTEN基因的表达情况分别为0.2533±0.0185、0.2177±0.0186、0.2257±0.0200,3次感染均有统计学差异(P<0.05)。感染3次后,计算3次平均值作为RSC96细胞中PTEN基因的相对表达量,PTEN基因的相对表达量在阴性对照慢病毒转染组为1.0044±0.0022,在PTEN-RNAi慢病毒转染组为0.2322±0.0187,敲减效率为76.78%,两组之间有统计学差异(P<0.01,图5)。由此可知,我们设计的AACCCACCACAGCTAGAACTT靶点序列是一个有效的靶点序列,成功建立起慢病毒介导的PTEN基因表达降低的RSC96施万细胞系模型。
3 讨论
PTEN基因又被称为TEP1(TGF-regulated and epithelial cell-enriched phosphatase)和MMAC1(mu⁃tated in multiple advanced cancer 1),编码由403个氨基酸组成的具有双重磷酸酶活性的蛋白质,可通过拮抗酪氨酸激酶等抑制肿瘤发生,是一种研究广泛的抑癌基因。MAPK信号通路和PI3K/AKT信号通路是调控PTEN基因的关键通路[20],此外,Wnt、NF-κB等通路也能受到PTEN基因的影响,在各种生理病理过程中起到作用[21]。PTEN基因对细胞功能影响较大,可以调节多种细胞的细胞周期,并通过调控细胞迁移及凋亡影响细胞寿命,进而发挥抑癌功能[22]。近些年研究发现,PTEN基因在脑缺血[23]、纤维化[24]、银屑病[25]等疾病中也起到作用,可以说参与了临床上多个科室多种疾病的过程,也因此受到研究者的重视。
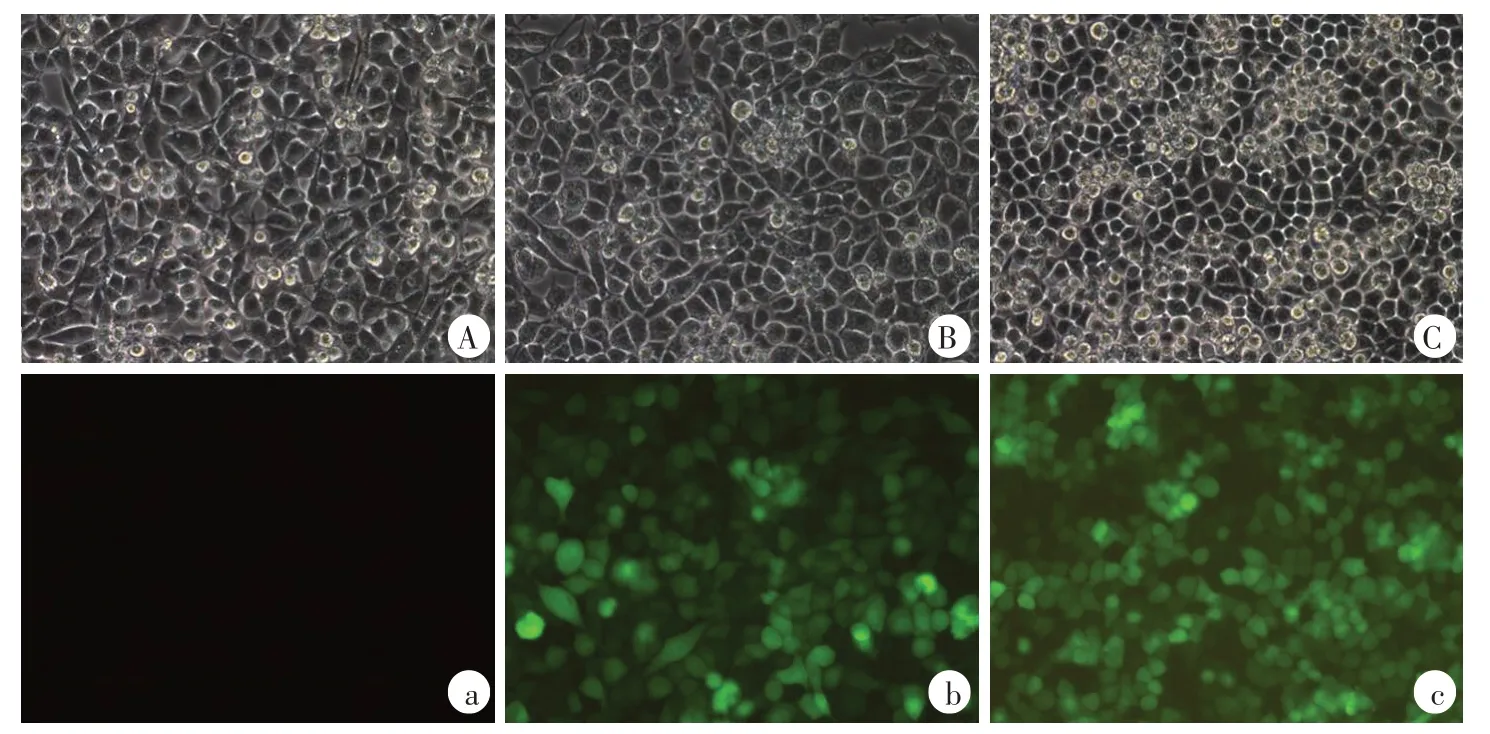
图3 MOI为10时PTEN-RNAi慢病毒转染RSC96施万细胞(200×)
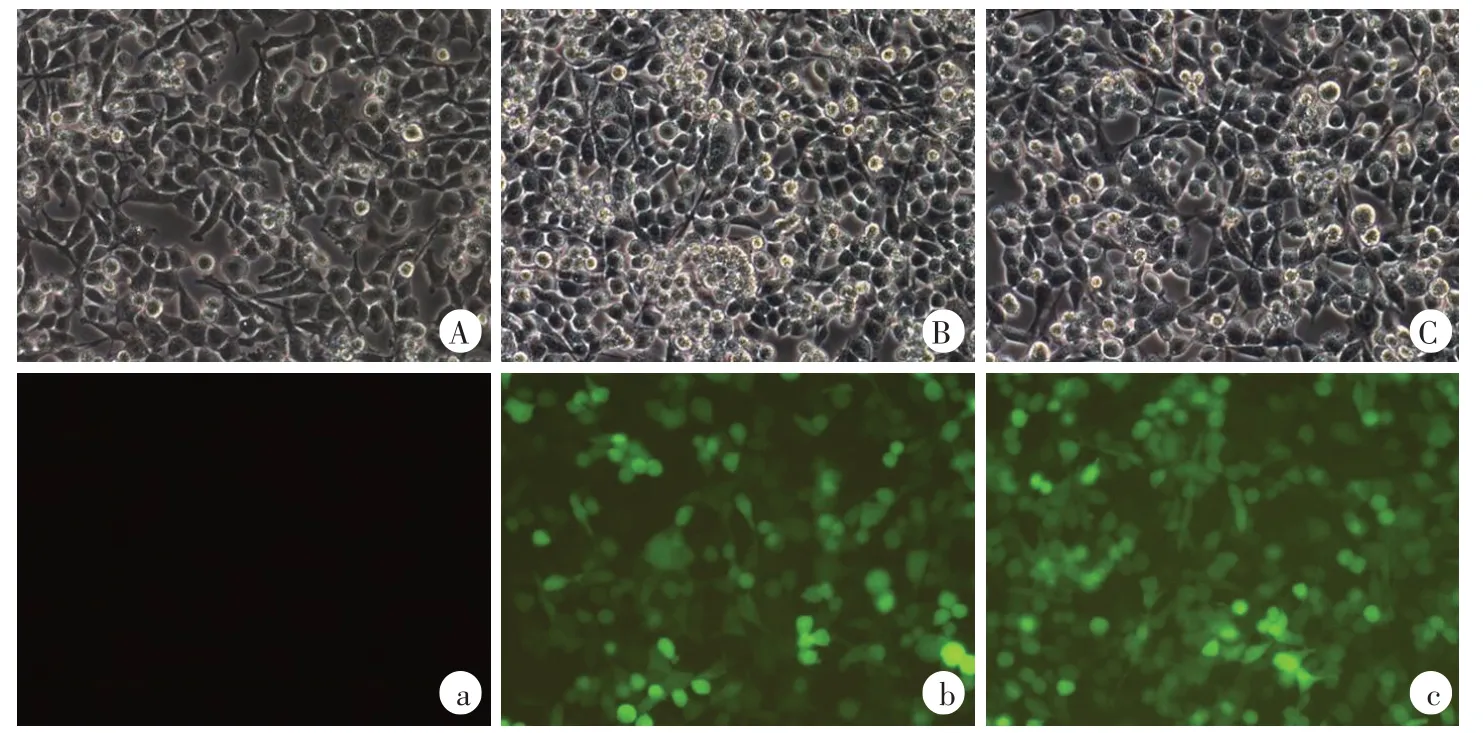
图4 MOI为5时PTEN-RNAi慢病毒转染RSC96施万细胞(200×)

图5 PTEN基因mRNA的表达情况
在骨科领域,PTEN基因也发挥了重要作用。Huang等[26]研究发现,小分子RNA Mir-26a-5p可以通过PTEN/PI3K/AKT信号通路的作用影响纤维细胞的增殖、侵袭和凋亡,进行调控类风湿性关节炎的发展;Zhang等[27]则认为,小分子RNA Mir-130a可以通过上述通路调节软骨细胞的增殖,减轻骨关节炎的病情。Lugo等[28]应用PTEN基因条件性敲除的小鼠研究发现,小鼠大脑中PTEN基因敲除后,骨骼骨质疏松,更容易发生骨折。Li等[29]则发现,MYB因子诱导下上调小分子RNAMir-363-3p后,可以在PTEN基因相关通路的影响下调节骨质疏松症的过程。此外,PTEN基因在大鼠周围神经发育及损伤修复中起到重要作用[30],参与了急性脊髓损伤中轴突生长和功能的恢复[31]。由此可知,PTEN基因可以作为临床上治疗各种骨科疾病的潜在靶点。
RSC96施万细胞系是一种在骨科领域应用广泛的细胞[32],尤其是创伤骨科、脊柱外科、手外科领域。在一般的细胞研究中,所用的细胞量是较多的,使用原代施万细胞需要较长的培养周期,限制了研究的进展,而应用RSC96施万细胞系则可以弥补这些不足,该细胞不仅保留了原代施万细胞的特征,还能够进行多次传代,培养条件也比原代施万细胞简单[33]。我们通过查阅文献发现,敲减PTEN基因的RSC96施万细胞模型鲜有报道,因此设计了本研究,建立PTEN基因表达降低的RSC96施万细胞系模型。
病毒作为基因转染中的一种工具,具有良好的特性,其可以将自身携带的目的基因整合到宿主细胞的DNA分子上,从而使重组的DNA分子可以随细胞分裂而稳定地遗传下去,在细胞系中形成一种稳转株。目前常用的病毒载体主要有三种:慢病毒、腺病毒和重组腺相关病毒[34]。本研究使用的是慢病毒,该病毒是在人类免疫缺陷I型病毒(human immunode⁃ficiency virus-1,HIV-1)基础上发展起来的一种单链RNA病毒,可插入最大约10 kb的外源基因片段。慢病毒既可以转染分裂细胞,也可以转染非分裂细胞,对原代培养的细胞转染效率也较高,有较好的优势。本课题组在前期研究中,通过慢病毒转染建立了SIRT1基因表达降低的ATDC5细胞模型[35],并在此基础上发现ATDC5细胞中SIRT1基因表达降低可以通过抑制Wnt信号通路造成该细胞退变[36]。Liu等[37]应用慢病毒转染技术将骨肉瘤细胞中BTF3基因沉默,发现骨肉瘤细胞的增殖受到抑制。也有研究者将慢病毒介导的microRNA-26a转染骨髓间充质干细胞造成细胞中小分子RNA过表达,将其用于小鼠颅骨缺损修复,取得了良好的效果[38]。由此可知,慢病毒转染技术在骨科领域应用广泛。
我们在研究中设计了大鼠PTEN基因的RNAi特异性序列,并用吉凯基因的GV248载体将其连接,成功构建了PTEN-RNAi框架,并将其包装成慢病毒后感染RSC96施万细胞,感染后的细胞状态良好,通过RT-PCR检测发现,与阴性对照病毒转染组相比,PTEN-RNAi慢病毒转染后,RSC96施万细胞中PTEN基因的表达量明显降低,敲减效率达76.78%。建立该细胞模型后,我们可以在其基础上对周围神经损伤后效应器与中枢相互作用的重塑过程进行深入研究,或者探讨干预分子靶点促进脊髓损伤后的修复进程的可能性,为进一步了解PTEN基因在这些过程中的作用及可能机制做铺垫,从而最终为临床治疗相关疾病寻找新的分子靶点。
本研究也有不足之处,首先,采用的RSC96细胞为细胞系,这与原代细胞有所区别,细胞系虽能多次传代,但与来源于生物体本身的原代细胞的生长分裂情况不同,所得的研究结果需要进一步分析或在原代细胞、动物层面进行验证后才能得到更加准确的结论。其次,缺少在此细胞模型上的深入机制研究,当然这也为我们进一步的研究内容提供了方向。
综上所述,本研究成功设计出一条可用于PTEN基因干扰的RNAi序列,并包装成滴度及转染效率均较高的慢病毒,将其转染RSC96施万细胞后,成功构建了PTEN基因表达降低的RSC96施万细胞系模型,为我们团队及其他研究者应用细胞模型研究PTEN基因敲减在骨科疾病发生发展中的功能及通过相关信号通路促进疾病修复的实验奠定了良好的基础。
