考氏科萨克氏菌产阿魏酸酯酶条件优化、酶学性质及其初步应用
2021-03-11章宇丹温雪瓶刘雪娇冯洁雅
章宇丹,温雪瓶,李 丽*,刘 军,刘雪娇,冯洁雅
(四川轻化工大学 生物工程学院,四川 宜宾 644005)
阿魏酸酯酶(ferulic acid esterase,FAE)E.C.3.1.1.73又名肉桂酸酯酶或肉桂酰酯酶,可以水解阿魏酸酯、多糖阿魏酸酯和低聚糖阿魏酸酯,属于羧酸酯水解酶的一个亚类[1]。该酶能够水解植物细胞壁中阿魏酸或相关肉桂酸与多糖如阿拉伯木聚糖、果胶之间的酯键,释放出游离的阿魏酸或阿魏酸二聚体[2],从而对植物细胞壁起到降解作用[3]。阿魏酸酯酶还可以与木聚糖酶、β-葡萄糖苷酶、纤维素内酯酶等协同作用更加彻底的降解植物细胞壁[4]。由于FAE的作用功能使得其在食品、饲料、纺织、造纸、医药、农业、生物能源等领域均有广泛的应用[5-8]。
阿魏酸又名4-羟基-3-甲氧基肉桂酸,是一种存在于许多植物细胞壁中的一种重要的酚酸物质,如高粱、芦根、麦秆、麦麸、米糠、玉米皮、洋葱皮、发酵茶等植物细胞壁中,具有抗氧化、抗血栓、抗辐射、抗血小板凝集、改善心脑血管健康、对老年人具有恢复和改善记忆等功能[9-13]。阿魏酸可作为特定保健用食品素材,也可作为有益于人体健康的益生元功能配料应用于食品饮料和膳食补充剂[14-15]。酒中阿魏酸的产生可以是在制曲和发酵过程中被微生物释放出来,也可以是在制曲和发酵过程中形成中间产物,再由微生物转化成阿魏酸,阿魏酸酯酶可以打破植物细胞壁中的酯键,进而释放阿魏酸[16-20]。据目前研究表明酿酒原料中的阿魏酸释放率很低,研究提高酿造过程中阿魏酸的释放量是很有必要的[21]。
国外没有固态发酵的酿制白酒方式,因此对白酒中阿魏酸的研究较少。国内目前对阿魏酸的研究主要集中在饲料、纺织、造纸、医药、农业、生物能源等领域。随着我国国民收入水平的提高,人们对生活质量的要求也越来越高,在保障白酒安全生产的同时还要让白酒有益于消费者的健康,健康饮酒已经成为中国白酒的新趋势。利用科技力量,剖析传统工艺白酒中的成分以及找寻天然植物中的健康成分。
本试验以前期从浓香型白酒酿造过程中筛选出的一株产阿魏酸酯酶菌株考氏科萨克氏菌(Kosakonia cowanii)为研究对象,对产酶条件进行优化,并研究该菌株产阿魏酸酯酶酶活性质及在麸皮、糟醅和大曲中的发酵应用。本研究旨在为之后研究提高白酒中的阿魏酸含量奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和材料
考氏科萨克氏菌(Kosakonia cowanii):本实验室保存;大曲、糟醅:泸州某酒厂;麸皮:市售。
1.1.2 化学试剂
NaCl、琼脂粉、(NH4)2SO4、MgSO4·7H2O、C6H8O7·H2O、甲醇、Na2HPO4·2H2O、KH2PO4、CaCl2·2H2O(均为分析纯):成都市科龙化工试剂厂;酵母浸粉、蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;二甲基甲酰胺、FeCl3(均为分析纯):上海麦克林生化科技有限公司;阿魏酸乙酯、阿魏酸甲酯(均为分析纯):阿拉丁控股集团有限公司;醋酸(分析纯):赛默飞世尔科技有限公司。
1.1.3 培养基
发酵培养基:(NH4)2SO41.3 g,MgSO4·7H2O 0.25 g,KH2PO40.37 g,CaCl2·2H2O 0.07 g,FeCl30.02 g,酵母粉1.0 g,5 mL阿魏酸乙酯溶液(含10%的二甲基甲酞胺,V/V),水1 L。121 ℃灭菌20 min。
1.2 仪器与设备
LS-28HD立式压力蒸汽灭菌器:江阴滨江医疗设备有限公司;TGL-16M离心机:湘仪离心机仪器有限公司;SWCJ-1FD超净工作台:上海沪净医疗器械有限公司;HWS-260A恒温恒湿培养箱:杭州绿博仪器有限公司;SPH-1102恒温摇床:上海世平试验设备有限公司;T6新世纪紫外分光光度计:北京普析通用仪器有限责任公司;1200型高效液相色谱(high performance liquid chromatography,HPLC)仪:美国Agilent公司。
1.3 方法
1.3.1 粗酶液的制备[22]
菌株Kosakonia cowanii以1%的接种量接种于发酵培养基中,置于180 r/min、32 ℃恒温摇床中培养72 h,发酵完后取9 mL发酵液在转速为10 000 r/min、4 ℃条件下离心10 min,保留上清液,即获得粗酶液。
1.3.2 酶学特性的研究
(1)酶的最适温度及稳定性
取2 mL缓冲液(pH 6.0)于试管中,加入2 mL 1 mmol/L阿魏酸甲酯溶液,分别放置于温度为30 ℃、40 ℃、50 ℃、60 ℃、70 ℃的水浴锅中反应5 min,再分别加入1 mL酶液,水浴20 min,沸水灭酶终止反应,混匀后以对照组为空白(失活的酶液)测定波长320 nm处的吸光度值,以酶活最高者为100%,计算相对酶活性[23]。
将粗酶液分别放置于温度为30 ℃、40 ℃、50 ℃、60 ℃的水浴锅中保温50 min,每隔10 min检测一次酶活性,统一在50 ℃水浴锅中反应。以各温度的初始酶活为100%,计算相对酶活性。
(2)酶的最适pH及稳定性
取2 mL缓冲液(pH 2.6、3.2、3.8、4.4、5.0、5.6、6.2、6.8、7.4、8.0)于试管中,加入2 mL 1 mmol/L阿魏酸甲酯溶液,置于50 ℃水浴锅中反应5 min,再分别加入1 mL酶液,在50 ℃水浴锅中反应20 min,沸水终止反应,混匀后以对照组为空白(失活的酶液)测定波长320 nm处的吸光度值,以酶活最高者为100%,计算相对酶活性。配制不同pH(3.2、3.8、4.4、5.0、5.6、6.2、6.8、7.4、8.0)缓冲液,与粗酶液等量混合,在4 ℃冰箱中放置2 h,测定剩余酶活,以各pH值的初始酶活为100%,计算相对酶活。
1.3.3 产酶条件的优化
(1)单因素试验
菌株Kosakonia cowanii预先进行活化,以接种量分别为0.5%、1.0%、2.0%、4.0%、6.0%接种到培养基中,装液量分别为30 mL/250 mL、60 mL/250 mL、90 mL/250 mL、120 mL/250 mL、150 mL/250 mL,初始pH值分别为5.0、5.5、6.0、6.5、7.0、8.0,分别置于温度为28 ℃、31 ℃、34 ℃、37 ℃、40 ℃的摇床中,180 r/min培养72 h,检测酶活,考察不同接种量、装液量、初始pH值、温度对酶活的影响,每个试验设置3个平行样。
1.3.4 分析检测
(1)阿魏酸酯酶酶活检测
检测方法:取9 mL发酵液10 000 r/min离心10 min,取上清液,即获得粗酶液。取2 mL阿魏酸甲酯溶液和2 mL柠檬酸缓冲液(pH 6.0)在温度为50 ℃水浴锅中水浴5 min,再加入1 mL粗酶液,反应20 min,沸水灭酶终止反应,以煮沸失活的酶液为空白,在波长320 nm条件下测定溶液吸光度值。
阿魏酸酯酶酶活定义:1 mL酶液在50 ℃、pH 6.0条件下,每分钟酯解阿魏酸甲酯,生成1 μmol阿魏酸所需酶量定义为1个酶活力单位(U/mL)。
(2)阿魏酸检测
检测方法:在糟醅、大曲和麸皮三角瓶中加入体积分数70%甲醇,所加体积分别为45 mL、55 mL、80 mL,放置于温度为30 ℃、180 r/min的摇床中摇30 min,然后10 000 r/min离心10 min,获得上清液,将上清液用0.22 μm滤膜过滤,进行HPLC分析。并按照标准曲线回归方程y=-8.633 3+53.960 4x(R2=0.999 95)计算阿魏酸含量[24]。
色谱条件:ZORBAX SB-Aq色谱柱(4.6 mm×250 mm,5 μm),紫外检测器,检测波长320 nm,柱温25 ℃,流动相为甲醇和5%醋酸(25∶75,V/V),流速1 mL/min,进样量10 μL[25]。
1.3.5 菌株初步应用探究
(1)麸皮发酵
麸皮与水的料液比为1∶1(g∶mL),将称好的麸皮放入盆中,加水拌匀,称取40 g装入三角瓶中,共8瓶,灭菌。将菌株进行活化,以3%的接种量接种到灭菌的麸皮中,放置于温度为34 ℃的培养箱中进行有氧发酵,每天检测阿魏酸含量,空白组为不加菌的麸皮。设置3个平行。
(2)糟醅发酵
称取45 g糟醅加入已灭菌的三角瓶中,用保鲜膜封口,共15瓶,分为两组,一组为实验组,共7瓶,一组为对照组,每组8瓶。将菌株进行活化,以3%的接种量接种到实验组中,将实验组和对照组都放置于温度为34 ℃的培养箱中进行厌氧发酵,每天检测阿魏酸含量,对照组不加菌。设置3个平行。
(3)大曲发酵
称取35 g大曲加入已灭菌的三角瓶中,共15瓶,分为两组,一组为实验组,共7瓶,一组为对照组,每组8瓶。将菌株进行活化,以3%的接种量接种到实验组中,将实验组和对照组都放置于温度为34 ℃的培养箱中进行有氧发酵,每天检测阿魏酸含量,对照组不加菌。设置3个平行。
1.3.6 数据处理
试验结果采用平均值±标注误差表示,使用SPSS 22.0进行单因素方差分析,并采用Duncan检验法进行多重比较,以P<0.05作为差异性显著判断标准。
2 结果与分析
2.1 发酵产酶条件的优化
2.1.1 装液量对产酶的影响
由图1可知,培养基装液量对酶活是有影响的,当装液量为30~90 mL/250 mL时,随着装液量的增加而增加;装液量达到90 mL/250 mL时,酶活最大,为28.27 U/L;当装液量>90 mL/250 mL后酶活逐渐减小。因此,最适装液量为90 mL/250 mL。
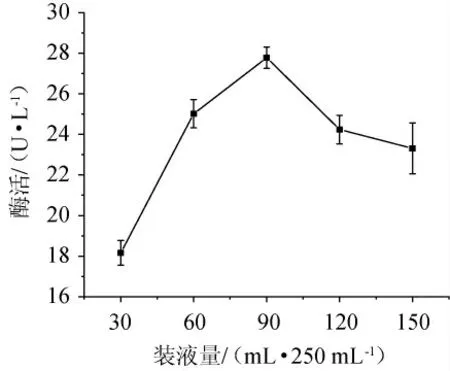
图1 装液量对产酶的影响Fig.1 Effect of liquid medium volume on enzyme production
2.1.2 培养基初始pH值对产酶的影响
由图2可知,培养基的初始pH值对于微生物的生长和产酶都有一定的影响。不同的初始pH对菌株产酶是有影响的,该菌株在初始pH值为5.0~8.0范围下均能产酶,在初始pH值为5.5时,酶活最大,约为27.34 U/L。随着初始pH值的增大,酶活呈递减趋势。因此,最适初始pH值为5.5。

图2 培养基初始pH对产酶的影响Fig.2 Effect of medium initial pH value on enzyme production
2.1.3 接种量对于产酶的影响
由图3可知,不同的接种量对酶活是有影响的,随着接种量在0.5%~4.0%范围内的提高,酶活随之增高,当接种量为4%,酶活最高,为27.12 U/L;当接种量>4%后,酶活减少。

图3 接种量对产酶的影响Fig.3 Effect of inoculum on enzyme production
2.1.4 温度对产酶的影响
由图4可知,温度的变化影响酶活的大小,随着温度在28~34 ℃范围内的升高,酶活呈递增趋势,当温度为34 ℃时,酶活最高;当温度>34 ℃后随着温度的升高,酶活呈递减趋。

图4 温度对产酶的影响Fig.4 Effect of temperature on enzyme production
2.1.5 优化后产酶情况
根据前面的研究,将菌株以4%接种量接种到培养基中,装液量为90 mL/250 mL,初始pH为5.5,在温度为34 ℃、180 r/min条件下培养3 d,检测酶活。结果表明,优化后酶活为28.27 U/L,比优化前提高了20.92%。
2.2 酶学特性的研究
2.2.1 酶最适温度及热稳定性
阿魏酸酯酶的最适温度及热稳定性,最适pH值及pH稳定性分别见图5和图6。

图5 阿魏酸酯酶的最适温度(A)及热稳定性(B)Fig.5 Optimal temperature (A) and thermal stability (B) of ferulic acid esterase
由图5A可知,当温度<50 ℃时,酶活呈逐渐上升状态,这是因为在此温度范围内,随着温度的升高,促进了反应速度;当温度为50 ℃,此时相对酶活最高为100%;当温度>50 ℃时,随着温度的升高,酶活呈下降状态,这是因为过高的温度会导致酶蛋白开始变形。因此,酶的最适温度为50 ℃。
由图5B可知,阿魏酸酯酶在30~40 ℃范围内时稳定性很好,在温度为50 ℃时表现出较好的稳定性,50 ℃保温50 min后,酶活仍保留58.96%。但当温度为60 ℃时,阿魏酸酯酶稳定性较差,保温50 min后残余酶活不到20%。
2.2.2 酶最适pH及pH稳定性
由图6A可知,pH值为5.6时相对酶活最高为100%,两边呈递减状态,这是因为pH会改变底物分子和酶分子的带电状态,进而影响酶和底物的结合,而且过高或过低的pH都会影响酶的稳定性,从而使酶遭受不可逆的破坏。因此,酶的最适pH值为5.6。

图6 阿魏酸酯酶的最适pH值(A)及pH稳定性(B)Fig.6 Optimal pH value (A) and pH stability (B) of ferulic acid esterase
由图6B可知,酶活在pH值为5.0~6.8范围内放置2 h,其酶活稳定性较好,残余酶活均在80%以上,pH值在3.2~3.8范围内,酶活稳定性较差。
2.3 菌株Kosakonia cowanii初步应用
2.3.1 麸皮发酵
由图7可知,麸皮发酵提取液在1~7 d,麸皮发酵释放阿魏酸的含量呈现上升趋势。空白组的麸皮阿魏酸含量为13.374 μg/g,麸皮发酵至第7天时的阿魏酸含量为16.3 715 μg/g,比空白组的麸皮阿魏酸含量提高了22.42%,该菌株发酵麸皮产生的阿魏酸酯酶,能够释放麸皮中的阿魏酸,从而提高释放的阿魏酸含量,说明菌株发酵能够提高麸皮中阿魏酸的释放。

图7 麸皮发酵对阿魏酸含量的影响Fig.7 Effect of bran fermentation on ferulic acid content
2.3.2 糟醅发酵
由图8可知,第0天的糟醅发酵提取液中阿魏酸的含量为11.136 6 μg/g,接菌的糟醅发酵第一天的阿魏酸含量与发酵0 d的糟醅发酵提取液中的阿魏酸含量相比有所增加,第二天之后呈现下降趋势,可能是因为前期三角瓶中含有氧气,菌株能够生长,产生的阿魏酸酯酶释放了糟醅中的阿魏酸,没有氧气后,糟醅中的阿魏酸不再被释放,又因为阿魏酸被分解,所以阿魏酸的含量逐渐减少。对照组中糟醅的阿魏酸被分解,含量逐渐减少,没有上升的过程。说明菌株在前期有氧条件下能起到释放阿魏酸的作用的;氧气消耗完后,菌株停止产酶,阿魏酸含量逐渐降低。

图8 糟醅发酵对阿魏酸含量的影响Fig.8 Effect of distilled grains fermentation on ferulic acid content
2.3.3 大曲发酵
由图9可知,第0天的大曲发酵提取液中阿魏酸的含量为4.054 8 μg/g,实验组中的阿魏酸含量呈现递增的趋势。这是因为实验组中接种的菌株产生阿魏酸酯酶,释放了大曲中的阿魏酸,所以阿魏酸含量呈递增趋势。对照组中阿魏酸含量呈现先递减后递增的趋势,出现递增的趋势可能是因为大曲中本身含有可以产阿魏酸酯酶的菌株,使大曲中的阿魏酸被释放出来,所以出现递增的趋势。出现递减的趋势可能是因为前期阿魏酸的分解速度大于阿魏酸酯酶释放阿魏酸的速度,所以出现递减的趋势。但是对照组与实验组相比,对照组中的阿魏酸被释放的含量较少,说明添加菌株有利于释放大曲中阿魏酸,且能够增加释放阿魏酸的速度。

图9 大曲发酵对阿魏酸含量的影响Fig.9 Effect of Daqu fermentation on ferulic acid content
3 结论
通过单因素优化培养条件为:装液量90 mL/250 mL、培养基初始pH值为5.5、接种量4%、温度34 ℃。在此优化条件下,酶活最高,酶活比优化前提高了20.92%。阿魏酸酯酶最适反应温度为50 ℃,在30~40 ℃时稳定性良好;阿魏酸酯酶最适反应pH值为5.6,在pH值为5.0~6.8酶活稳定性良好。通过菌株的初步应用探究得出,菌株能够增加麸皮、大曲和糟醅中阿魏酸的释放量,使得样品中阿魏酸含量增加,为后续阿魏酸酯酶在白酒酿造中的应用奠定了一定基础。
