miR-19b对H2O2诱导的大鼠心肌细胞H9c2氧化应激损伤的保护作用及机制研究
2021-03-11阮怀玉廖小婷曾彬
阮怀玉 廖小婷 曾彬
(武汉大学人民医院心内科 武汉大学心血管病研究所 心血管病湖北省重点实验室,湖北 武汉 430060)
近年来,氧化应激在心血管疾病发展过程中的重要作用越来越受到关注,研究[1]表明氧化应激可引起心肌缺血、心肌缺血再灌注损伤以及心肌重构等一系列病理过程的发生,最终导致心肌细胞坏死和凋亡。心肌细胞是高度分化的细胞,不可再生,因此干预氧化应激和减少心肌细胞凋亡成为心血管疾病治疗的研究热点。最新研究发现,miRNA是心血管疾病重要的调控因子[2],并且也已证明多种miRNA参与心血管疾病的发生和发展,如miR-26[3]、miR-21[3-4]和miR-221[5-6]等。近年来研究发现miR-19b在心力衰竭中低表达[7],并可通过抑制心肌细胞凋亡和靶向BCL2L11/BIM来逆转缺血性心力衰竭[8],也与心肌梗死的发生密切相关[9],但其对心肌细胞氧化应激的作用还少见报道。因此,本研究将探讨miR-19b在H2O2诱导的大鼠心肌细胞H9c2损伤中的保护作用及具体机制。
1 材料与方法
1.1 实验材料
大鼠心肌细胞H9c2由湖北省心血管病重点实验室提供,高糖DMEM培养基和胎牛血清购自Gibco公司,CCK8溶液和胰蛋白酶等购自Sigma公司,Lipofectamine 2000和Trizo试剂盒等购自Invitrogen公司,AnnexinV-FITC细胞凋亡试剂盒购自天津三箭技术有限公司,超氧化物歧化酶(SOD)、乳酸脱氢酶(LDH)、丙二醛(MDA)和还原型谷胱甘肽(GSH)等检测试剂盒均购自南京建成生物工程研究所。
1.2 H9c2细胞的培养
(1)从-80 ℃冰箱中取出细胞迅速放入37 ℃水浴快速解冻,加入5 mL培养基重悬细胞并离心5 min。(2)弃去上清液,加入5 mL培养基重悬细胞接种于培养皿内,用含10%胎牛血清的DMEM培养液在37 ℃、5%CO2条件下培养。(3)当细胞融合到90%时进行传代,后取处于对数生长期的细胞用胰蛋白酶处理后待用。
1.3 细胞分组与转染
实验分为6组:(1)空白对照组(L1组):正常培养的H9c2细胞;(2)H2O2组(L2组):H2O2(浓度400 μmol/L)处理2 h建立氧化损伤模型;(3)H2O2+miR-19b mimic阴性对照(NC)组(L3组):转染miR-19b mimic NC;(4)H2O2+miR-19b mimic组(L4组):转染miR-19b mimic;(5)H2O2+miR-19b inhibitor组(L5组):转染miR-19b inhibitor;(6)H2O2+miR-19b inhibitor NC组(L6组):转染miR-19b inhibitor NC。以上各组转染后用H2O2处理2 h。
1.4 CCK8实验
(1)将100 μL的细胞悬液配置在96孔板中并将其放在培养箱预培养24 h;(2)将6组待测物质各10 μL分别加在培养板内;(3)继续将培养板在培养箱培养24 h;(4)向每孔分别加入10 μL CCK8溶液;(5)用酶标仪测定450 nm处吸光度。细胞活力(%)=[A(实验孔吸光度)-A(空白孔吸光度)]/[A(对照孔吸光度)-A(空白孔吸光度)]×100。
1.5 RT-PCR法检测miR-19b表达量
各组细胞转染48 h后,总RNA用Trizol试剂提取并进行逆转录。用PCR试剂盒对miR-19b和U6进行荧光定量PCR扩增,以U6为内参对各组miR-19b的表达进行校正。反应体系总共20 μL,其中cDNA 2 μL,上下游引物各1 μL,qPCR试剂为10 μL,其余为ddH2O。反应条件为:在95 ℃温度下,进行5 min的预变性,然后再95 ℃变性15 s,60 ℃退火30 s,进行40个循环。计算miR-19b的相对表达量:△Ct=Ct目的基因-Ct内参基因,由公式2-△△Ct计算的值代表了miR-19b的相对表达量。实验共进行3次。
1.6 流式细胞术检测细胞凋亡
取处于对数生长期的各组细胞接种于6孔板中,转染24 h后,各组细胞分别离心、消化、收集,然后用磷酸盐缓冲溶液洗涤2次并离心弃去上清液。将200 μL结合缓冲液加入收集到的细胞沉淀中并将其吹打成单细胞悬液,加入5 μL膜联蛋白V-异硫氰酸荧光素和碘化丙啶试剂,轻柔摇晃使其混匀后在阴凉无光的条件下放置20 min后将其放入流式细胞仪检测。
1.7 试剂盒检测各组心肌细胞的SOD、LDH、MDA和GSH的表达水平
各个指标检测按照试剂盒说明书进行操作。
1.8 Western blot法检测核因子相关因子2和血红素氧合酶-1蛋白表达
将裂解液加入6组细胞中并进行蛋白提纯,后进行蛋白定量、电泳、转膜,加5%脱脂牛奶在室温条件下封闭1 h,然后用兔抗鼠核因子相关因子2(Nrf2)(稀释度1∶500)以及兔抗鼠血红素氧合酶1(HO-1)(稀释度1∶1 000)抗体4 ℃孵育过夜。次日用辣根过氧化物酶标记的羊抗兔二抗(稀释度1∶10 000)室温孵育1 h,化学发光法显影。采用凝胶成像系统进行分析,以目的蛋白条带灰度值与β-actin条带灰度值的比值反映Nrf2和HO-1的表达水平。
1.9 统计学分析
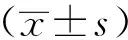
2 结果
2.1 H2O2对H9c2心肌细胞活性的影响
结果显示,随着H2O2浓度的增加,对H9c2心肌细胞的损害越大,H9c2心肌细胞活性越低,细胞凋亡越多。结果如图1所示。
注:与0 μmol/L H2O2比较,a:P<0.05,b:P<0.01。图1 H2O2对H9c2心肌细胞活性的影响
采用0、100、200、400、600和800 μmol/L H2O2分别处理H9c2心肌细胞2 h,结果显示,随着H2O2浓度的增加,H9c2心肌细胞活性下降,差异有显著性(P<0.01)。当H2O2的浓度为400 μmol/L时,细胞活性为64%,既能显著抑制H9c2细胞活力,又不会使大量细胞凋亡,因此采用400 μmol/L的H2O2制作H9c2心肌细胞凋亡模型。
2.2 转染后各组细胞内miR-19b的表达水平
与L1组(1.00±0.15)比较,L2组(0.16±0.04)和L3组(0.22±0.05)细胞中miR-19b表达量显著降低,差异有统计学意义(P<0.01);与L2组及L3组比较,L4组(1.59±0.25)细胞中miR-19b表达量显著升高,L5组(0.08±0.02)细胞中miR-19b表达量降低,差异均有统计学意义(P<0.01),L6组(0.19±0.05)细胞中miR-19b表达量未见统计学差异(P>0.05)。可说明miR-19b转染成功,见图2。
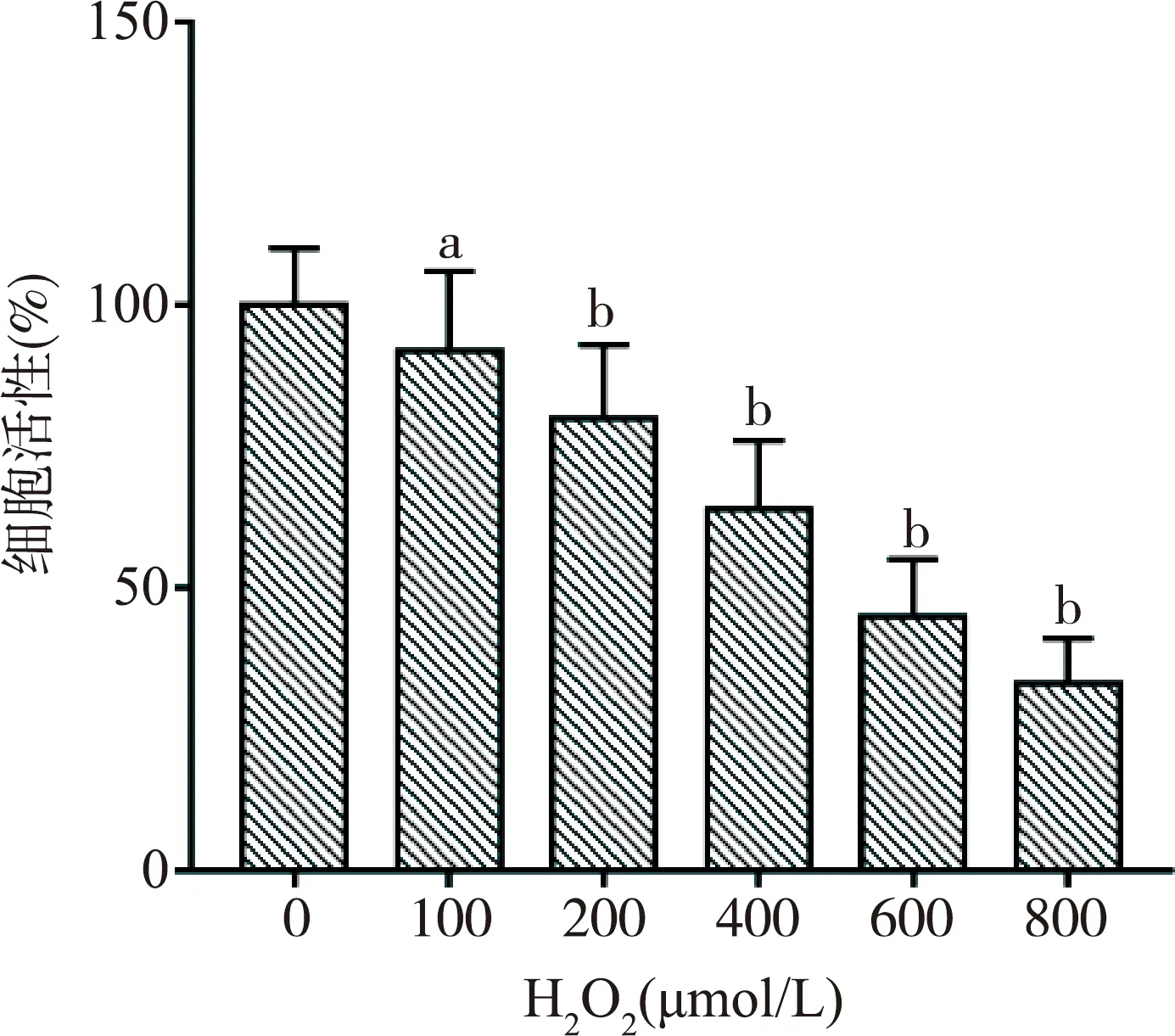
2.3 miR-19b对H2O2诱导的H9c2细胞活性的影响
与L1组(100%±10%)比较,L2组(61%±30%)和L3组(58%±21%)中细胞活性显著降低,差异具有统计学意义(P<0.01);与L2组及L3组比较,L4组(83%±29%)中细胞活性显著升高,L5组(31%±17%)中细胞活性显著降低,差异均有统计学意义(P<0.01),L6组(55%±26%)中细胞活性未见统计学差异(P>0.05)。可说明miR-19b可提高由H2O2诱导的H9c2心肌细胞活性,见图3。
注:a:与L1组相比,P<0.01;b:与L2组相比,P<0.01;c:与L3组相比,P<0.01。图3 miR-19b对H2O2诱导的H9c2细胞活性的影响
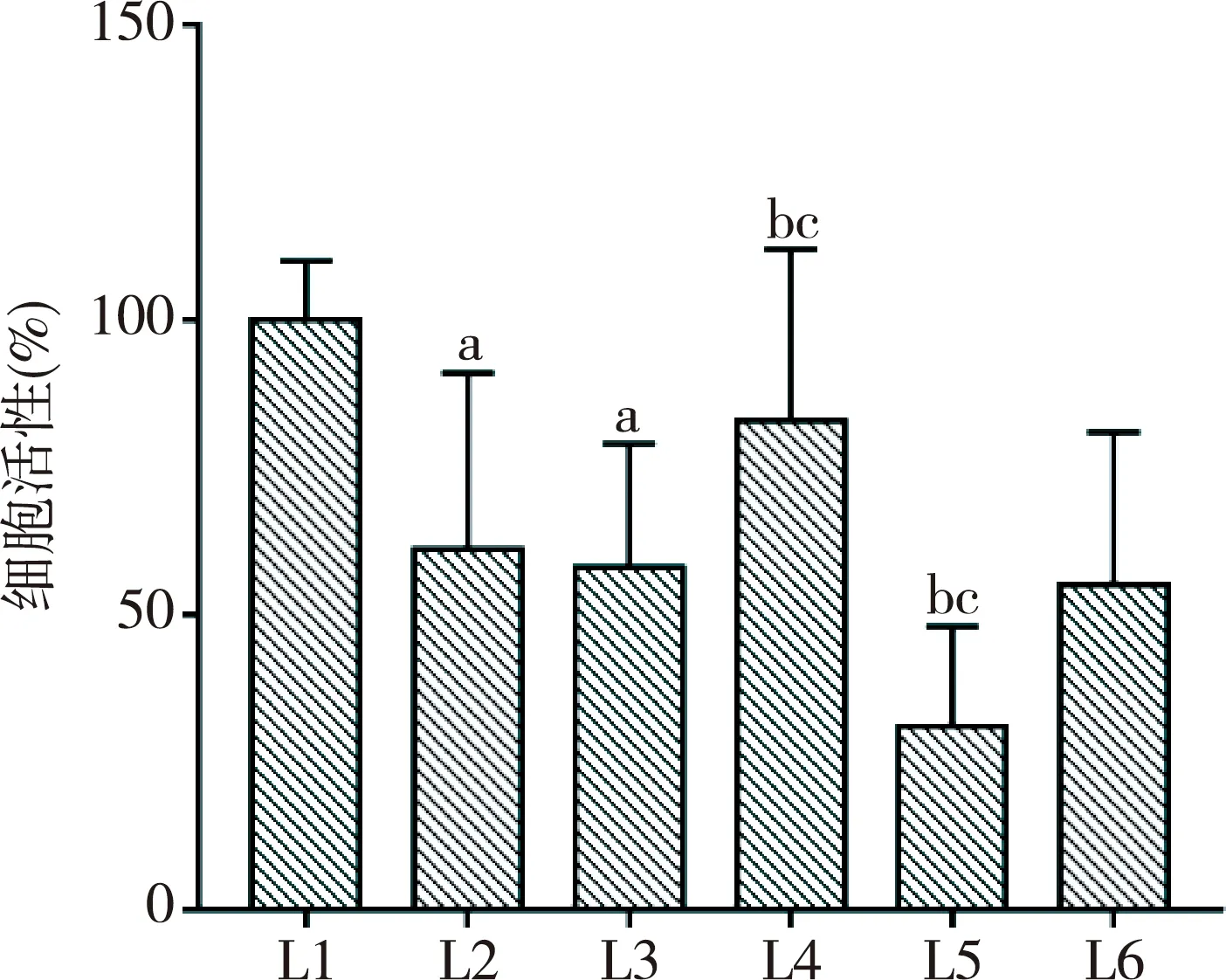
2.4 miR-19b对H2O2诱导的H9c2细胞凋亡的影响
与L1组(5.45%±0.40%)比较,L2组(35.50%±2.50%)和L3组(33.30%±2.15%)中细胞凋亡率显著提高,差异具有统计学意义(P<0.01);与L2组及L3组比较,L4组(7.57%±0.68%)中细胞凋亡率显著降低,L5组(50.15%±5.10%)中细胞凋亡率提高,差异均有统计学意义(P<0.01),L6组中细胞凋亡率(40.13%±3.10%)未见统计学差异(P>0.05)。可说明miR-19b降低由H2O2诱导的H9c2细胞凋亡率,见图4。
2.5 miR-19b对H2O2诱导的H9c2细胞中SOD、LDH、MDA和GSH水平的影响
与L1组相比,L2组和L3组中细胞内SOD活力和GSH含量显著降低,LDH活力和MDA含量显著升高,差异具有统计学意义(P<0.01);与L2组及L3组相比,L4组中细胞内SOD活力和GSH含量显著升高,LDH活力和MDA含量显著降低,L5组中细胞内SOD活力和GSH含量显著降低,LDH活力和MDA含量显著升高,差异均有统计学意义(P<0.01),L6组中细胞内SOD、LDH活力和MDA、GSH含量未见统计学差异(P>0.05)。说明miR-19b可升高细胞内SOD、GSH的表达量,降低LDH、MDA的表达量,见表1。
注:PI:碘化丙啶;FITC:异硫氧酸荧光素。图4 miR-19b对H2O2诱导的H9c2细胞凋亡的影响
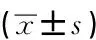
表1 各组H9c2细胞中检测指标结果比较
2.6 miR-19b对H2O2诱导的H9c2细胞中Nrf2和HO-1表达水平的影响
与L1组相比,L2组和L3组中Nrf2和HO-1表达水平显著升高,差异具有统计学意义(P<0.01);与L2组及L3组相比,L4组Nrf2和HO-1表达水平显著升高,L5组中Nrf2和HO-1表达水平显著降低,差异均有统计学意义(P<0.01)。说明miR-19b可增强H2O2诱导的H9c2细胞中Nrf2和HO-1表达水平,见图5。
3 讨论
miRNA是一种微小的非编码RNA分子,主要在转录后调节基因表达,参与细胞间的通讯[6,10],并且在细胞增殖、分化、凋亡,甚至肿瘤发生等多种生物学过程中起到重要作用[11-12],已逐渐成为生命科学领域的研究热点。近年来,研究发现miRNA与心肌梗死、心律失常和心力衰竭等多种心血管疾病的发生和发展密切相关[13-15]。目前认为氧化应激是心血管疾病发生的重要因素[16],进一步的研究也发现某些miRNA可通过调节氧化应激损伤水平来减缓甚至抑制心肌细胞凋亡的发生,如符丽珍等[17]研究发现下调miR-221表达来激活PTEN/Akt信号通路,进而抑制H2O2诱导的H9c2细胞凋亡。郑君毅等[18]研究显示通过降低miR-1表达水平可减少H2O2诱导氧化应激引起的细胞凋亡。miR-19b是miR-17-92簇的主要成员之一,曾被认为与心脏的病理生理变化有关[19]。既往研究[20]也发现miR-19b可有效减缓糖尿病肾病、糖尿病视网膜病变等一系列并发症的发生,而这一作用也可能是通过提高机体的抗氧化能力实现的。因此,本研究进一步地探讨miR-19在氧化应激相关的心肌细胞凋亡中的保护作用及其机制。
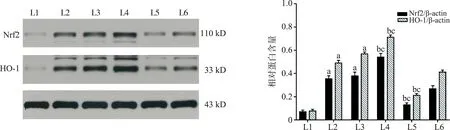
注:a:与L1组相比,P<0.01;b:与L2组相比,P<0.01;c:与L3组相比,P<0.01。图5 miR-19b对H2O2诱导的H9c2细胞中Nrf2和HO-1表达水平的影响
在体内几乎所有细胞在代谢过程中都会产生H2O2,且H2O2在体外性质相对稳定,较易获得,故本实验采用H2O2为工具建立氧化应激损伤模型来模拟体内氧化损伤的病理过程,但较高浓度的H2O2可直接导致细胞膜破裂,所以通过采用不同浓度的H2O2来诱导大鼠H9c2心肌细胞,结果发现伴随着H2O2浓度的升高,大鼠H9c2心肌细胞活性呈现出逐渐降低的趋势,故最终选择400 μmol/L H2O2处理2 h建立体外心肌氧化应激损伤模型,并将其作为后续实验诱导剂量。接着利用RT-PCR法检测H2O2诱导的H9c2细胞中miR-19b的表达量,结果表明H2O2组中miR-19b表达量上升,与Xu等[21]研究结果一致,RT-PCR结果进一步表明miR-19b转染的成功。研究接着利用流式细胞术及相关试剂盒检测miR-19b对H2O2诱导的H9c2细胞活力及凋亡和相关氧化还原酶系的影响。本研究结果表明,与L1组比较,L2组、L3组以及L5组中H9c2细胞活性显著降低,细胞凋亡率显著增加,而L4组中H9c2心肌细胞活性增加,细胞凋亡率显著降低,这提示miR-19b对H2O2诱导的H9c2细胞凋亡具有保护作用。与此同时,还发现在miR-19b保护心肌细胞抗氧化损伤的同时伴随着细胞内LDH、MDA含量减少以及SOD、GSH水平的增加,这提示miR-19b可能通过调控与干预细胞内的氧化还原系统来减少H2O2引起的细胞内有害物质的过量堆积,同时增加SOD、GSH等抗氧化物质的含量,进而发挥保护心肌细胞的作用。
细胞凋亡是生命活动的基本现象,整个过程通常会涉及一系列基因的激活、表达以及调控等的作用。既往研究[22]发现,Nrf2是机体抗氧化应激的重要核转录因子,属于Cap-n-collar(CNC)转录因子家族成员,其激活后可启动下游HO-1等多种抗氧化蛋白类基因的表达,从而调控迁徙、细胞生长、细胞凋亡以及转录等多种生理病理活动。当组织细胞处于缺血等多种应激状态时,HO-1可通过Nrf2调控进行应答,其表达量迅速上升,从而表现出明显的抗氧化、抗炎及抗凋亡作用[23]。因此,近年来Nrf2/HO-1信号通路途径在细胞凋亡与调控和减低心肌细胞凋亡中发挥的重要作用正备受关注[24]。最新研究[25]表明,Nrf2/HO-1信号通路在高糖诱导的心肌细胞氧化应激损伤中发挥着重要的保护作用。同时,还发现Nrf2/HO-1途径主要是通过调控抗氧化酶系的表达等机制保护组织器官[26]。故本研究探讨miR-19b是否会对H2O2诱导的H9c2细胞中Nrf2/HO-1信号通路产生影响,研究结果表明miR-19b能显著上调H2O2诱导的H9c2细胞中Nrf2表达,上调HO-1表达水平,从而说明上调miR-19b表达可能通过激活Nrf2/HO-1信号通路,并调控下游蛋白表达,从而抑制H2O2诱导的H9c2细胞凋亡。
综上所述,miR-19b对H2O2诱导的心肌细胞的氧化应激损伤可发挥较好的保护作用,可能是通过激活Nrf2/HO-1信号通路以及调控细胞氧化还原系统来有效减少心肌细胞凋亡,并且本研究结果或对miR-19b治疗心血管疾病及其他氧化应激损伤所致的疾病具有一定指导意义。
