白子菜鲜、干品寒凉药性差异的动物实验研究
2021-03-10韦乃球韦美梦覃洪乾柳俊辉薛中峰
韦乃球,韦美梦,覃洪乾,柳俊辉,李 琦,薛中峰,李 莉
(1.广西中医药大学 药学院,广西 南宁 530200;2.广西壮族自治区兽药监察所,广西 南宁 530001 )
鲜药是相对于干药而言的,即新鲜采集的中药,是中药的一种原始状态,主要以新鲜的植物药为主。换而言之,鲜药一般是在采收其药用部位后,经净制即行使用的中药,药材成分未发生明显改变,是我国传统用药特色之一。
药性理论是中药理论的核心,是中医辨证论治、处方遣药的重要依据,主要包括四气、五味、归经、升降浮沉、毒性等内容,而四气药性是中药的首要药性,正如陶弘景所言“药物甘苦之味可略,唯冷热须明”。四气,即寒、热、温、凉四种药性,其中温和热、寒和凉并没有本质差异,只是程度上有所不同,即温次于热、凉次于寒。中药寒、热、温、凉药性主要是指从药物作用于人体获得不同疗效所总结出来的理论,但是传统中药寒、热、温、凉药性理论在其形成、发展和应用的过程中,由于受当时的认识水平所限,其认知和表述存在模糊性和主观性。因此,中药在临床应用中往往缺少可供参考的客观化、定量化的指标,影响中药的安全性和有效性。如何揭示中药寒、热、温、凉药性的科学内涵,实现中药寒、热、温、凉药性的相对客观化和定量化,成为中药现代研究亟待解决的问题。
白子菜Gynura divaricata (L.)DC.为菊科多年生草本植物, 又名白背三七、白仔菜、神仙草等[1]。《中药大词典》认为白子菜根味甘、性凉,有清热凉血、散瘀消肿之功效[2];而茎叶味咸、性凉,有清热、舒筋、接骨、止血、祛痰的作用[3]。但是,《中华本草》认为白子菜味甘、淡,性寒,具有清热凉血、解毒消肿、活血散瘀、止痛的功效[3]。由此可见,白子菜在不同文献中标定的寒凉药性有程度差异。
因此,本课题基于动物宏观行为、能量代谢等指标的观察和测定,考察白子菜鲜、干品对机体的作用,并对相关指标的变化进行共性分析,初步探讨白子菜鲜、干品的寒凉药性差异,为白子菜鲜、干品的区别应用提供依据。
1 实验材料
1.1 仪器
756MC 型紫外可见分光光度计(上海精密科学仪器有限公司);MDF-U7386S 型超低温保存箱(日本SANYO);ELX800 型酶标仪(美国BIOTEK);ST16R 型台式高速冷冻离心(德国 Thermo Fisher 公司);UPT 型优普特实验室超纯水器(法国 MilliPORE);K30 型干式恒温器(杭州爽盛仪器)。
1.2 试剂
琥 珀 酸 脱 氢 酶(SDH) 测 试 盒( 批 号:20171201);钠/ 钾-ATP 酶(Na+/K+-ATPase) ( 批号:20171201) ,南京建成生物工程研究所;蛋白质 Marker (批号:26634) ,Thermo;聚偏二氟乙烯膜(PVDF) (批号:IPVH00010)、化学发光试剂(批号:WBKLS0010) ,Millipore; RIPA(强)组织细胞快速裂解液(批号:PAB180006)、BCA 蛋白浓度测定试剂盒(增强型)(批号:PAB180007)、PBS 磷酸盐缓冲液(批号:PAB180003)、GoatAnti-Rabbit IgG (批号:PAB160011),bioswamp;瞬时受体电位通道家族M8 型受体(TRPM8)(批号:ab3243)、瞬时受体电位香草酸受体1(TRPV1)(批号:ab6166),abcam;甘油醛-3-磷酸脱氢酶(GAPDH)(批号:2118),CST。其它常用生化试剂均为国产分析纯。
1.3 药材
实验药材采集于广西贵港,经广西中医药大学药学院药用植物教研室郭敏副教授鉴定为菊科植物白子菜Gynura divaricata(L.)DC.的全草。分别取白子菜鲜8 kg、干品1kg(因为8 kg 鲜品经晒干可得干品1 kg),加10 倍量的水,浸泡1 h 后回流提取1.5 h,趁热过滤,药渣加8 倍量水回流提取1.0 h,趁热过滤,将两次滤液混合并摇匀,浓缩药液,分别制成相当于生药16 g/mL 、2 g/mL 的浸膏,置4 ℃冰箱备用。
1.4 动物
KM 小鼠,雄性,体质量为(20±2) g,SPF 级,由广西医科大学动物中心提供,许可证号:SCXK(桂)2014-0002。
2 实验方法
2.1 模型复制
2.1.1 体盛组模型 每日正常饮水,同时饲喂足量高蛋白饲料至毛色光亮,日饮水量明显增多,喜动,食欲大增,体质量、肛温明显升高,出现典型的“热盛证”特点,即为体盛组造模成功。
2.1.2 体虚组模型 每日正常饮水 ,同时控制饲喂普通饲料( 0.1 g /1 g),每日测试前 1 h 于水深 20 cm、水温 ( 20 ±5) ℃中进行游泳训练,至自然沉降,毛易脱落,日饮水量明显减少,并且出现精神萎靡、食欲不振、体质量明显降低,游泳时间缩短,尾巴和四肢冰冷,出现典型的“虚寒证”特点,即为体虚组造模成功。
2.2 分组与给药
将小鼠随机分为空白组、体盛组、体虚组、体盛+白子菜鲜品组、体盛+白子菜干品组、体虚+白子菜鲜品组、体虚+白子菜干品组,每组10 只,连续灌胃给药15 d。
2.3 检测指标
2.3.1 一般指标 分别于给药第0、7、14 天早7时测量小鼠体质量,并记录小鼠饮水量、饮食量。
2.3.2 小鼠肛温测定 分别于给药第0、7、14 天测量小鼠肛温,各组动物平行交替进行测试。
2.3.3 小鼠温度趋向性测定 每次给药 1 h 后,将小鼠依次放入自动温控系统(低温板 25 ℃,高温板 45℃)的冷热板各通道内,并对活动轨迹进行30 min 全程监测并计数。
2.3.4 小鼠肝组织SDH、Na+/K+-ATPase 活性测定 分离肝脏,用生理盐水清洗血污,铝箔纸包好,-80 ℃保存待测。按照试剂盒说明书进行操作,采用化学比色分光光度法测定肝组织SDH、Na+/ K+-ATPase 活性。
2.3.5 Western blot 检测小鼠下丘脑TRPV1 和 TRPM8 的蛋白水平 从下丘脑组织中提取蛋白,用Bradford 蛋白质定量方法,进行蛋白定量。采用质量分数为12%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测,湿法转移至 PVDF 膜,脱脂奶粉室温封闭2 h,分别加入一抗( 兔抗 TRPV1 或兔抗 TRPM8,1 ∶100) ,在 4℃下孵育过夜。洗涤缓冲液洗膜后加入二抗( HRP 标记山羊抗兔二抗,1 ∶3 000),室温孵育2 h。使用兔抗 GAPDH 特异性抗体作为内参对照检测。将膜放置在暗室中,根据用量取 ECL 发光液 A 和 B 等量混匀,加在膜的正面与之充分接触。然后将膜置于全自动化学发光分析仪中检测,通过上海天能Tanon 2 500/R 凝胶图像处理系统软件读取相关条带灰度值。
2.4 统计学方法
采用SPSS22.0 软件对实验所得数据进行统计学分析。计量资料以均数±标准差(±s)表示。两组间比较采用t 检验,多组间比较采用方差分析。以P <0.05 为差异具有统计学意义。
3 实验结果
3.1 小鼠体质量的变化
与空白组比较,体盛组小鼠体质量显著升高,体虚组小鼠体质量显著或极显著降低;给药14 d 后,与体盛组比较,体盛+白子菜鲜、干品组小鼠体质量极显著降低;与体虚组比较,体虚+白子菜鲜、干品组小鼠体质量略降低,但无显著性差异;同时,体盛/体虚 +白子菜干品组小鼠体质量变化趋势较体盛/体虚+白子菜鲜品组小鼠明显,结果见表1。
表1 小鼠体质量的变化(±s,n = 10)Tab. 1 Changes of body weight in mice(±s,n = 10)
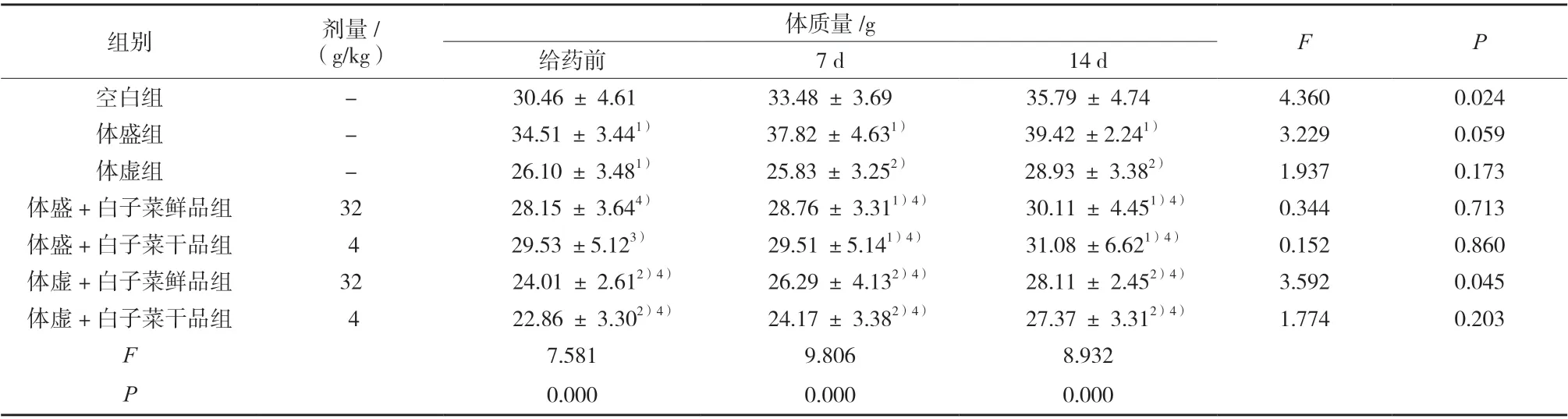
表1 小鼠体质量的变化(±s,n = 10)Tab. 1 Changes of body weight in mice(±s,n = 10)
注:与空白对照组比较,1)P <0.05,2)P <0.01;与体盛组比较,3)P <0.05,4)P <0.01;与体虚组比较,5)P >0.05,6)P <0.01(表2-7 同)。
组别 剂量/(g/kg)体质量/g F P给药前 7 d 14 d空白组 - 30.46 ± 4.61 33.48 ± 3.69 35.79 ± 4.74 4.360 0.024体盛组 - 34.51 ± 3.441) 37.82 ± 4.631) 39.42 ±2.241) 3.229 0.059体虚组 - 26.10 ± 3.481) 25.83 ± 3.252) 28.93 ± 3.382) 1.937 0.173体盛+白子菜鲜品组 32 28.15 ± 3.644) 28.76 ± 3.311)4) 30.11 ± 4.451)4) 0.344 0.713体盛+白子菜干品组 4 29.53 ±5.123) 29.51 ±5.141)4) 31.08 ±6.621)4) 0.152 0.860体虚+白子菜鲜品组 32 24.01 ± 2.612)4) 26.29 ± 4.132)4) 28.11 ± 2.452)4) 3.592 0.045体虚+白子菜干品组 4 22.86 ± 3.302)4) 24.17 ± 3.382)4) 27.37 ± 3.312)4) 1.774 0.203 F 7.581 9.806 8.932 P 0.000 0.000 0.000
3.2 小鼠饮水量的变化
与空白组比较,体盛组小鼠饮水量极显著升高,体虚组小鼠饮水量显著或极显著降低;给药14 d 后,与体盛组比较,体盛+白子菜鲜、干品组小鼠饮水量略降低,但无显著性差异;与体虚组比较,体虚+白子菜鲜、干品组小鼠饮水量略降低,但无显著性差异;体盛/体虚 +白子菜干品组小鼠饮水量变化趋势较体盛/体虚+白子菜鲜品组小鼠明显,结果见表2。
3.3 小鼠饮食量的变化
与空白组比较,体盛组小鼠饮食量略增加或显著增加,体虚组小鼠饮食量显著降低;给药14 d 后,与体盛组比较,体盛+白子菜鲜、干品组小鼠饮食量显著或极显著降低;与体虚组比较,体虚+白子菜鲜、干品组小鼠饮食量变化无显著性差异;体盛/体虚 +白子菜干品组小鼠饮食量变化趋势较体盛/体虚+白子菜鲜品组小鼠明显,结果见表3。
3.4 小鼠肛温的变化
与空白组比较,体盛组小鼠肛温显著升高,体虚组小鼠肛温略降低或显著降低;给药14 d 后,与体盛组比较,体盛+白子菜鲜、品组小鼠肛温显著或极显著降低;与体虚组比较,体虚+白子菜鲜、干品组小鼠肛温略降低,但无显著性差异;体盛/体虚 +白子菜干品组小鼠肛温变化趋势较体盛/体虚+ 白子菜鲜品组小鼠明显,结果见表4。
表2 小鼠饮水量的变化(±s,n = 10)Tab. 2 Changes of water consumption in mice(±s,n = 10)
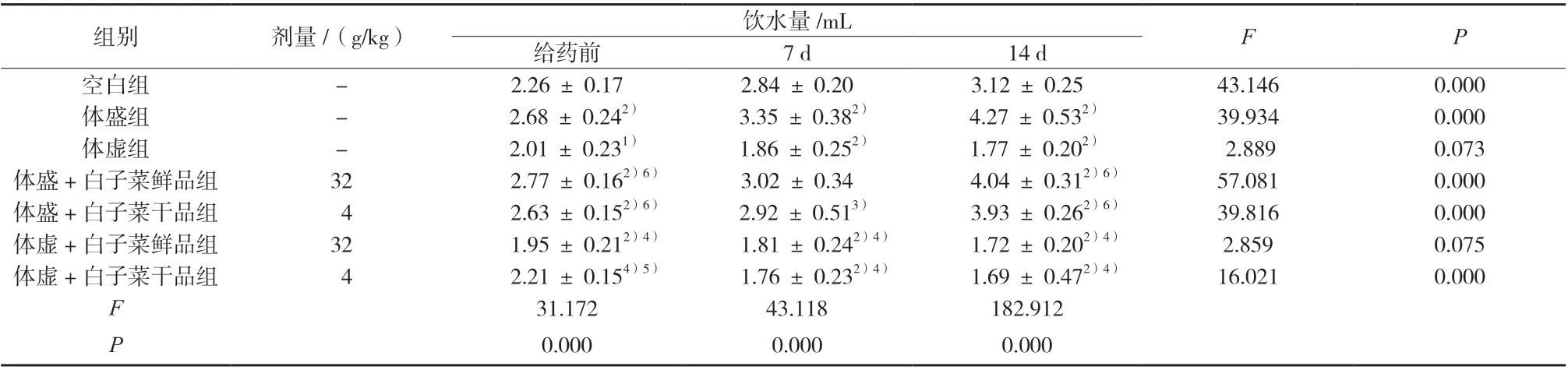
表2 小鼠饮水量的变化(±s,n = 10)Tab. 2 Changes of water consumption in mice(±s,n = 10)
组别 剂量/(g/kg) 饮水量/mL F P给药前 7 d 14 d空白组 - 2.26 ± 0.17 2.84 ± 0.20 3.12 ± 0.25 43.146 0.000体盛组 - 2.68 ± 0.242) 3.35 ± 0.382) 4.27 ± 0.532) 39.934 0.000体虚组 - 2.01 ± 0.231) 1.86 ± 0.252) 1.77 ± 0.202) 2.889 0.073体盛+白子菜鲜品组 32 2.77 ± 0.162)6) 3.02 ± 0.34 4.04 ± 0.312)6) 57.081 0.000体盛+白子菜干品组 4 2.63 ± 0.152)6) 2.92 ± 0.513) 3.93 ± 0.262)6) 39.816 0.000体虚+白子菜鲜品组 32 1.95 ± 0.212)4) 1.81 ± 0.242)4) 1.72 ± 0.202)4) 2.859 0.075体虚+白子菜干品组 4 2.21 ± 0.154)5) 1.76 ± 0.232)4) 1.69 ± 0.472)4) 16.021 0.000 F 31.172 43.118 182.912 P 0.000 0.000 0.000
表3 小鼠饮食量的变化(±s,n = 10)Tab. 3 Changes of diet in mice(±s,n = 10)
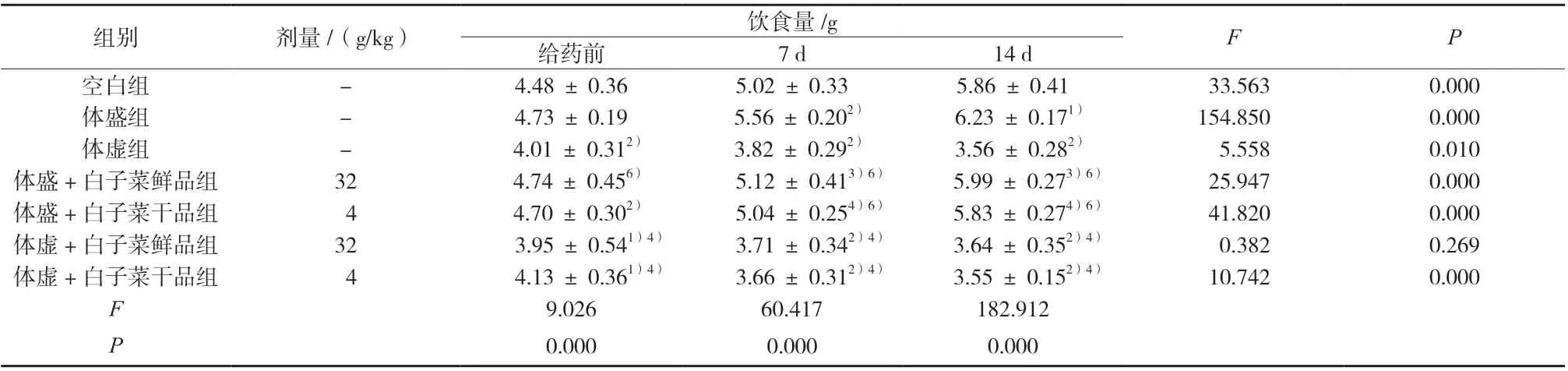
表3 小鼠饮食量的变化(±s,n = 10)Tab. 3 Changes of diet in mice(±s,n = 10)
组别 剂量/(g/kg) 饮食量/g F P给药前 7 d 14 d空白组 - 4.48 ± 0.36 5.02 ± 0.33 5.86 ± 0.41 33.563 0.000体盛组 - 4.73 ± 0.19 5.56 ± 0.202) 6.23 ± 0.171) 154.850 0.000体虚组 - 4.01 ± 0.312) 3.82 ± 0.292) 3.56 ± 0.282) 5.558 0.010体盛+白子菜鲜品组 32 4.74 ± 0.456) 5.12 ± 0.413)6) 5.99 ± 0.273)6) 25.947 0.000体盛+白子菜干品组 4 4.70 ± 0.302) 5.04 ± 0.254)6) 5.83 ± 0.274)6) 41.820 0.000体虚+白子菜鲜品组 32 3.95 ± 0.541)4) 3.71 ± 0.342)4) 3.64 ± 0.352)4) 0.382 0.269体虚+白子菜干品组 4 4.13 ± 0.361)4) 3.66 ± 0.312)4) 3.55 ± 0.152)4) 10.742 0.000 F 9.026 60.417 182.912 P 0.000 0.000 0.000
表4 小鼠肛温的变化(±s,n = 10)Tab. 4 Changes of anal temperature in mice(±s,n = 10)
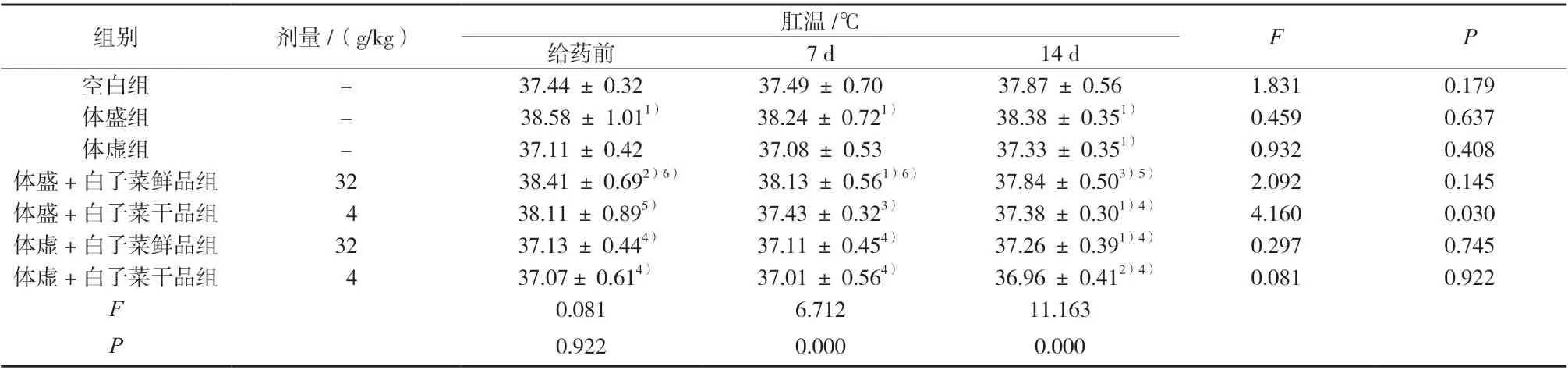
表4 小鼠肛温的变化(±s,n = 10)Tab. 4 Changes of anal temperature in mice(±s,n = 10)
组别 剂量/(g/kg) 肛温/℃ F P给药前 7 d 14 d空白组 - 37.44 ± 0.32 37.49 ± 0.70 37.87 ± 0.56 1.831 0.179体盛组 - 38.58 ± 1.011) 38.24 ± 0.721) 38.38 ± 0.351) 0.459 0.637体虚组 - 37.11 ± 0.42 37.08 ± 0.53 37.33 ± 0.351) 0.932 0.408体盛+白子菜鲜品组 32 38.41 ± 0.692)6) 38.13 ± 0.561)6) 37.84 ± 0.503)5) 2.092 0.145体盛+白子菜干品组 4 38.11 ± 0.895) 37.43 ± 0.323) 37.38 ± 0.301)4) 4.160 0.030体虚+白子菜鲜品组 32 37.13 ± 0.444) 37.11 ± 0.454) 37.26 ± 0.391)4) 0.297 0.745体虚+白子菜干品组 4 37.07± 0.614) 37.01 ± 0.564) 36.96 ± 0.412)4) 0.081 0.922 F 0.081 6.712 11.163 P 0.922 0.000 0.000
3.5 小鼠温度趋向性行为的比较
与空白组比较,体盛组在高温区的停留比例显著减少,体虚组小鼠在高温区的停留比例显著增加;给药14 d 后,与体盛组比较,体盛+白子菜干品组小鼠在高温区的停留比例显著减少,体盛+白子菜鲜品组小鼠在高温区的停留比例无显著变化;与体虚组比较,体虚+白子菜鲜、干品组小鼠在高温区的停留比例略减少,但无显著性差异;体盛/体虚 +白子菜干品组小鼠指标变化趋势较体盛/体虚+白子菜鲜品组小鼠明显,结果见表5。
3.6 小鼠肝组织中的SDH、Na+/K+-ATPase 活性
与空白组比较,体盛组小鼠肝组织中SDH、Na+/K+-ATPase 活性显著升高,体虚组小鼠肝组织中SDH、Na+/K+-ATPase 活性显著或极显著降低;给药14 d 后,与体盛组比较,体盛+白子菜鲜、干品组小鼠肝组织中SDH、Na+/K+-ATPase 活性显著或极显著降低;与体虚组比较,体虚+白子菜鲜、干品组小鼠肝组织中SDH、Na+/K+-ATPase 活性略升高,但无显著性差异;同时,体盛/体虚 +白子菜干品组小鼠指标变化趋势较体盛/体虚+白子菜鲜品组小鼠明显,结果见表6。
表5 小鼠在各温区的总停留时间比例(±s,n = 10)Tab. 5 Proportion of total stay time of mice in each temperature zone(±s,n = 10)
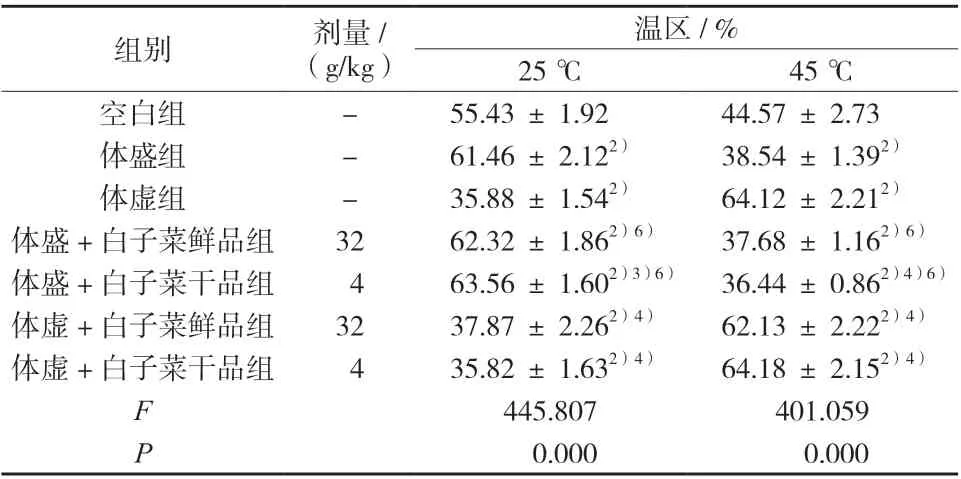
表5 小鼠在各温区的总停留时间比例(±s,n = 10)Tab. 5 Proportion of total stay time of mice in each temperature zone(±s,n = 10)
温区/ %25 ℃ 45 ℃空白组 - 55.43 ± 1.92 44.57 ± 2.73体盛组 - 61.46 ± 2.122) 38.54 ± 1.392)体虚组 - 35.88 ± 1.542) 64.12 ± 2.212)体盛+白子菜鲜品组 32 62.32 ± 1.862)6) 37.68 ± 1.162)6)体盛+白子菜干品组 4 63.56 ± 1.602)3)6) 36.44 ± 0.862)4)6)体虚+白子菜鲜品组 32 37.87 ± 2.262)4) 62.13 ± 2.222)4)体虚+白子菜干品组 4 35.82 ± 1.632)4) 64.18 ± 2.152)4)F 445.807 401.059 P 0.000 0.000组别 剂量/(g/kg)
表6 小鼠肝组织SDH、Na+/K+-ATPase 活性(±s,n = 10)Tab. 6 Activities of SDH and Na+/ K+- ATPase in mice liver(±s,n = 10)
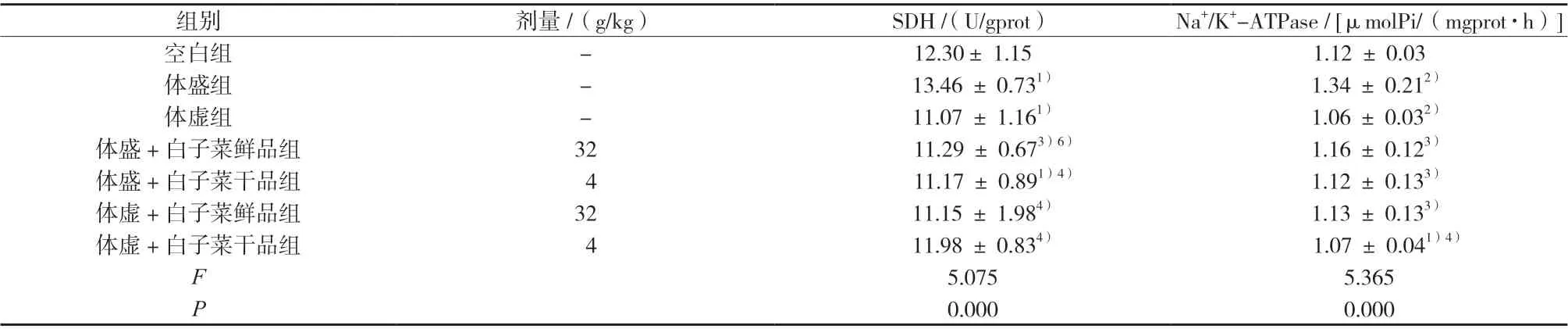
表6 小鼠肝组织SDH、Na+/K+-ATPase 活性(±s,n = 10)Tab. 6 Activities of SDH and Na+/ K+- ATPase in mice liver(±s,n = 10)
组别 剂量/(g/kg) SDH / (U/gprot) Na+/K+-ATPase / [μmolPi/(mgprot·h)]空白组 - 12.30± 1.15 1.12 ± 0.03体盛组 - 13.46 ± 0.731) 1.34 ± 0.212)体虚组 - 11.07 ± 1.161) 1.06 ± 0.032)体盛+白子菜鲜品组 32 11.29 ± 0.673)6) 1.16 ± 0.123)体盛+白子菜干品组 4 11.17 ± 0.891)4) 1.12 ± 0.133)体虚+白子菜鲜品组 32 11.15 ± 1.984) 1.13 ± 0.133)体虚+白子菜干品组 4 11.98 ± 0.834) 1.07 ± 0.041)4)F 5.075 5.365 P 0.000 0.000
3.7 Western blot 检测小鼠TRPV1 和 TRPM8 的蛋白水平
与空白组比较,体盛组小鼠TRPV1 蛋白表达极显著升高及TRPM8 蛋白表达极显著降低,体虚组小鼠TRPV1 蛋白表达极显著降低及TRPM8 蛋白表达极显著升高;给药14 d 后,与体盛组比较,体盛+白子菜鲜、干品组小鼠TRPV1 蛋白表达极显著降低及TRPM8 蛋白表达极显著升高;与体虚组比较,体虚+白子菜鲜、干品组小鼠TRPV1 蛋白表达极显著升高及TRPM8 蛋白表达极显著降低;同时,体盛/体虚 +白子菜干品组小鼠指标变化趋势较体盛/体虚+白子菜鲜品组小鼠明显,结果见表7、图1。
表7 小鼠TRPV1 和 TRPM8 蛋白水平(±s,n = 10)Tab. 7 Protein levels of TRPV1 and TRPM8 in mice(±s,n = 10)

表7 小鼠TRPV1 和 TRPM8 蛋白水平(±s,n = 10)Tab. 7 Protein levels of TRPV1 and TRPM8 in mice(±s,n = 10)
组别 剂量/(g/kg) TRPV1/ GAPDH TRPM8/ GAPDH空白组 - 0.48 ± 0.01 0.52 ± 0.00体盛组 - 0.70 ± 0.012) 0.35 ± 0.002)体虚组 - 0.41 ± 0.002) 0.74 ± 0.012)体盛+白子菜鲜品组 32 0.63 ± 0.012)4)6) 0.42 ± 0.012)4)6)体盛+白子菜干品组 4 0.59 ± 0.012)4)6) 0.44 ± 0.012)4)6)体虚+白子菜鲜品组 32 0.46 ± 0.012)4)6) 0.67 ± 0.012)4)6)体虚+白子菜干品组 4 0.45 ± 0.012)4)6) 0.69 ± 0.002)4)6)F 855.043 3189.488 P 0.000 0.000
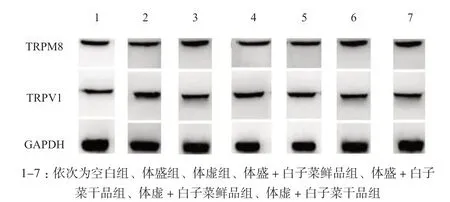
图 1 小鼠TRPV1 和 TRPM8 蛋白水平(±s,n = 10)Fig.1 Protein levels of TRPV1 and TRPM8 in mice(±s,n = 10)
4 讨论
中药寒热药性是中药基础理论的核心内容,也是中药与西药之间最本质的区别。因此,大量开展中药寒热药性研究,可以促进中药药性理论的发展和完善。相关文献表明[4-13],在实验动物给药后,通过观察体质量、饮水饮食量、肛温、毛发颜色等一般情况,以及温度趋向性、能量代谢指标、瞬时感受器电位离子通道蛋白含量变化等,可探究中药鲜、干品的寒热药性差异,为运用现代科学语言阐述中药药性理论固有的科学内涵提供参考。
本研究发现,与空白组比较,体虚组小鼠呈现体质量下降、饮水饮食量减少、肛温降低、对高温趋向性增强等典型“虚寒证”特点;体盛组小鼠呈现体质量升高、饮水饮食量增加、肛温升高、对高温的趋向性减弱等典型“热证”特点。在此模型上,白子菜鲜、干品干预之后,小鼠一般能量代谢指标(体质量、饮水饮食、肛温等)均降低,这与寒凉药性使一般能量代谢降低的理论一致。同时,白子菜鲜、干品对小鼠“趋热性”增强的顺序与上述数据改变规律基本一致,提示通过动物温度趋向性实验可以分辨白子菜鲜、干品药性的细微差别,同时也从实验水平验证了传统药性理论认识的客观存在性。
此外,本实验还考察了白子菜鲜、干品对SDH和ATP 酶活性的影响。结果表明,体虚小鼠的SDH和ATP 酶活性均下降,而经白子菜鲜、干品干预后,SDH 和ATP 酶活性均进一步下降,提示白子菜鲜、干品的“寒性”使小鼠SDH 和ATP 酶活性进一步受到抑制;在体盛小鼠也得到类似结果。本实验也观察到,体盛小鼠给予白子菜鲜、干品干预后,随着肛温下降,小鼠下丘脑 TRPV1 表达明显降低、TRPM8 表达明显升高。根据《素问至真要大论》提出“寒者热之,热者寒之”的重要治则,白子菜鲜、干品可能通过下调下丘脑中 TRPV1 表达水平、上调TRPM8 表达从而起到纠正热证动物模型发热症状的作用。在以上各数值变化中,白子菜鲜品改变的幅度要小于白子菜干品,从而验证了白子菜鲜、干品寒凉药性程度差异的客观存在。
5 结论
中药药性不仅是药物的固有属性,亦受外界因素影响,比如中药进行相应加工炮制后化学成分会有所改变,会使其寒凉之性逐渐减弱,甚者药性由寒转温;或使其温热之性逐渐减弱,甚者药性由温转寒。本实验结果表明,白子菜鲜品经晒干后药性由凉转为寒,显然是受加工炮制后化学成分改变的影响,但具体与哪些化学成分的改变有关,还需进一步研究,以便确切阐释白子菜的药性理论,为其临床合理应用提供理论依据。
