紫花含笑花被呈色过程中色素含量与超微结构的变化特征
2021-03-10余秋岫金晓玲刘彩贤
余秋岫,金晓玲,罗 峰,刘彩贤*
(1 中南林业科技大学 风景园林学院,长沙 410004;2 广州市绿化公司,广州 510000)
花色创新是花卉育种的重要内容,研究色彩形成的原因对于新型观花品种的选育具有重要意义[1]。花色是复杂的表型性状,花瓣色素种类及其含量是影响月季[2]、部分忍冬属[1]植物呈色的主要原因。除受色素类型与比例影响外,还有细胞液pH值、光照、温度等多种因素的影响[3-4],其中花瓣表皮细胞形态是影响花色变化的重要因素之一[5]。Zhang等[6]提出锥形细胞将光线聚焦到内部花色素上,从而增强花瓣颜色的强度[7];不同花色菊花徒手切片结果表明,圆锥形上表皮细胞结构入射光进入细胞比例比扁平形增加[8]。另外,对万寿菊舌状花超微结构观察发现,叶绿体向有色体的结构转变可导致花色呈橘黄色变化[9]。
紫花含笑 (Micheliacrassipes) 是木兰科 (Magnoliaceae) 含笑属 (Michelia) 常绿小乔木或灌木,花色紫红,是含笑属中为数不多紫色系植物,近年来常用作杂交亲本进行木兰科植物花色改良[10-11]。目前,对紫花含笑的研究主要集中在孢粉学[12]、生物学特性[13]、杂交新品种选育[11,14]、无性繁殖方式[15-16]以及花叶提取物开发[17]等方面,据观察其花被在蕾期完成由绿转紫的着色过程,现蕾时为绿色而在花蕾期花冠呈紫色,但紫花含笑花被颜色形成的机理尚不明确,花被的形态结构及其对呈色影响也无报道。本研究采用光镜和电镜方法观察比较不同颜色花被显微及超微结构,结合花色表型分析花被呈色过程中花色素和细胞结构差异,为探讨紫花含笑的花色呈色机制提供依据,也为木兰科植物花色育种及功能利用提供参考。
1 材料和方法
1.1 试验材料
试验材料采自湖南省林业厅木兰科资源圃的健康紫花含笑植株。根据花期发育过程中花被颜色的变化进程,分为绿被期和紫被期2个阶段。分别取绿色和紫色花被片作为石蜡切片、扫描电镜、透射电镜及色素含量分析试验材料(图1)。取样时去除花被基部与顶部位置,取花被2/3的部分。
1.2 观测指标及方法
1.2.1 花色表型测定参照张杨青慧等[3]的方法,用CM-700d型号色差仪(Konica minolta,Japan)对紫花含笑花被上表皮进行测量,获得花色明度(L*值)、色相a*和b*值,彩度C*值和色相角度h根据公式计算[18],5次生物学重复。其中,C*=(a*2+b*2)1/2,h=arctan(b*/a*)
1.2.2 花被色素含量类黄酮含量分析采用Flavonoid Kit比色试剂盒法(南京建成生物工程研究所);花青素含量提取采用1%盐酸溶液水解法[19];叶绿素及类胡萝卜素含量测定参照于娜[20]乙醇浸提法。所有指标含量测定均设3次生物学重复,每个生物学重复均设3次技术重复。
1.2.3 花被表皮色素分布观察参照程怡等[21]方法,尖头镊子撕下花被2/3处上表皮,于EVOS XL Core细胞成像系统40倍镜下拍照观察。
1.2.4 花被石蜡切片样品制备及观测以绿色和紫色花被为试材,取花被2/3处置于FAA固定液中,采用常规石蜡切片法制片[9,22]观测。利用数字切片扫描系统Motic VM1(厦门麦克奥迪实业集团有限公司)观察、拍照,用Digimizer 4.5.1软件测定花被表皮形态,包括上表皮长度、宽度及其长宽比。
1.2.5 花被扫描电镜样品制备及观测参照肖文芳[5]的方法。从紫花含笑植株上采集新鲜花朵,用蒸馏水漂洗干净;截取大小为5 mm×5 mm样品,置于戊二醛固定液中;用磷酸缓冲液对样品进行冲洗,共3次,每次10 min;用30%~100%乙醇梯度脱水处理;用醋酸异戊酯替换掉细胞中的乙醇,2次,每次15 min;使用真空冷却干燥器进行干燥处理; 样品粘附在铝制托盘,用离子溅射镀膜仪(IB-5 型)在样品表面镀1层金属膜;使用JSM-6390 LV 扫描电镜(Hitachi,Japan)对样品进行观察及拍照记录。

图1 紫花含笑花被变色前后上表面Fig.1 The upper surface of different color perianths in Michelia crassipes
1.2.6 花被透射电镜样品制备及观测取花被2/3部分,剪成小细条,迅速放入2%戊二醛固定液中,抽真空防止材料上浮,4 ℃保存;4 ℃,1%四氧化锇(OsO4)固定3 h;30%~100%乙醇梯度脱水处理;环氧树脂812包埋剂包埋样品;超薄切片机切片,分别置于乙酸双氧铀[UO2(CH3COO)2·2H2O]、柠檬酸铅(C6H5O7Pb)中染色;于透射电镜下观察(H-7650,Hitachi,Japan)。
1.3 数据统计与分析
采用Origin 2017绘制图表和SPSS 2.0软件对试验数据进行统计以及逐步回归分析,指标的相关性采用Pearson相关系数评价。
2 结果与分析
2.1 紫花含笑花色变化过程中花被表型参数和色素含量变化特征及其相关性
2.1.1 花色表型参数如图2,A所示,不同颜色花被L*、a*、b*差异明显。其中,随着花被颜色由绿转紫,其明度L*值大幅降低;色相a*值上升表示由绿到红的变化,花被颜色向红色相偏移,色相b*值大幅降低说明颜色由黄转蓝的变化趋势;彩度C*值大幅降低,色相角h则上升。
2.1.2 色素含量图2,B显示,在紫花含笑花被呈色过程中,花被类黄酮、花青素和类胡萝卜素含量呈现上升趋势,叶绿素则呈下降趋势。其中,在花色由绿转紫变化过程中,花被类黄酮含量上升了1.2倍,花青素含量上升了3.25倍,类胡萝卜素含量上升了11.3倍,而叶绿素含量下降了1.05倍;但与其他色素含量相比,花被类胡萝卜素总含量上升幅度最大,含量却最低。同时,比较紫花含笑花被呈色变化过程中花青素与其他各色素含量比值,发现花被花青素/类黄酮略微有所增大,花被花青素/叶绿素明显增大,增加了7.69倍,而花被花青素/类胡萝卜素却显著降低了65.48%;但就比值大小而言,不同颜色花被均以花青素/类胡萝卜素最大,花青素/叶绿素次之,花青素/类黄酮最小(图2,C)。
2.1.3 花色表型与色素含量的关系从简单相关分析结果(表1)可知,花被片明度L*值与a*值呈极显著负相关,同时与花青素、类黄酮、类胡萝卜素及花青素/类黄酮、花青素/叶绿素的比值也呈负相关,而与b*值、叶绿素含量及花青素/类胡萝卜素呈正相关;a*值与b*值、叶绿素含量及花青素/类胡萝卜素呈负相关,与花青素、类黄酮和类胡萝卜素含量及花青素/类黄酮、花青素/叶绿素呈正相关;b*值与叶绿素含量和花青素/类胡萝卜素呈正相关,与花青素、类黄酮、类胡萝卜素含量、花青素/类黄酮和花青素/叶绿素呈负相关。可见,在紫花含笑花被花色由绿转紫的过程中,花被表面明度L*降低,花色紫红变化程度主要与花青素、类黄酮、类胡萝卜素等色素含量以及花青素/类黄酮、花青素/叶绿素呈显著正相关,而与叶绿素含量和花青素/类胡萝卜素呈显著负相关;各色素间相互影响,相互制约,共同影响花被呈色。
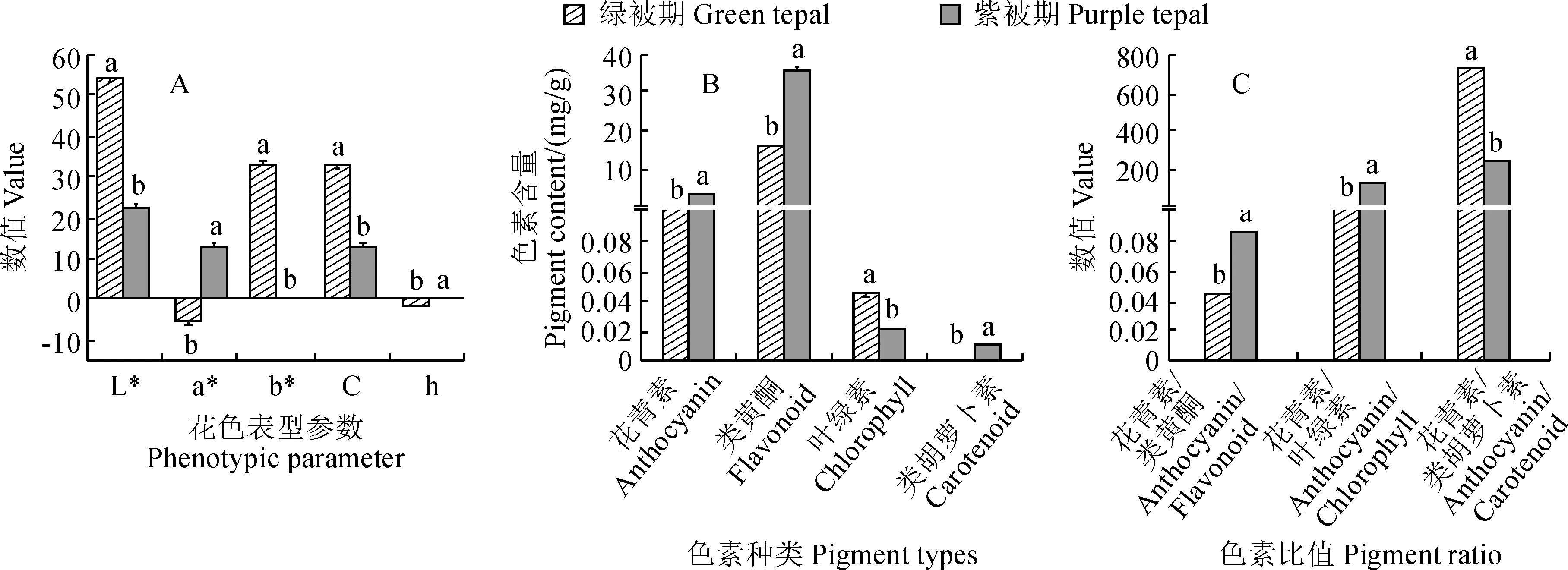
图2 紫花含笑不同颜色时期花被表型参数和色素含量、比值比较Fig.2 Comparison of phenotypic parameters, pigment content and ratio of perianth in different color periods of Michelia crassipes
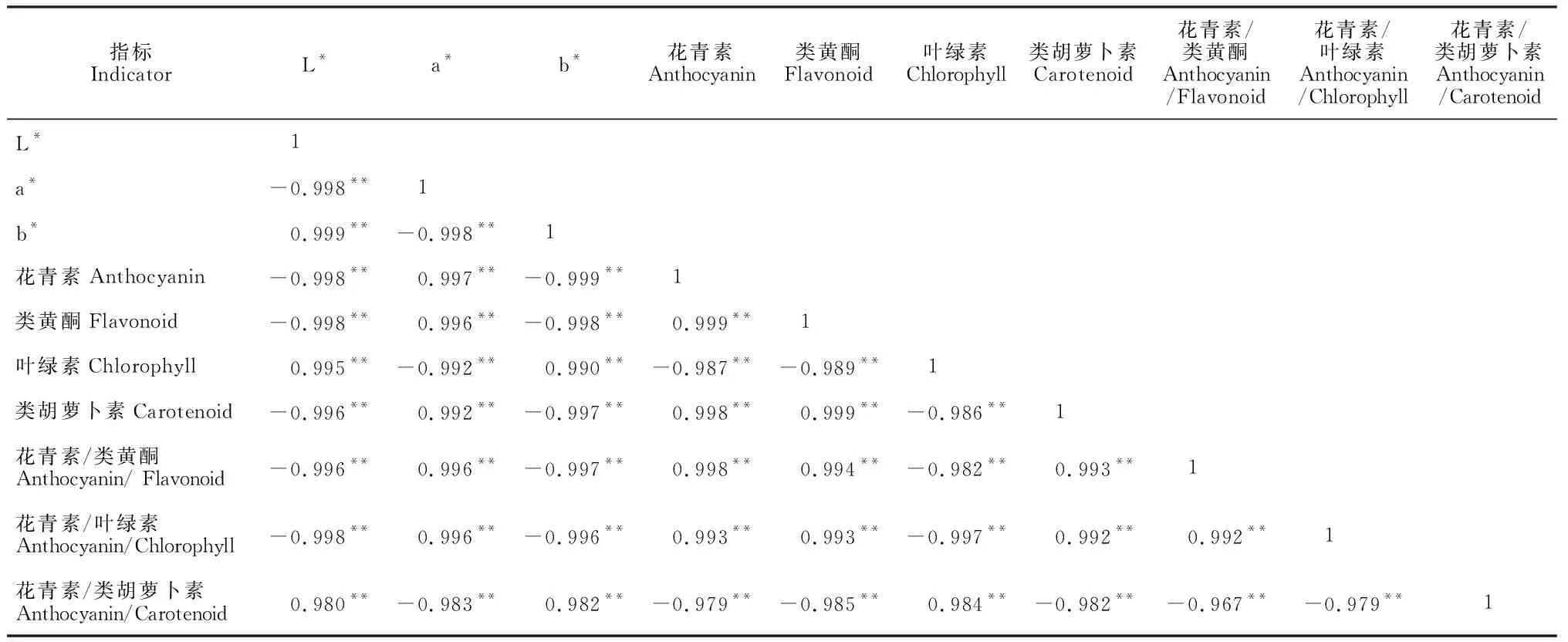
表1 各指标间简单相关性分析
同时,简单相关分析中与花被呈色表现出极显著相关因素较多,进一步对各色素含量变化进行逐步回归分析,拟从不同花色素中找到花色(a*、b*)影响最显著的因子。在5%的显著水平下,逐个淘汰不显著自变量,选出偏回归系数达到显著或极显著水平的因子,进入花色的回归方程(表2)。如表2所示,花被色度a*值的逐步回归方程中,仅保留了花青素1个因子,且二者呈现正相关关系,其余因子全部被剔除;花被色度b*值的逐步回归方程中,也只保留了花青素1个因子,但二者呈负相关关系。这一结果表明,花青素对紫花含笑花冠呈紫色有显著作用。
综合以上分析,花被中各色素组分的相对含量变化共同影响紫花含笑呈色,其中花青素含量上升以及类胡萝卜素、类黄酮等含量增加辅助增色可能是紫花含笑花被显紫色的主要原因,同时还伴随着叶绿素的降解。
2.2 紫花含笑花被上表皮色素分布特征
通过40倍光镜观察紫花含笑花被上表皮徒手切片(图3)发现,绿色花被中主要是叶绿素分布,未观察到花青素的存在(图3,A);而紫色花被中,花青素出现,并大面积分布于上表皮中,叶绿素含量降低(图3,B)。因此,花青素的出现可能是紫花含笑花冠着紫色的主要原因。
2.3 紫花含笑花被表皮细胞形态特点
2.3.1 基本形态特点对不同颜色花被的上表皮细胞长度、宽度及长宽比进行统计分析,发现不同花色花被的细胞形态存在差异。其中,绿色花被上表皮细胞近似为正方形,细胞排列紧密、间隙小,表面平整(图3,C),细胞面积较小,长宽比为1.497(表3);紫色花被上表皮多为椭圆形,单个细胞的裸露面大于细胞间接触面,表面呈弧形,细胞面积较大,长宽比为1.855(图3,D;表3)。
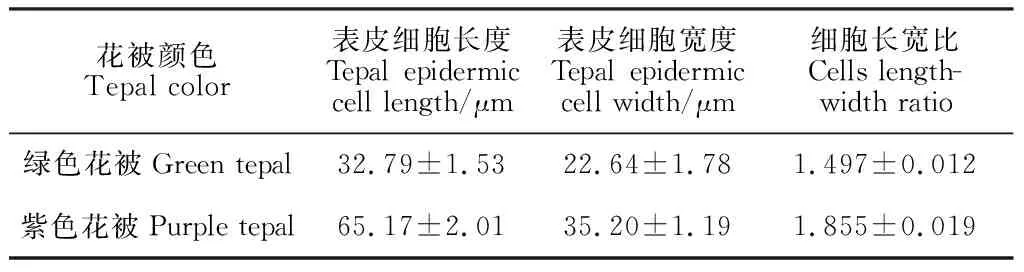
表3 紫花含笑不同颜色花被上表皮细胞解剖形态比较
2.3.2 不同颜色花被片上表皮细胞形态比较肖文芳等[5]将蝴蝶兰花瓣表皮细胞形态分为扁平型、穹顶型、长穹顶型和乳突型。本试验扫描电镜观察发现,紫花含笑绿色花被上表皮细胞形态完整,均为扁平型(图4,A),细胞基本饱满,细胞间隙处有轻微皱缩;细胞排列紧密,基本处于同一个平面,无空隙,具气孔器(图4,B)。紫花含笑紫色花被除气孔器外(图4,C),上表皮细胞垂周壁上覆盖不规则的褶皱条纹,条纹间有空隙;细胞凸起为穹顶型,细胞排列紧凑但不处于同一个平面,单个细胞呈弧形凸起(图4,D)。花被上表皮结构观察结果表明,花被呈紫色过程中,表皮细胞由扁平型向圆锥凸起变化,单个细胞长宽比增大,细胞垂周壁出现褶皱,表皮结构形态上向增加光照吸收面积变化。
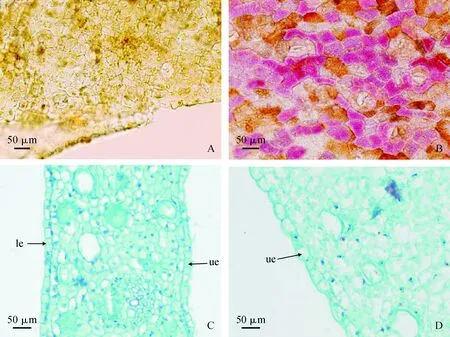
A、C.绿色花被;B,D.紫色花被;ue.上表皮; le.下表皮图3 紫花含笑不同颜色花被上表皮色素分布及细胞形态变化A,C. Green tepal; B,D. Purple tepal; ue. Upper epidermis; le. Lower epidermisFig.3 The pigment distribution and transverse sections of upper epidermal cells in different color perianth of Michelia crassipes
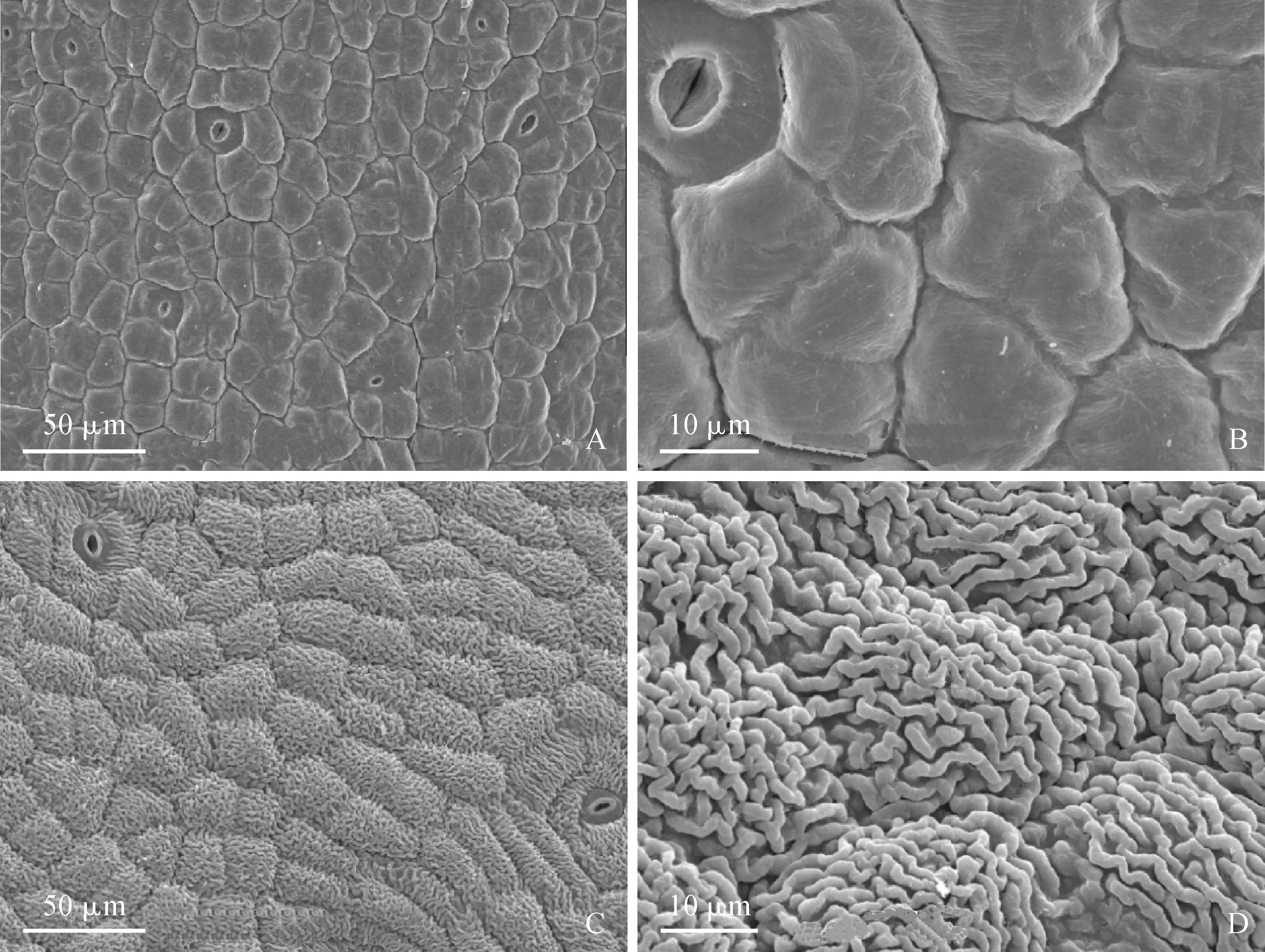
A.绿色花被上表皮;B.绿色花被表皮细节图;C.紫色花被上表皮;D.紫色花被表皮细节图图4 紫花含笑变色前后花被表皮结构变化A. The upper surface of green tepal; B. The details of upper surface of green tepal; C. The upper surface of purple tepal; D. The details of upper surface of purple tepalFig.4 Electron microscopic images of the upper surface of different color perianth in Michelia crassipes
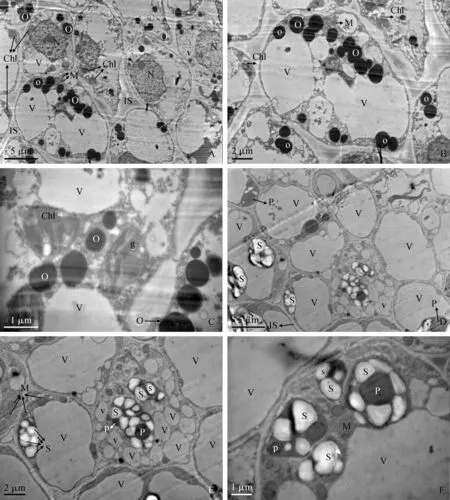
A~C. 绿色花被:A. 花被超显微结构;B. 细胞结构;C.叶绿体结构细节图;D~F. 紫色花被:D. 花被超显微结构;E. 细胞结构图;F.有色体结构细节图;Chl.叶绿体;g.基粒;O.黑色嗜锇滴;V.液泡;M.线粒体;N.细胞核;IS.细胞间隙;P.质体;S.淀粉粒图5 紫花含笑两种颜色花被超显微结构比较A-C. Green tepal: A. Ultrastructure of petals of green tepal; B. Cellular structure diagram; C. The details of chloroplasts; D-F. Purple tepal: D. Ultrastructure of petals of purple tepal; E. Cellular structure diagram; F. The details of chromoplasts; Chl. Chloroplast; G. Granum; O. Osmiophilic droplet; V. Vacuole; M. Mitochondrion; N. Nucleus; IS. Intercellular space; P. Plasmid; S. Starch grainsFig.5 Ultrastructure of perianth with different colors in Michelia crassipes
2.3.3 不同颜色花被细胞超微结构差异从两种颜色花被表皮结构观察可知,不同颜色花被表皮结构有所差异,现进一步对花被细胞进行超显微观察。结果显示:紫花含笑绿色花被细胞有丰富的细胞器,尤以叶绿体和线粒体居多,细胞核结构清晰,细胞质充盈,细胞间隙较宽;液泡体积小而分散,在细胞中与其他细胞器体积约各占1/3~1/2(图5,A、B);叶绿体体积较大,呈长椭圆形,内部基粒片层结构清晰(图5,C);花被细胞中存在大量黑色嗜锇滴,多为圆形且体积较大(图5,A~C)。
紫花含笑紫色花被细胞间隙相比绿色花被窄,细胞间结构相对饱满;出现叶绿体转化为有色体的超显微结构,但有色体结构细胞器数量不多,中央大液泡占据花被细胞体积最大(图5,D),多数细胞中央大液泡体积几乎占据整个细胞,将细胞器挤压向细胞边缘凝聚;偶有细胞淀粉粒及质体球占据细胞中央(图5,E);存在巨大的淀粉粒现象,淀粉粒近似为圆形或多边形,质体球体积较大(图5,F)。该结果表明,随着花被显紫色,液泡体积增大与叶绿体向有色体转化是主要的细胞器变化。
3 讨 论
色素组成及其含量的时空组合是决定花色形成的重要因素[1,4,18],本研究中通过相关分析以及逐步回归方程发现,紫花含笑花被显紫色可能是花青素含量显著上升,伴随着叶绿素的降解,以及类黄酮和类胡萝卜素含量增加起辅助增色作用所致,结果与Liu[23]研究一致。花青素含量变化也是影响蒙农红豆草[24]、丽格海棠[25]等植物花瓣呈色的主要色素。黄酮或黄酮醇等类黄酮物质本无色,有显著的辅助色素效应,即与花青苷结合呈现增色效应及红移[1,26-27],类胡萝卜素与花青素复合也产生不同色调的红色[8]。本研究中紫花含笑花青素、类黄酮和类胡萝卜素含量变化及花青素/叶绿素与红度a*值呈显著正相关,与明度L*值、b*值显著负相关,这与王艺光等[28]发现类胡萝卜素的积累改变桂花花瓣的红度a*值结果一致,也与花青素含量积累降低花瓣明度和黄色程度,有利于睡莲花色红色化原因相似[29]。
花瓣锥形表皮细胞形态能够影响其光捕获能力和光的反射比[30]。菊花[8]和万寿菊[9]细胞表型对花色变化的影响研究表明,圆锥形结构相比扁平状结构入射光进入花瓣表皮细胞的比例增加而花色加深。本研究中,紫花含笑花被呈色前后上表皮细胞结构差异性变化与前人结果一致,即绿色花被表皮细胞扁平规整,而紫色花被上表皮细胞呈椭圆形凸起,表皮细胞长宽比变化与色素含量均呈显著相关;而且细胞垂周壁覆盖褶皱条纹,说明花瓣表皮细胞表面积增大,可能有利于入射光的吸收。
植物花色与花瓣细胞中质体的结构具有密切关系,烟草花蜜腺绿色转橙过程中出现叶绿体向有色体转化,并伴随着一定程度的液泡增大[31];矢车菊盛花期花瓣液泡明显增大并且存在有色质体[32],叶绿体、淀粉体转化为积累类胡萝卜素的有色体细胞器结构,是花、果实颜色黄转橙的主要原因之一[9,33-34]。本研究中,紫花含笑花被超微结构观察发现,细胞液泡体积增大及有色质体的转化是其花被呈紫色的主要细胞结构变化。紫花含笑花冠转紫色过程中液泡体积占比从1/3直达2/3以上,更甚者几乎占据整个细胞,出现了叶绿体结构向淀粉粒以及有色体转化,但数量不多,与紫被期叶绿素降解、类胡萝卜素含量有明显增加但含量较少结果一致。考虑到花青素苷在细胞质中合成,在液泡中积累[26],因此推测紫花含笑由绿转紫过程中,随着花青素的合成和转运,最终积累在液泡中从而导致液泡体积的增大。另外,在绿色花被细胞内存在大量黑色嗜锇滴,即油细胞等脂类物质被锇酸固定为嗜锇滴,许多含锇酸物质的质体是精油的合成场所[35-36],因此推测绿被期是花香物质合成的重要时期。
综上所述,紫花含笑花被呈色过程中,花青素的积累伴随着类胡萝卜素及类黄酮等色素含量增加辅助增色可能是其花被呈紫色的主要原因,细胞结构上表现为液泡体积增大,叶绿体向有色体转化。花被呈色是多因素作用的结果,为更好地诠释其花被呈色的成因,尚需从植物体内色素代谢调控及其转录调控开展深入研究,此结果为今后木兰科花色呈色机制研究提供细胞学依据。
