枣花芽分化过程中营养物质和内源激素含量及抗氧化酶活性变化研究
2021-03-10阿布都卡尤木阿依麦提樊丁宇岳婉婉赵婧彤
阿布都卡尤木·阿依麦提,樊丁宇,岳婉婉,赵婧彤,郝 庆*
(1 新疆农业科学院 园艺作物研究所/农业部新疆地区果树科学观测实验站,乌鲁木齐 830091;2 新疆农业大学 林学与园艺学院,乌鲁木齐 830052)
枣(ZiziphusjujubaMill.)属于鼠李科(Rhamnaceae)枣属(ZiziphusMill.),原产中国,栽培历史悠久[1]。枣花芽分化不同于其他果树,属当年分化、当年开花,分化期短、分化速度快,在整个成花过程中可不断分化、多次分化[2-3]。花芽分化是一个比营养器官分化更为复杂的过程,是果树生长发育过程中一个极为重要的时期,它与生产密切相关,直接影响果实的品质与产量[4]。果树只有形成一定数量的优质花芽才能保证获得理想的产量和克服大小年结果现象,而影响果树花芽分化的因素主要是环境因子以及植物体内的营养和各内源激素相互协调的动态平衡关系,它们共同控制营养转向,从而对花芽分化发育起调控作用,而不同物质的作用效应依物质种类、作用时期和植物种类而不同[5]。因此,明确枣花芽分化时间的碳水化合物、抗氧化保护酶及内源激素的运转规律,对人为调控花芽质量,改善和提高果实品质,并为育种工作的顺利进行提供理论依据。
花芽分化作为植物开花机理研究中的一个重点,它是受多因素调节与控制,各物质通过一系列复杂生理生化反应由量变到质变的过程。花芽分化期植物内部新陈代谢活跃,营养物质是花芽分化的基础[6]。多数报道曾指出,淀粉、可溶性糖及蛋白质等营养物质对植物花芽分化发挥着重要作用[7]。如刘俊松等[8]发现,8年生和2年生温州蜜柑叶片和茎的可溶性糖含量在花芽形态分化前呈积累趋势,在花芽形态分化期下降;而其淀粉含量在秋冬和早春较低,在花萼原基出现后开始回升。总的来说,碳水化合物含量随着花芽分化而不断升高,一定量的淀粉积累有利于花芽分化[9-10]。抗氧化保护酶类在植物花芽分化过程中也具有重要的作用。如邓灿[11]报道,在‘早钟6号’枇杷花芽分化过程中,叶片和花芽中PPO、POD和PAL活性变化均呈“双峰”曲线变化,花芽中PPO、POD和PAL活性均高于叶片,较高的PPO、POD和PAL活性有利于花芽分化的进行。李静等[12]研究发现,4个芍药品种花芽分化过程中各时期POD活性均呈单峰型变化趋势,SOD和CAT活性随着花芽分化呈增强趋势。激素是调控植物花芽分化的重要物质,而有关激素对果树花芽分化的影响在许多果树中已见报道。例如,双季板栗在分化过程中各时期的IAA和ABA含量均高于ZR和GA3含量,高IAA/ABA,低ZR/IAA和GA3/IAA值在促进芽萌动方面起重要作用[13];在枣花芽孕育期需要较低水平的IAA和较高水平GA3,也需要较低的IAA/GA3及较高的ABA/GA3和ABA/IAA[14];ABA、CTK这两大促花激素含量升高,且较高的ABA/IAA、ZR/IAA及ABA/GA3比值有利于‘李光杏’花芽分化的进行[15];刺梨花芽分化时,GA与IAA含量下降,ZR与ABA水平上升对成花有促进作用[16];而Mohanty等[17]证实ABA对成花有促进或抑制的双重作用。
目前,国内外在枣花期调控方面研究主要集中于生物学、形态和物候学特征等方面[18-19],尚未有枣花芽分化过程中各个时期的营养物质、保护酶活性及内源激素动态变化的系统报道。本研究以新疆主栽品种灰枣、骏枣不同发育阶段的花芽为对象,在前期对其花芽分化过程形态变化观察的基础上[3],分析枣花芽分化过程中营养物质、内源激素含量及酶活性的变化规律,为枣花芽分化调控提供依据。
1 材料和方法
1.1 试验地概况
供试材料取自新疆阿克苏地区温宿县新疆林业科学院佳木国家重点林木良种基地的红枣园(N41°15′49″,E80°32′21″,海拔1 103.8 m)。该基地属于大陆性干旱荒漠气候,降雨量少,蒸发量大,气候干燥,昼夜温差大;春季持续较短,多有大风降温天气,年均降水量42.4~94.4 mm,年蒸发量为2 000~2 900 mm;年平均气温为9.9~11.5 ℃之间,年均日照时数2 747.7 h,无霜期195 d。
1.2 材料和方法
1.2.1 试验材料供试材料为8年生新疆主栽枣品种骏枣和灰枣,从2019和2020年4月中旬到5月下旬,自田间随机采集树冠外围中部2~4年生枣股上的枣吊。新疆骏枣、灰枣花芽形态分化进程均可分为6个时期,分别于4月14日和4月17日左右枣股开始萌动,进入花原基分化期到雌蕊分化期分别需要7和11 d左右。骏枣和灰枣花芽分化结束后即进入花蕾期,花蕾期从开始到结束需20 d左右。骏枣是日开型,灰枣是夜开型,两种枣单花寿命较短,从进入蕾裂期到子房膨大期仅需30~36 h。灰枣花量大,坐果率低,花期略长,骏枣花量少,坐果率高,花期较为集中。
1.2.2 试验方法笔者通过前期枣花芽解剖结构观察明确了枣花芽分化的不同阶段,并将灰枣和骏枣花芽分化过程划分为6个时期,即花原基分化期、分化初期、萼片分化期、花瓣分化期、雄蕊分化期和雌蕊分化期。试验每品种选择生长势基本一致的9株树挂牌标记,主要采集植株东南西北4个不同方位的多年生枣股上的枣吊,剥离枣吊上叶片,切取花芽,所选材料要健康、标准,每次材料取完后装入离心管,立即液氮速冻带回实验室,置-80 ℃冰箱,用于观察不同花芽分化时期营养物质含量、抗氧化酶活性、内源激素含量的测定。试验设置3个重复。
1.3 花芽相关指标测定
花芽可溶性糖、淀粉含量测定采用蒽酮比色法;还原糖含量测定采用二硝基水杨酸(DNS)法;蛋白质含量测定采用考马斯亮蓝G-250法;超氧化物歧化酶(SOD)活性测定采用NBT光还原法;过氧化氢酶(CAT)活性测定采用紫外吸收法;过氧化物酶(POD)活性测定采用愈创木酚法;多酚氧化酶(PPO)活性测定采用邻苯二酚法;采用酶联免疫分析法(ELISA)测定生长素(IAA)、赤霉素(GA3)、玉米素(ZT)、脱落酸(ABA)含量[20-21]。
1.4 数据分析
数据采用SPSS 19.0进行统计分析,并用Duncan’s法对平均值进行多重比较。所有数据的录入和作图均使用Excel 2010软件。
2 结果与分析
2.1 枣花芽分化过程中营养物质含量的变化特征
骏枣花芽分化过程中淀粉、可溶性糖、还原糖含量的变化规律相似,均呈先显著降低后显著上升再降低的趋势(图1,A~C)。其中,在花原基分化期至萼片分化期,花芽淀粉和可溶性糖含量急剧下降,但花芽还原糖含量下降幅度不大;花芽可溶性糖含量在转入花瓣分化期时急剧上升至最高峰,而其淀粉和还原糖的含量在雄蕊分化期时达到最高值;进入雌蕊分化期时,花芽淀粉、可溶性糖、还原糖的含量开始下降,但雄蕊分化期与雌蕊分化期之间并没有显著差异。灰枣花芽分化过程中淀粉、可溶性糖、还原糖含量的变化规律与骏枣相似(图1,A~C)。在花原基分化期至花瓣分化期,灰枣花芽可溶性糖的含量变化较为平缓,在花瓣分化期至雄蕊分化期急剧上升,而在转入雌蕊分化期时再下降,但此时淀粉和还原糖含量还在继续上升,并与雄蕊分化期有显著差异。灰枣花芽的还原糖在花原基开始分化至萼片分化期大量消耗,其含量到萼片分化期时比花原基分化期下降了23.54%,且其在萼片分化期到雌蕊分化期又迅速上升并达到显著差异水平。另外,灰枣和骏枣花芽可溶性蛋白含量在花芽分化过程中总体呈先上升后下降的变化趋势,灰枣在花原基分化期到花芽分化初期表现为显著上升,而同期骏枣的变化幅度不明显,而在萼片分化期至雌蕊分化期两种枣品种的可溶性蛋白含量均显著降低(图1,D)。总体来看,在花芽分化过程中,骏枣花芽的还原糖、淀粉、可溶性蛋白含量均高于同期的灰枣。经前期试验验证,骏枣和灰枣是同一时间进入花芽分化期,但骏枣比灰枣提前几天结束分化。由此可知较高的还原糖、淀粉、可溶性蛋白含量有利于枣花芽形态分化。
2.2 枣花芽分化过程中抗氧化酶活性的变化特征
由图2,A可知,花芽中超氧化物歧化酶(SOD)的活性在其分化过程中变化幅度较大。在花原基分化期至萼片分化期,灰枣和骏枣花芽的SOD活性均先急剧上升后再降低;在萼片分化期至雌蕊分化期,灰枣花芽的SOD活性逐步降低,而骏枣则持续上升,这可能是SOD正在参与某些与花瓣原基、雄蕊原基以及雌蕊原基分化相关的代谢活动所致。在花原基分化期至雌蕊分化期,灰枣花芽PPO活性呈逐步下降趋势,但同期骏枣则呈先降低再上升的趋势,但上升和降低幅度较小,没有达到显著差异水平(图2,B)。在花芽分化过程中,其POD、CAT活性显示出逐步降低的动态变化趋势(图2,C、D)。其中,骏枣花芽POD和CAT活性在其开始分化时小幅度降低,在分化初期以后急剧下降;而灰枣花芽POD和CAT活性花原基分化期至分化初期急剧降低,在分化初期后到雌蕊分化期下降速度减缓,转入雌蕊分化期时两种枣品种花芽的POD和CAT活性最低,并与花原基分化期存在显著差异。果树花芽分化过程中需要各种酶参与细胞活性氧代谢,共同维持活性氧的动态平衡,但枣的花芽分化与其他果树不同,枣吊边生长花芽边分化。因此,根据以上试验结果推测保护酶的活性降低有利于枣树花芽分化各个阶段的启动,在分化过程中保护细胞内部的代谢活动缓慢进行,各类保护酶活性下降有助于花芽分化和发育的顺利进行。
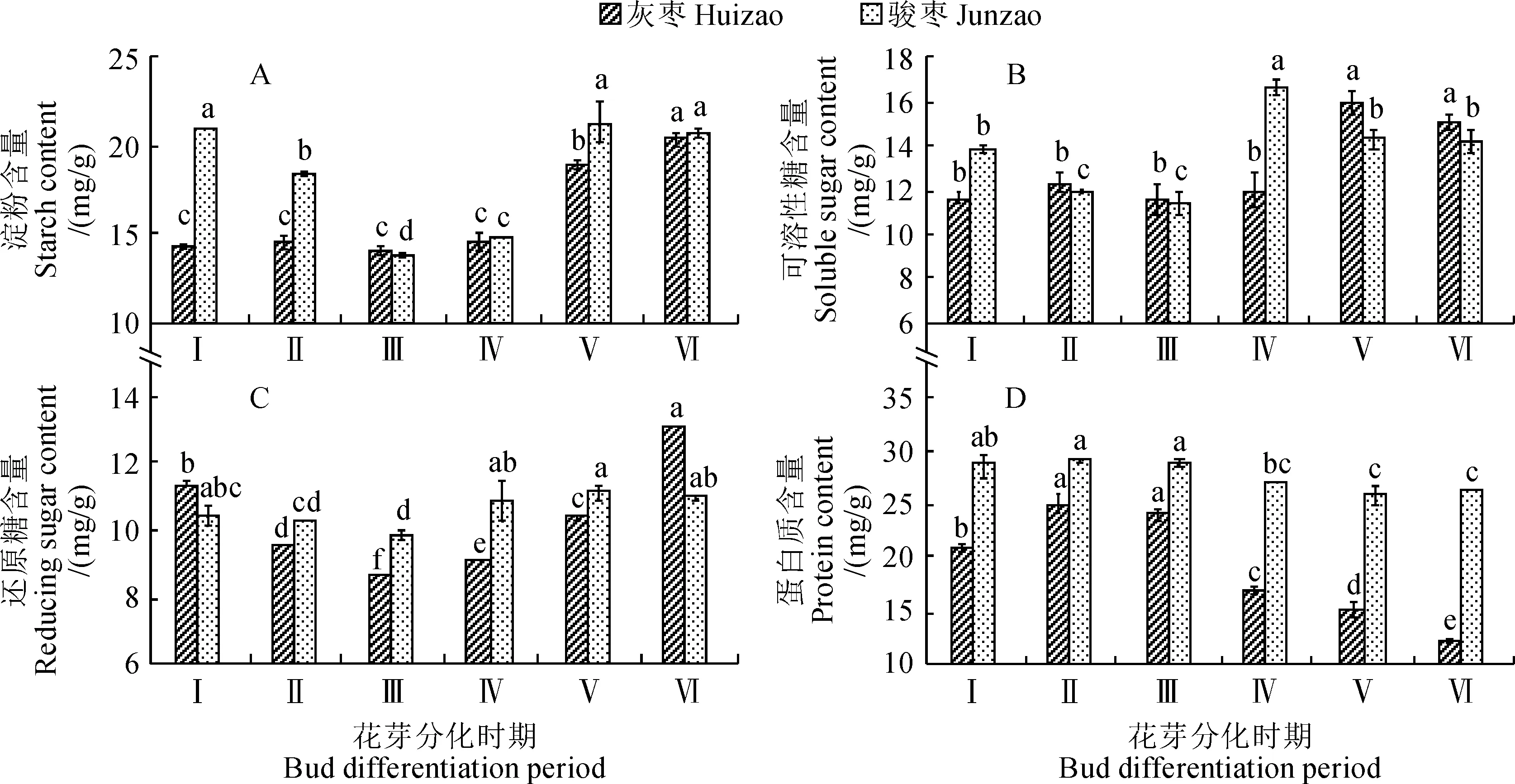
Ⅰ.花芽原基分化期;Ⅱ.分化初期;Ⅲ.萼片分化期;Ⅳ.花瓣分化期;Ⅴ.雄蕊分化期;Ⅵ.雌蕊分化期;不同小写字母表示同一品种不同分化时期间在0.05水平存在显著性差异(P<0.05)。下同图1 灰枣和骏枣花芽分化过程中营养物质含量的变化Ⅰ. Flower bud primordium differentiation stage; Ⅱ. Initial differentiation; Ⅲ. Sepal differentiation; Ⅳ. Petal differentiation; Ⅴ. Stamen differentiation. Ⅵ. Pistil differentiation; The different normal letters within same cultivar indicate significant differences among different differentiation periods at 0.05 level (P < 0.05). The same as belowFig.1 Changes of nutrient contents during flower bud differentiation of Huizao and Junzao

图2 灰枣和骏枣花芽分化过程中抗氧化酶活性的变化Fig.2 Changes of antioxidant enzyme activities during flower bud differentiation of Huizao and Junzao
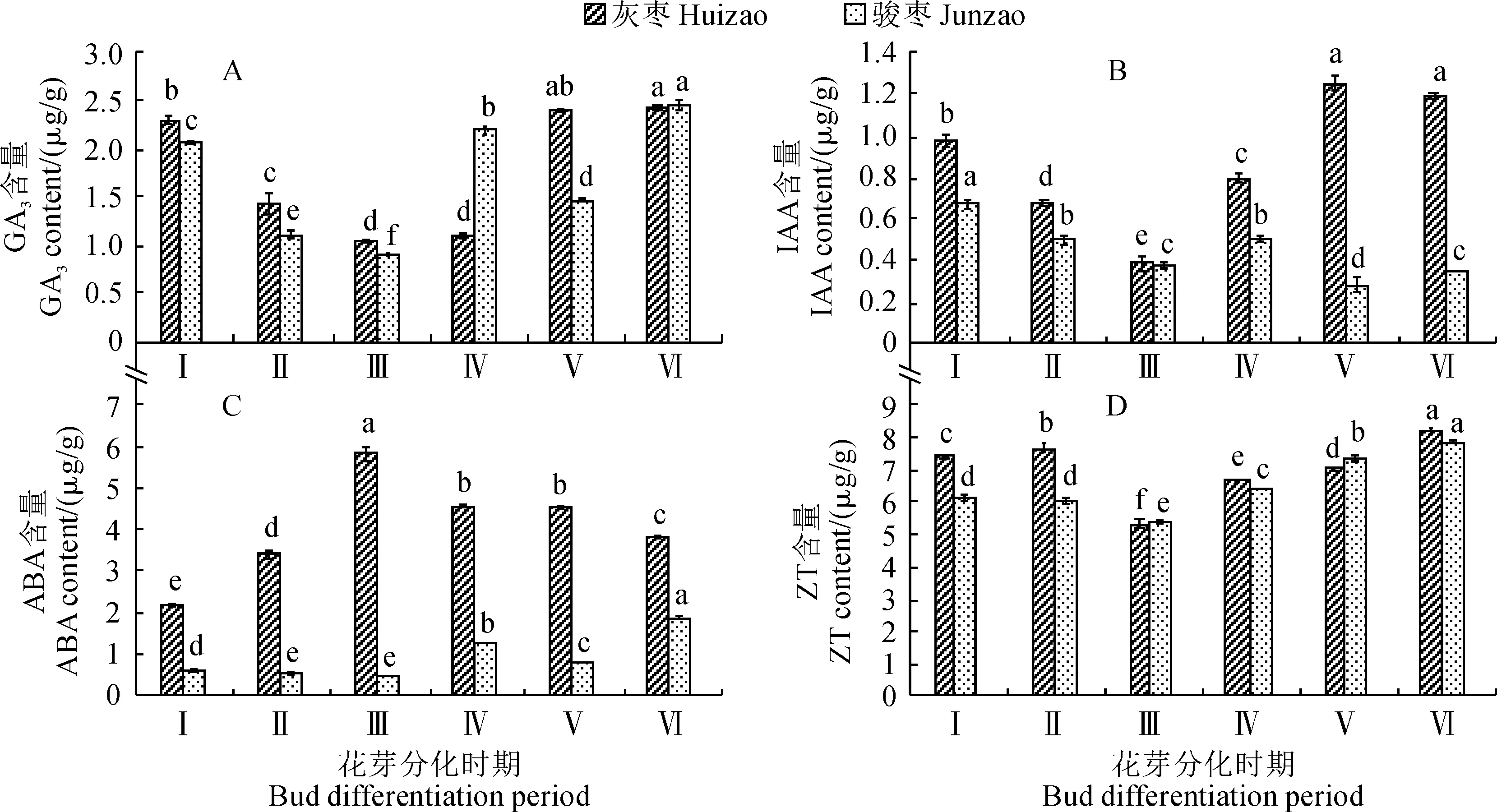
图3 灰枣和骏枣花芽分化过程中内源激素含量的变化Fig.3 Changes of endogenous hormone contents during flower bud differentiation of Huizao and Junzao
2.3 枣花芽分化过程中内源激素含量的变化特征
花芽分化受GA3、IAA、ABA、ZT多种内源激素的协同调控。图3,A~D显示,在灰枣和骏枣花芽分化过程中,其内源激素GA3、IAA、ZT含量均呈现基本一致的高-低-高的变化趋势;在花原基分化期至萼片分化期,GA3和IAA含量急剧下降,而ZT含量则在花原基分化期至分化初期的变化幅度不大,但进入萼片分化期时显著降低,在萼片分化期后则逐步上升;在萼片分化期至雄蕊分化期,灰枣花芽的GA3和IAA含量快速上升后维持最高水平基本不变,而骏枣花芽的变化幅度较大并呈S型波动。灰枣花芽的ABA含量在花原基分化期至萼片分化期显著上升,在转入萼片分化期时达到最高值并与其他分化时期差异显著,随后在萼片分化期至雌蕊分化期逐步降低;骏枣花芽ABA含量在花原基分化期至萼片分化期较低但时期间有显著差异,在萼片分化期至雌蕊分化期表现为小S型波动但整体呈显著上升趋势。前人研究表明高IAA和ABA含量不利于花芽孕育,但对枣花发育和坐果有较大影响,本试验各个花芽发育时期的灰枣激素含量均高于骏枣,特别是IAA和ABA。从此结果来推测,高IAA含量和较高ABA含量不利于枣花芽分化。因此,灰枣中高IAA和ABA含量可使其花芽分化时期比骏枣变长。
2.4 枣花芽分化过程中内源激素比值的变化特征
枣花芽分化过程中各内源激素比值的变化趋势相差较大(图4)。其中,在花原基分化期至萼片分化期,两个枣品种花芽的GA3/ABA和骏枣花芽的GA3/IAA值先显著降低后再逐步上升;而两个品种花芽的ZT/GA3,骏枣花芽的ZT/IAA、ZT/ABA,以及灰枣花芽的GA3/IAA值的变化幅度比较大。同时,骏枣花芽分化过程中ABA/IAA值在花原基分化期至雌蕊分化期呈逐步上升趋势,而灰枣花芽ABA/IAA值在花原基分化期至萼片分化期先显著上升,在萼片分化结束后再降低,但灰枣ABA/IAA和ZT/IAA值还是表现为萼片分化期高于花原基分化期。因此,枣花芽分化过程中较高的ABA/IAA、ZT/IAA和GA3/IAA比率可促进花芽的孕育,有利于花芽形成。
3 讨 论
碳水化合物和可溶性蛋白是植物生长、发育和生理代谢所需能量的提供者和维系生命的重要基础物质,其积累有利于花芽分化[22]。碳水化合物主要包括淀粉和糖类,淀粉常作为储备能量,在花芽分化时水解成可溶性糖供花芽利用[23]。杨盛等[24]研究表明,僵芽梨新梢的芽内可溶性糖、淀粉等营养物质含量和碳氮比低于正常梨园。胡静等[25]研究指出,西红花花芽分化属于向心型发育,高含量的可溶性糖和可溶性蛋白可促进花芽分化。本研究中,骏枣花芽开始分化过程中消耗了大量营养物质,导致花芽中可溶性糖、还原糖和淀粉含量下降;之后,随着灰枣和骏枣花芽的分化又为开花积累营养物质,花芽可溶性糖含量上升;花开放导致消耗大量营养物质使得可溶性糖含量再次下降,且整个花芽分化过程中淀粉含量始终高于可溶性糖和还原糖含量。说明枣花芽分化时产生的大量可溶性糖和淀粉等营养物质转移到芽中,从而促进花芽形态的分化。同时,可溶性蛋白作为花芽促进分化的重要生理指标,与植物性状表达的关系十分密切。李秉真等[26]研究认为,在苹果梨花芽分化过程中总伴有蛋白质合成过程增强,表明花器官形成需要消耗大量的蛋白质。本研究发现枣花芽在进入分化期时可溶性蛋白质含量上升达到最大值后再逐步降低。由此推测枣花芽分化时通过某种信号启动蛋白酶水解组合蛋白,为花芽转变提供充足的可溶性蛋白。

植物内源激素是果树花芽分化的关键诱导因子之一,对花芽分化的顺利进行起着重要的调控作用。赤霉素参与成花信号传导途径,低浓度GA3促进花芽分化,反之则抑制分化[30-32]。本研究中,两种枣花芽中GA3含量在花芽分化起始期急剧下降,达到整个分化过程的最小值,花瓣分化期以后逐步上升,而且均在花芽分化结束时最高,说明低水平的GA3有利于灰枣和骏枣的花芽分化。两种枣品种花芽分化终期(雌蕊分化期)GA3含量最高,有可能是花芽分化结束成花过程需要GA3的积累。IAA是影响植物成花的重要激素之一,但关于IAA与植物成花的关系一直存在争议。张宁等[5]报道高水平IAA含量抑制文冠果花芽分化;Stone等[33]指出,降低IAA水平能够减少糖的消耗,增加淀粉的积累,为成花做准备;郭文丹等[34]发现,油桐花芽生理分化期IAA含量迅速下降,到花芽形态分化开始前降到较低水平。本研究发现,两种枣花芽分化开始后IAA含量迅速下降,说明枣花芽分化诱导期需要较低的IAA浓度;骏枣花芽IAA含量在萼片分化期至花瓣分化期先上升再降低,但是整个分化过程中低于未分化期,说明低水平的IAA有利于骏枣花芽分化;而灰枣花芽IAA含量在萼片分化期后迅速上升,可能与细胞数增加和细胞体积增大有关,因此,灰枣花芽分化与IAA含量的关系尚需深入研究。ABA是一种促进成花的内源激素,Garcia等[35]在油桃花芽分化的研究中发现,其花芽ABA含量生理分化期逐渐上升,在生理分化完成进入形态分化期后逐渐下降,在分化末期再上升。本研究中骏枣进入花芽分化起始期ABA含量下降,而此时灰枣的ABA含量急剧上升,在萼片分化期以后灰枣和骏枣花芽的ABA含量显著高于未分化期,且一直保持在较高水平,说明花芽分化过程中ABA的积累有利于灰枣和骏枣花芽分化和发育。ZT是一种植物体内天然存在的细胞分裂素。细胞分裂素产生于根部,从而保证核酸和蛋白质免遭破坏,促进核酸和蛋白质在作物体内的积累。研究表明,ZT能促进苹果的花芽分化,其含量在花芽生理分化期虽然下降但仍处于较高水平[36];高水平的ZT有利于无花果花芽分化[37]。本研究中,灰枣和骏枣花芽分化前期ZT含量有所下降,随着花芽分化的推进ZT的含量显著增加,因此认为ZT的含量保持在较高的水平有利于枣花芽分化。
植物的花芽分化不仅受单一激素的影响,同时各内源激素相互作用、协调达到一种动态平衡关系,调控植物花芽分化[38]。枣花[14]、苹果[36]等物种植株花芽分化阶段均需要较高水平ABA/IAA;高水平IAA/GA3促进枣开花[14];花芽分化初期至雌蕊原基分化期较高ZT/GA3有利于文冠果的花芽分化[5];切花秋菊‘神马’花芽分化开始后,顶芽和叶片中高比率的ZT/IAA有利于花芽分化[39]。本研究结果表明,骏枣花芽分化过程中ABA/IAA、ZT/IAA、GA3/IAA比值快速上升,由此推测IAA与ABA、GA3和ZT可能存在拮抗作用,且有利于花芽的形成;灰枣花原基分化期至萼片分化期ZT/IAA、GA3/IAA显著上升后降低,分化结束后ZT/IAA、GA3/IAA的比值低于花原基分化期,这表明灰枣花芽转成花过程不需高水平的ZT/IAA、GA3/IAA;ABA与ZT、GA3变化趋势基本相反,枣花芽分化期GA3/ABA、ZT/ABA的比值呈快速下降的趋势。所以,关于枣花芽分化过程中GA3/ABA、ZT/ABA关系有待进一步研究。
综上所述,枣花芽分化是一个极其复杂的过程,灰枣和骏枣花芽开始分化后花芽的POD、CAT、PPO活性一直呈下降趋势;可溶性糖、还原糖、淀粉含量以及GA3、IAA、ZT、GA3/ABA水平显著下降,转入萼片分化期后逐步回升;自花芽开始分化后两个枣品种的蛋白质、ZT/GA3和灰枣的SOD、ABA、ABA/IAA、ZT/ABA显著上升,到分化初期后开始逐步下降,而骏枣的ABA、ABA/IAA、GA3/IAA含量继续上升。多种因素共同调控着枣花芽分化过程,而决不是单一地取决于某一种或某一类物质。营养物质、酶活性和内源激素之间相辅相成,相互促进又相互拮抗,它们的动态变化和平衡对植物的花芽分化起着至关重要的作用。
