可吸收止血材料降解代谢评价策略和放射性标记联合HPLC-MS 技术应用
2021-03-10张天宏李敬来张振清
张天宏,李敬来,张振清
1.国科卓越(北京)医药科技研究有限公司,北京 100176;2.北京苏雅医药科技有限责任公司,北京 102629
及时有效的止血是创伤后伤者或手术中患者预后甚至存活的关键因素[1-2]。作为止血手段之一,针对不同的应用场景(体表出血或内脏出血,轻微渗血,少量积血,中度流血)[3],各种类型的可吸收止血材料已经在全球广泛使用。表1 总结了多种分类依据[4-5],其中分子类型和制备工艺,直接关系到产品的理化性质、体内降解规律、疗效、毒性反应。

表1 已上市可吸收止血材料的分类
可吸收止血材料临床使用中潜在的不良反应主要分两类:(1)过敏反应,局部化学异物或感染引起的或炎症反应和肉芽肿,这与止血材料的降解速率和物理机械作用引发有关;(2)使用后,止血材料降解吸收过程中产生的毒性物质的机体暴露。其中1 类不良反应较为常见[6],需要规范使用操作来解决;2 类不良反应尚未见报道,但随着新型止血材料的研发,不能排除这种风险。为排除2 类风险,新产品研发过程中,以体内的处置动力学研究为基础的,科学严格的安全性评价工作非常重要。
外源物的体内动力学是药理毒理学的基础。详尽阐明外源物在体内的处置过程是解释药效和毒性的物质基础,也是确保应用于人体后,病人免于危险物质或危险水平暴露的关键。作为外源物质(包括食物、药物、毒物、化妆品等)的一种,可吸收止血材料的体内代谢(metabolism)和处置(disposal)的动力学研究也遵循共同的研究策略。目前药物代谢动力学研究比较充分,具备严谨的理论基础、丰富的文献资料,因此本文重点借助药物代谢动力学的理论和成果,结合可吸收止血材料自身的特点,讨论该类产品体内动力学研究的方法和策略。
与药代动力学相比,可吸收止血材料的体内代谢和处置的动力学具有自己独特的特点。不同于经典的给药途径,可吸收止血材料直接应用于组织表面(创面),凝固并被包裹。典型的药物体内动力学过程包括了吸收、分别、代谢、排泄(absorption,distribution,metabolism,excretion,ADME),除个别情况外,例如某些苷类中药在口服后于胃肠道分解为苷原的过程,药物在给药部位的代谢过程几乎可以忽略。相比之下,止血材料在吸收前会在体液的作用下发生降解代谢,主要以降解产物的形式吸收。且这种吸收前的降解代谢往往受到反应接触面积的限制,反应速率远慢于胃肠道中,并可能是这类物质使用后体内动力学过程的限速步骤。这种特殊的体内动力学表现,也是本文开头所提出的这类产品的所表现出的多数1 类毒副作用的原因。
除了上述的给药部位先代谢后吸收的特点,可吸收止血材料的另一个体内动力学的独特特点是,吸收入血的降解产物为不同分子量的一组低聚物,且多为内源性成分。由于降解吸收限速的原因,这些内源性降解产物组的非给药部位暴露很低,持续时间长。这些特点给该类材料的体内动力学研究带来极大的挑战,目前主流的解决方案是放射性标记示踪技术结合液相色谱—质谱联用技术(HPLC-MS)分析手段。本研究总结了该方法的原理、优劣势、试验流程和相关重要的影响因素,以期为该类产品体内动力学研究方案设计提供支持和选项。
另外,不同类型的可吸收止血材料的研发过程中经常面临体内动力学研究策略的问题。例如,有些产品的理论代谢产物是内源性物质;有些是天然物质进行了部分修饰;有些则完全是非天然成分。这些产品在体外研究的基础上,是否有必要进行体内动力学研究,是否需要采用放射性标记,研究到什么程度,才能满足注册申报的证据标准。关于这些问题,我们提出的解决方案是,在充分理论和体外实验评估的基础上,将可吸收止血材料按降解产物风险等级分为低、中、高三个水平,根据不同的风险等级采用相应的体内代谢动力学研究策略和放射性标记示踪技术结合HPLC-MS 分析方案。
最后,按照三级风险分类,分别总结了可吸收止血材料在体外降解规律和体内代谢动力学的进展,为此类产品的降解代谢评价策略和放射性标记联合HPLC-MS 技术应用提供理论和实践的支持。
1 放射性标记示踪技术结合HPLC-MS 分析
1.1 放射性标记示踪与HPLC-MS 的互补性
外源物的体内动力学研究关注的是物质的定位(location)、定量(quantitation)、定性(qualification),因此这门学科的发展强烈依赖于检测手段的进步。近20 年来,随着检测手段的更新进步,尤其是HPLC-MS 联用技术的成熟(在专属性、定性鉴别和定量检测灵敏度的优势),极大促进了外源物的体内动力学的学科发展。但由于化合物电离的影响因素复杂,导致HPLC-MS 定量依赖于标准品,并无法区分所测定物质的外源性或内源性。一旦受试物质体内代谢广泛,面对众多不同的代谢物,该技术将无法实现对外源物代谢特征的全面考察,包括总体代谢途径和各途径对总消除的相对贡献。
与之互补的是放射性同位素标记示踪技术,已经用于外源物体内动力学研究60 年了,目前仍是一种全面的同时也是高灵敏度的体内代谢处置动力学研究方法。虽然现有的分析技术突飞猛进,但仅有放射性示踪技术能够直接、明了地揭示每一种代谢物占总外源物相关物质暴露的百分比,因此该方法是创新药物代谢研究不可或缺的手段。长期以来,放射性同位素标记示踪法被公认为获得全面代谢相关信息的最有效手段(金标准)(没有之一)。美国FDA 审评的新药中85%以上在药物代谢和安全性评价中使用了放射性标记示踪技术。
放射性同位素示踪法的优点[7]:(1)可去除干扰,区分内源性和外源性物质,发挥示踪作用。(2)标记物与非标记物的化学结构完全一致,物理、化学性质及生物活性非常相近。(3)生物细胞不能区分同一元素的各种同位素,而是一视同仁地对待。(4)灵敏度高,例如,可吸收止血材料降解吸收缓慢,导致体内非给药部位暴露极低,要求检测方法必须具有极高的灵敏度。(5)定量方法无需标准品,简便直接,对于某个特定的放射性原子,其放射性(在单位时间内发生衰变的概率、辐射形式)与邻近原子的情况无关,也与原子的化学状态及物理条件无关(因为它们只影响外层电子)。(6)适用于代谢途径复杂广泛或代谢产物标准品不易获得的外源物体内动力学研究。
放射性同位素示踪法的缺点:(1)产生放射性污染;(2)考虑到辐射安全的因素,需具备研究资质;(3)无法进行物质定性,即无法鉴定标记分子的形式。可见,放射性同位素示踪法与HPLC-MS 法具有高度的互补性。二者联合研究是目前主流的方法,具体研究策略见图1。
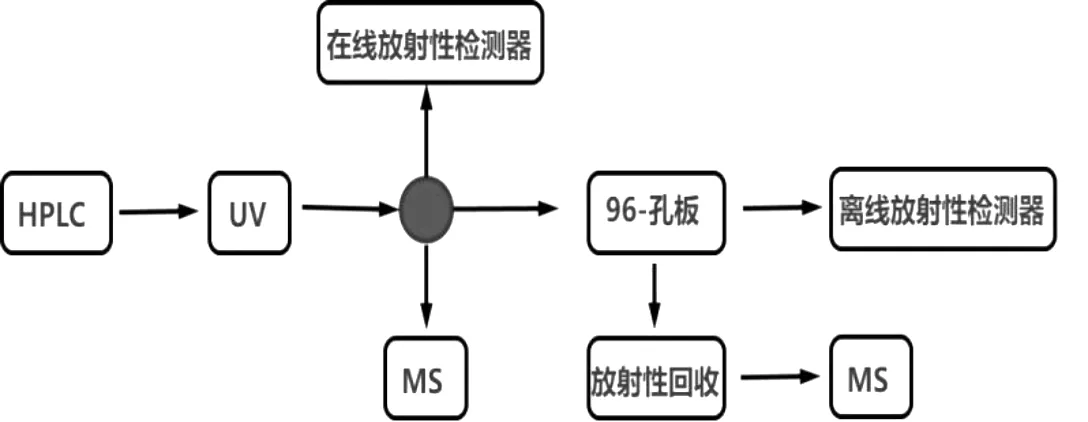
图1 放射性同位素示踪技术联合HPLC-MS研究策略
1.2 放射性标记示踪技术流程
1.2.1 放射性标记物的制备 目前常用于外源物体内动力学研究的放射性核素有14C、3H、32P、33P、35S、125I 和131I 等。核素的选择和标记合成试验设计原则:(1)14C 优于3H,14C 标记在分子骨架中,3H 位于分子骨架的侧枝,体内存在1H-3H 交换的风险,从而影响示踪结果。(2)分子内标优于分子外标,分子内标(如3H 或14C)的标记物与非标记物的化学结构完全一致,物质在生物机体内的化学变化和生物学过程相同,但对于大于10 KDa 的大分子采用125I 的分子外赘合标记,也是可以接受的。同时,实验中需要对脱标记进行监测,一旦脱标记占比过高,将影响数据质量。(3)定位标记优于非定位标记,定位标记的实验结果明确。以1H-3H 交换法为基础的非定位标记,不可控因素较多,实验中应关注脱标记质控。(4)在可商业化购买的放射性标记原料和合成实验可行性的前提下,选择尽量短的合成路线,缩短试验周期,提高产率。(5)3H 定位标记位点选择时,应注意避开氧化代谢软点;14C 标记位点应选择分解代谢后分子所关注的部分,否则损失体内示踪的代表性。(6)对于预期分解代谢为不同分子结构的产品,可选择不同核素双标记,节省实验资源。
1.2.2 放射性标记物的表征 放射性标记物的表征包括:(1)物理化学特性表征,应与非标产品一致。(2)通过高效液相色谱(HPLC),质谱(MS),核磁共振(NMR)等手段表征,应与非标产品一致。(3)HPLC 放射性色谱等手段鉴定放化纯度。(4)通过总放射性活度检测,计算比活度,应满足实验动物需求。(5)测定标记样品的稳定性。
1.2.3 放射性标记物临床前试验 本部分实验目的是:运用经验证的定量、定性测定方法,在可靠的物质平衡数据(回收率>85%)支持下,充分展示给药后受试物相关物质体内暴露情况,原形物和代谢产物总体和分别的动力学过程[8]。具体包括:(1)确定血液、组织、排泄物中总体(总放射性)动力学规律;(2)确定血液和排泄物中的代谢产物全谱;(3)给药位点总体消除过程;(4)确定人和动物体外代谢产物谱、显示种属差异、以便正确选择毒理研究动物种属;(5)通过放射性代谢产物鉴定人体代谢酶,早期发现人体高比例代谢产物,并为药物相互作用研究的试验设计提供依据。对于可吸收止血材料,基本不涉及后2 点。
实验过程包括以下步骤(以3H 和14C 为例)。
药物配置:将非标的受试物与标记受试物按一定比例混合,配制与临床应用一致的剂型。考虑到可吸收止血材料的代谢特点(吸收慢,体内暴露低,研究周期长),可提高放射剂量,以满足检测需求。
动物给药:尽可能模拟临床给药方式。
样品采集:样品包括血、组织、排泄物。对于药物体内物质平衡研究,采集周期应满足排泄物中回收到总给药放射性的85%(3H)或90%(14C)以上,或日排泄放射性占总给药量的1%以下。但对于可吸收止血材料,由于体内过程较慢,需依据自身特点或预实验结果,参考药物研究的标准,设置合理的采样周期。组织分布研究中除血、肝、肾、脑等重要器官外,另应重点关注给药部位,采样时尽可能扩大范围,以免损失放射性,造成给药部位药量的低估。尿粪回收采样周期结束后,动物应进行全面的组织采样测定,这对于解释物质平衡的数据非常关键。
样品处理:液体样品(血浆,尿液)可直接或稀释后与闪烁液混合;固体样品(粪便,组织)需经匀浆均质化后取样,氧化燃烧后回收到闪烁液中;全血干斑也需经氧化燃烧后测定。实验中注意平行插入质控样品,以随时监测氧化燃烧效率的稳定性和均一性。
基于液体闪烁计数(liquid scintillation counting)总放射性活度测定:各种待测样品的基质不同,可能影响到闪烁计数效率和猝灭,需要分别进行标定和质控验证。
液相放射性色谱检测技术(liquid radiochromatography):结合分离HPLC 和MS 手段代谢物谱,如图1 所示,可采用在线或离线放射性检测。
放射性自显影技术(radioautography):尸体冷冻,整体切片,放射自显影[9]。本质上等同于组织分布实验,优势是更直观。
2 可吸收止血材料体内动力学研究策略
全球,包括FDA,没有针对可吸收医疗器械体内处置动力学研究技术指导原则。本研究参考药代动力学研究的相关原则,针对可吸收医疗器械体所独有的给药方式和可能的体内处置规律特点,尝试提出一个初步解决方案,抛砖引玉。
本研究的最终目的是充分阐明止血材料体内降解后ADME 过程,包括受试物在给药部位消除的动力学过程,体内主要降解产物体内暴露曲线,相关代谢终产物排泄动力学过程等。简单说,就是降解机制,降解特性,降解产物谱和相关产物的动力学过程。一般这些研究均在非临床阶段完成,主要包括体外降解试验和体内研究。因此,试验设计应以简单、非标方法优先为原则,综合考虑受试化合物的分子结构信息和体外实验的代谢物结果,确定项目的总体研究策略和放射性标记示踪技术结合HPLC-MS 分析方案。具体见图2。
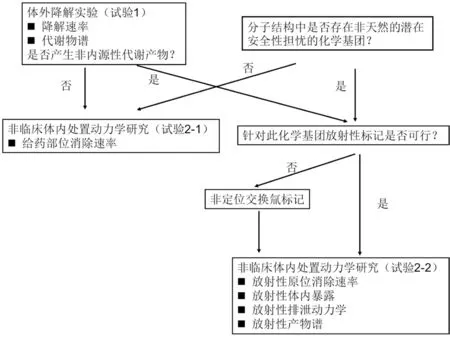
图2 可吸收止血材料体内处置动力学研究策略
从化学分子结构角度,止血材料为经化学修饰改性或化学反应聚合而成的含有重复单元的高分子材料。首先应分析判断止血材料的化学分子结构中是否含有非天然的潜在安全性担忧的化学基团。据此可将止血材料按降解产物风险等级分为低、中、高三个水平,分别对应表1 中按制备工艺分类的三个类别。
体内分析中会遭遇诸如基质复杂,代谢产物与内源性物质一致等困难,另外按临床植入方式给药后,受试物完全降解消除可能耗时较长,更加降低代谢产物的体内暴露浓度,以上因素给定性和定量分析带来挑战。因此,首先需要进行体外降解试验(试验1),并与体内研究(试验2)相互配合。
在试验1 中,可利用生物相关的酶或其他加速降解手段,对受试物的降解能力(稳定性)进行初步判断,并鉴定溶出液体中可能的代谢物谱,判定降解途径和是否产生非内源性代谢产物。
如果在试验1 中没有非内源性物质的生成,且受试物分子结构中没有非天然的潜在安全性担忧的化学基团,例如低风险类,或中风险类中符合以上判断标准的产品,可进行非标记体内研究(试验2-1),按临床植入方式给药后,观察受试物在给药部位消除的动力学过程。由于产物均为内源性物质,可不必考察主要降解产物体内暴露曲线和排泄动力学过程。
如果在试验1 中发现非内源性物质的生成,或止血材料的化学分子结构中含有非天然的潜在安全性担忧的化学基团,二者满足其一,即启动放射性标记试验(试验2-2),按3 项下进行全面的体内动力学考察。例如高风险类,或中风险类中符合以上判断标准的产品。
总结以上的研究策略(具体决策树见图2),可见低风险类可进行非标记研究;高风险类必须进行放射性标记的体内处置研究;中风险类的研究策略选择需结合体外试验代谢物谱结果,和分子结构分析,综合判断。
另外,不能排除其他有效的可接受的标记示踪手段,例如荧光标记等,以及未来创新的研究方法,在可吸收止血材料体内ADME 研究中的贡献。
3 可吸收止血材料体内动力学研究进展
总结现有的公开发表的文献资料,可以发现,可吸收止血材料体内动力学研究策略和放射性标记示踪技术结合HPLC-MS 分析方案基本遵循了上述决策树的原则,具体如下。
低风险产品由于没有生成非内源性物质的潜在安全性担忧,仅进行非标记代谢研究,即按临床植入方式给药后,仅观察受试物在给药部位消除的动力学过程。例如淀粉类,主要降解为寡糖或单糖,通过碘-淀粉显色反应等手段,观察到受试物在植入部位7 d 即完全清除[10-11];壳聚糖类,在体内经巨噬细胞的几丁质酶和溶菌酶作用下生成壳寡糖,再进一步生成 β-葡萄糖胺,通过病理切片和染色,显微镜下观察手段,发现受试物在植入部位3~6 周即完全清除[12-15];明胶及胶原可通过酶解(主要是明胶酶和组织蛋白酶)的方式降解为氨基酸,植入体内后降解时间分别为4~6 周及8~12 周[16-19]。
高风险产品由于具有生成非内源性物质的潜在安全性担忧,需通过放射性标记方法,进行全面的体内动力学考察。例如,氰基丙烯酸酯类粘合剂或聚乙二醇类密封胶,主要通过水解(合成的逆过程)的方式降解[20-21],体内的降解周期至少为3~8 周[22]。
中风险产品来源于天然物质经化学修饰或改性而获得的,可根据图2 的决策树,首先进行体外降解实验,获得代谢物谱的数据,综合受试物分子结构中是否含有非天然的潜在安全性担忧的化学基团,判断是否需要开展放射性标记全面的ADME 研究。一般的,如果本类产品中修饰简单(氧化,羧甲基化),可按低风险产品的研究策略,如修饰过程中引入复杂修饰(交联剂),则按高风险产品的研究策略执行。例如,采用前者研究策略的氧化再生纤维类止血材料,体外降解为不同聚合度的寡聚糖或寡聚糖醛酸[23-33],体内降解周期至少3 周[34-35];采用后者研究策略的某纤维素止血材料,采用交联剂修饰后,经体内放射性标记示踪结合HPLC-MS分析发现此交联剂以某小分子形式排出体外。这体现了中风险产品不同分子采取不同研究策略。
4 总结
综上,可吸收止血材料作为外源物,为了临床安全使用,需全面阐明体内代谢和处置动力学过程。放射性标记示踪技术结合HPLC-MS 分析,是此类产品体内动力学研究的主要手段。本研究充分讨论此方法的优劣势和实验关键考虑因素,提出在充分理论和体外实验评估的基础上,将可吸收止血材料按降解产物风险等级分为低、中、高三个水平,从科学的、全面的、经济的角度分别优化研究策略和放射性标记示踪技术结合HPLC-MS 分析方案,并总结了目前各风险等级产品在体外降解规律和体内代谢动力学的进展。以上为个人观点,不代表任何机构,仅供参考。
