线粒体靶向抗氧化剂MitoQ对猪孤雌激活囊胚冷冻保存的影响
2021-03-10王文杰张树山吴彩风戴建军张德福
王文杰,葛 雷,张树山,吴彩风,戴建军,张德福
(上海市农业科学院畜牧兽医研究所,上海农业遗传育种重点实验室动物遗传工程研究室,上海201106)
自玻璃化冷冻保存技术在小鼠8 细胞期胚胎成功应用以来[1],因其方便、快捷和高效,得到了飞速发展,使哺乳动物种质资源保存成为现实。该技术在牛羊等家畜的胚胎冷冻中应用成熟,并在实际生产中得到了商业化应用[2]。由于猪的胚胎对低温非常敏感,容易受到低温损伤,导致其冷冻保存研究进展仍比较缓慢。我国直到2005年才成功获得猪胚胎超低温冷冻保存后代[3],但相关技术离实际生产应用仍有一定差距,需进一步对冷冻保护剂和冷冻方法进行优化。冻后氧化应激和细胞凋亡被认为是影响胚胎进一步发育的主要因素[4-5]。线粒体是细胞内极其重要的细胞器,是ATP 的主要供给来源。研究表明,冷冻可破坏卵母细胞或胚胎内的线粒体结构,造成线粒体功能障碍,直接影响其体外发育能力[6-8]。MitoQ是一种新型线粒体靶向抗氧化剂,可降低线粒体受到的氧化损伤。在人类精子冷冻保存中,刘丽等[9]发现MitoQ 能够明显降低精子氧化损伤,并显著提高其抗冻能力。本试验在猪卵母细胞体外成熟、胚胎培养及玻璃化冷冻与解冻过程中全程添加200 nmol∕L MitoQ,通过检测其线粒体膜电位、氧化应激水平、凋亡状态、发育能力和相关基因表达水平,探究MitoQ 对猪孤雌激活囊胚冷冻保存的影响。
1 材料与方法
1.1 化学试剂
本研究所用常规生化试剂除特殊说明外均购自美国Sigma 公司,培养液购自美国Gibco 公司,培养所用耗材购于丹麦Nunc 公司。
1.2 卵母细胞的采集和体外成熟
从上海嘉定五丰屠宰场采集猪新鲜卵巢,保存于含200 IU∕mL 双抗的37 ℃生理盐水中,2 h 内运回实验室。抽取卵巢表面直径为2—6 mm 的卵泡液,静置15 min 后于显微镜下挑选结构完整、胞质均匀的卵母细胞复合体(Cumulus-oocyte complexes,COCs),用TCM-199 清洗3 次,每60 枚COCs 置于500 μL 体外成熟培养液中培养44 h。体外成熟培养液由TCM-199 加10%猪卵泡液(实验室自制)、10 IU∕mL孕马血清促性腺激素(宁波第三激素制品有限公司)、10%胎牛血清、10 IU∕mL 双抗、0.1 mg∕mL 的L-半胱氨酸和10 ng∕mL 表皮生长因子组成。培养条件为38.5 ℃、5% CO2及饱和湿度。试验组成熟过程中添加MitoQ,其终浓度为200 nmol∕L,对照组不添加MitoQ。
1.3 卵母细胞孤雌激活及体外培养
成熟培养44 h 后的COCs 用0.1%透明质酸酶消化以去除颗粒细胞,TCM-199 洗涤3 次后,选择形态均一且排出第一极体的成熟卵母细胞进行孤雌激活。使用电激活液(50 μmol∕L CaCl2、0.3 mol∕L 甘露醇和0.1 mmol∕L MgCl2)洗涤卵母细胞3 次,移入电激活槽,电激活参数为1.2 kV∕cm、30 μs、1 次激活。激活后的卵母细胞经PZM-3 清洗3 次后置于38.5 ℃、5% CO2、饱和湿度的培养条件下培养7 d。试验组培养液(PZM-3)中添加终浓度为200 nmol∕L 的MitoQ,对照组不添加MitoQ。
1.4 囊胚玻璃化冷冻解冻
囊胚的冷冻与解冻均在38.5 ℃热台上进行,将培养所得囊胚在冷冻平衡液(PZM-3 含7.5% EG、7.5% DMSO、20% FBS)中处理3—5 min,转移至冷冻保护液(PZM-3 含15% EG、15% DMSO、20% FBS、0.4 mol∕L 蔗糖)中处理15 s,之后用OPS 管装载,迅速投入液氮中保存。解冻时,将OPS 管从液氮中取出,迅速置于解冻I 液(含0.5 mmol∕L 蔗糖的培养液)中,吹出囊胚,处理3—5 min 后转移至解冻II 液(含0.25 mmol∕L 蔗糖的培养液)中继续作用3—5 min,之后囊胚用PZM-3 洗涤3 次,并在PZM-3 中培养24 h备用。MitoQ 处理组解冻囊胚在含有200 nmol∕L MitoQ 的PZM-3 中培养,对照组培养液中不含MitoQ。
1.5 线粒体膜电位检测
线粒体膜电位ΔΨm用JC-1 试剂盒(上海碧云天生物技术有限公司)进行检测。囊胚在JC-1 染液(含800 μL TCM-199 和200 μL 5×染色液缓冲液)中38.5 ℃条件下避光孵育20 min,4 ℃染色缓冲液洗3 次,置于共聚焦显微镜(LSCM,Nikon,日本)下观察拍照。使用Image-Pro Plus 6.0 软件分别记录绿色和红色荧光信号强度,每个囊胚红色(RITC)和绿色(FITC)荧光强度的比值即为ΔΨm。每组重复3 次,每次约20 枚囊胚。
1.6 Pan-Caspase 染色
Pan-Caspase 原位荧光染色采用美国Promega 公司试剂盒进行染色。将FITC-VAD-FMK 用TCM-199按照1∶500 稀释配成染色液,处理好的囊胚置于染色液中孵育20 min,PZM-3 洗3 次,荧光显微镜下观察拍照。用Image-Pro Plus 6.0 软件统计分析荧光强度值。每组重复3 次,每次约20 枚囊胚。
1.7 TUNEL 凋亡染色
用一步法TUNEL 检测试剂盒(上海碧云天生物技术有限公司)进行细胞凋亡检测。解冻好的囊胚在4%多聚甲醛中固定1 h,在含有0.1% Triton X-100 的PBS 中冰浴2 min,之后移入50 μL TUNEL 检测液(2 μL TdT 酶+ 48 μL 荧光标记液)中37 ℃避光孵育1 h。在5 μg∕mL 的Hoechst 33342 染色液中避光孵育10 min进行细胞核染色,PBS 洗3 次后置于载玻片上压片,显微镜下观察。记录囊胚细胞数和凋亡细胞数。每组重复3 次,每次约20 枚囊胚。
1.8 活性氧检测
用活性氧检测试剂盒(上海碧云天生物技术有限公司)检测活性氧水平。处理好的囊胚移入含有10 μmol∕L DCFH-DA 的TCM-199 中,37 ℃作用20 min。清洗3 次后于荧光显微镜下观察拍照,Image-Pro Plus 6.0 分析荧光强度。每组重复3 次,每次约20 枚囊胚。
1.9 脂质氧化检测
脂质氧化(MDA)水平采用试剂盒(上海碧云天生物技术有限公司)进行检测。处理好的囊胚加入150 μL 细胞裂解液,待裂解后,1600g离心10 min,取100 μL 上清,加入200 μL MDA 检测工作液,混匀,沸水浴15 min,冷却至室温,1000g离心10 min。取200 μL 上清于96 孔板中,532 nm 下测定吸光度。MDA 浓度值以nmol∕mg 表示。每组重复3 次,每次约60 枚囊胚。
1.10 凋亡相关基因表达
用一步法cDNA 提取试剂盒(北京全式金生物技术有限公司)提取试验组和对照组囊胚(各120 枚)cDNA。引物信息参见表1,用SYBR GreenⅠ进行荧光定量Real-time PCR。PCR 体系为:1 μL cDNA 模板,0.4 μL Forward Primer(10 μmol∕L),0.4 μL Reverse Primer(10 μmol∕L),10 μL 2 × TransStart Top Green qPCR SuperMix,8.2 μL ddH2O;PCR 程序为:94 ℃30 s;94 ℃5 s,60 ℃(参照各引物最佳退火温度而定)30 s,45个循环;95 ℃10 s,65 ℃60 s,97 ℃15 s;37 ℃5 min。所有样品均3 次重复。相对表达量采用2-ΔΔCt法计算比较。

表1 qRT-PCR 所用引物Table 1 Primers for qRT-PCR
1.11 数据分析
采用SPSS 13.0 软件进行Student’st-test 处理。结果以“平均数±标准误”表示,以P<0.05 为差异显著。
2 结果与分析
2.1 MitoQ 添加对猪卵母细胞孤雌激活囊胚线粒体膜电位和凋亡水平的影响
红色荧光与绿色荧光比值为线粒体膜电位,橙色荧光强度越高表明线粒体膜电位越高。由图1 可知,MitoQ 处理组线粒体膜电位(0.83)相比对照组(0.52)显著升高。
荧光强度越高表示Pan-Caspase 活性越高。MitoQ 组冻后囊胚总Caspase 凋亡蛋白荧光强度值(20.65)相比对照组(42.47)显著下降(图2)。TUNEL 凋亡检测结果显示,MitoQ 组囊胚中细胞的凋亡比例(22.36%)显著低于对照组(36.42%)。

图1 囊胚线粒体膜电位Fig.1 Mitochondrial membrane potential of vitrified blastocysts
2.2 MitoQ 添加对猪卵母细胞孤雌激活囊胚氧化应激水平的影响
ROS 含量越高,绿色荧光强度越强。如图3 所示,添加MitoQ 处理囊胚的ROS 水平(26.32)相比对照组(35.70)显著下降。冻后MitoQ 处理囊胚MDA 含量(37.64 nmol∕L)与对照组(49.83 nmol∕L)相比亦显著降低。
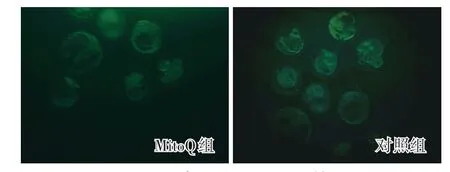
图2 囊胚总Caspase 活性Fig.2 Pan-Caspase activities of vitrified blastocysts

图3 囊胚活性氧水平Fig.3 Effect of ROS level of vitrified blastocysts
2.3 线粒体功能和凋亡相关基因表达
如图4 所示,冻后添加MitoQ 处理的卵母细胞与对照组卵母细胞相比,线粒体氧化应激相关基因CuZnSOD相对表达量显著提升;线粒体功能相关基因(DNM1、MFN2)相对表达量也显著提升;凋亡相关基因TNF-α、Bax相对表达量显著下降,Bcl-2 相对表达量显著升高。
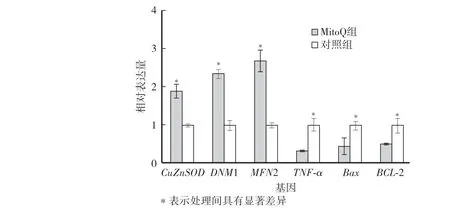
图4 MitoQ 对猪孤雌激活囊胚冷冻后相关基因表达的影响Fig.4 Effect of MitoQ related gene expression in vitrified blastocysts
3 讨论
氧化应激和细胞凋亡是影响冻后细胞损伤的重要因素。细胞内ROS 水平增加可使细胞产生氧化应激,造成线粒体功能损伤,激活细胞凋亡[10-11]。本试验表明,200 nmol∕L MitoQ 处理孤雌激活囊胚,解冻后显著降低了胚胎的ROS 水平,提高了线粒体膜电位值,说明MitoQ 能降低冷冻对细胞的氧化应激,改善线粒体功能。这与陈亚宁等[12]将白藜芦醇作为抗氧化剂在猪孤雌激活囊胚抗冻研究中结果一致,也与明少鹏等[13]用MitoQ 在大鼠海马神经元中改善线粒体功能的研究结果相符。
细胞受到冷冻损伤后会引起细胞内ROS 含量升高,诱发氧化应激[14],而氧化应激会使细胞产生过量的脂质过氧化物MDA,破坏细胞的生物膜活性,诱导大分子氧化变性,抑制蛋白质功能,诱发细胞凋亡[15]。本试验表明,冷冻猪孤雌激活囊胚后添加200 nmol∕L MitoQ 能够明显降低囊胚的MDA 水平,并减少冻后囊胚中的细胞凋亡比例。该结果与Mitchell 等[16]用MitoQ 在肾脏低温保存中降低细胞氧化应激结果类似,说明MitoQ 能够缓解猪孤雌激活囊胚冷冻后的氧化损伤,并通过降低MDA 水平减少细胞凋亡的发生比例,从而提高其抗冻能力。
哺乳动物卵母细胞和早期胚胎在发育中最重要的凋亡途径为线粒体介导的凋亡途径和死亡受体介导的细胞凋亡途径[17]。TNF-α参与了死亡受体介导的细胞凋亡途径[18],MFN2、DNM1、Bcl-2、CuZnSOD和Bax则参与了线粒体介导的凋亡途径[19]。本试验中,添加200 nmol∕L MitoQ 的冻后猪孤雌激活囊胚与对照组相比,促凋亡相关基因Bax、TNF-α表达水平显著降低,抑制凋亡相关基因Bcl-2、CuZnSOD显著升高,表明MitoQ 能够降低细胞冻后凋亡水平,这与Niu 等[20]在猪卵母细胞冷冻研究中的结果相符。MitoQ添加后TNF-α表达水平降低,表明死亡受体介导的细胞凋亡途径可能参与了MitoQ 对孤雌激活囊胚抗冻能力的调节;CuZnSOD表达水平的提高表明MitoQ 可引起囊胚内源性抗氧化物质的增加,从而提高MFN2、DNM1 的表达水平,改善冻后胚胎的线粒体功能,有效降低线粒体介导的细胞凋亡水平。该结果与霍甜甜等[23]用线粒体靶向抗氧化肽SS31 在小鼠神经研究中的结果相符。本研究结果初步表明了MitoQ能同时通过改善囊胚细胞内死亡受体介导的和线粒体介导的凋亡水平,提高胚胎的抗冻能力。
综上所述,200 nmol∕L MitoQ 处理猪孤雌激活囊胚,冷冻后能缓解其细胞氧化损伤,提高其线粒体功能,从而达到降低细胞凋亡水平、提高胚胎抗冻能力的效果。
