鲕状赤铁矿石熔融还原试验研究
2021-03-09马明生
马明生
(中国恩菲工程技术有限公司,北京 100038)
我国的鲕状赤铁矿主要分布于河北省宣化和湖北省宁乡,总储量约为100 亿t[1]。鲕状赤铁矿是嵌布粒度极细的铁氧化物与石英、绿泥石、菱铁矿等矿物以鲕状构造形成的铁矿石。鲕状结构很不利于矿石的单体解理,并且矿石经碎矿和磨矿后特别容易形成微细颗粒,含泥量大,导致该铁矿石的选冶非常困难[2-3]。多年来,研究人员开展了大量研究工作,集中于鲕状赤铁矿矿物学、选矿工艺[4-6]、直接还原-磁选[7-11]等方面,不断完善鲕状赤铁矿资源利用技术基础。本文介绍一种利用高温熔融还原鲕状赤铁矿冶炼生铁的工艺过程,并阐述熔融还原的热力学和动力学研究结果。
1 试验介绍
1.1 试验思路
本试验以河北宣化鲕状赤铁矿石为主要原料,CaO 分析纯作为熔剂,焦炭作为还原剂。将铁矿石、石灰石及焦炭按表1 的配比进行称量,然后初步混合,再装入球磨机在60 r/min 的转速下混合5 min。
将混合均匀的配合料装入石墨坩埚中,在高温电炉中进行熔态还原提铁试验。试验主要考察三部分内容,具体如下所述。
1)考察二元碱度对熔态还原提铁效果的影响。将表1 中的各配比料在1 500 ℃下保温120 min。
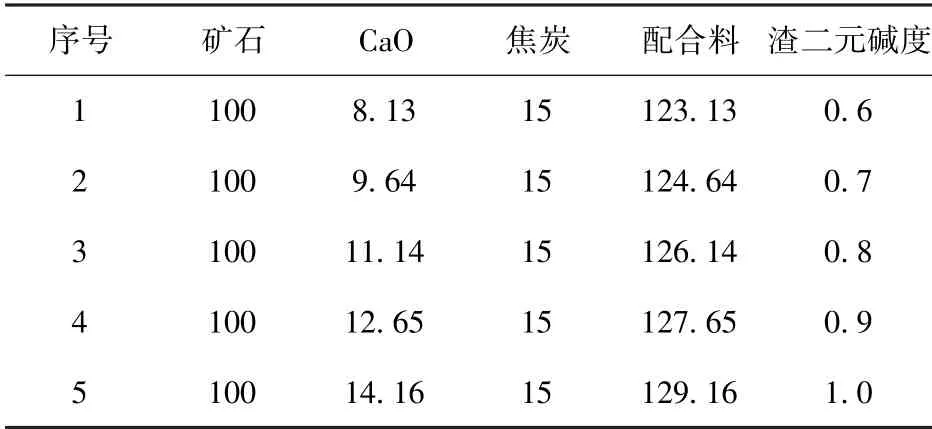
表1 配合料组成 g
2)考察温度对熔态还原提铁效果的影响。将前述试验所确定的最佳配比料分别在1 350 ℃、1 400 ℃、1 450 ℃和1 500 ℃下保温120 min。
3)考察保温时间及温度对配合料还原提铁的综合影响。开展了二元碱度R为0.6、0.7、0.8、0.9和1.0 的配合料分别在1 350 ℃、1 400 ℃、1 450 ℃和1 500 ℃进行0 min、30 min、60 min、90 min、120 min 和150 min 还原提铁试验。
1.2 试验及测试设备
1)原料破碎和加工设备。包括矿石和冶炼渣的破碎及研磨设备,如破碎机、球磨机等。
2)升温设备。原料升温设备采用马弗炉,该炉以硅钼棒为发热体,工作温度最高可达1 700 ℃,完全可以满足原料的熔化和渣铁分离的需要。
3)坩埚及模具。采用石墨坩埚进行渣铁分离试验,规格为直径10 cm,高度20 cm,最高工作温度1 600 ℃。
4)物相分析设备。利用日本Mac XRD 仪对样品进行物相分析,测试条件:在50 kV、40 mA 条件下,以波长λ=0.154 05 μm 的Cu-kα 靶作为发射源,测试角度范围是10° <2θ<65°。
5)显微设备。利用德国Leitz 偏光显微镜来观察鲕状矿石内部铁矿石和脉石矿物的分布。
2 矿石组成及物相
矿石的化学成分分析结果列于表2。矿石全铁含量为47.66%,S、P 含量分别为0.22%和0.24%。矿石的XRD 测试结果如图1所示。经鉴定,其主要矿物相组成为赤铁矿、菱铁矿和石英。由图2 及图3 的光学显微镜观察结果可知,赤铁矿与脉石矿物菱铁矿、石英多以逐层包裹的细颗粒鲕状结构分布于矿石中。如图3~5所示,偏光显微镜下观察到矿石中还有少量细颗粒分布的黄铁矿、绿泥石和绿帘石矿物。
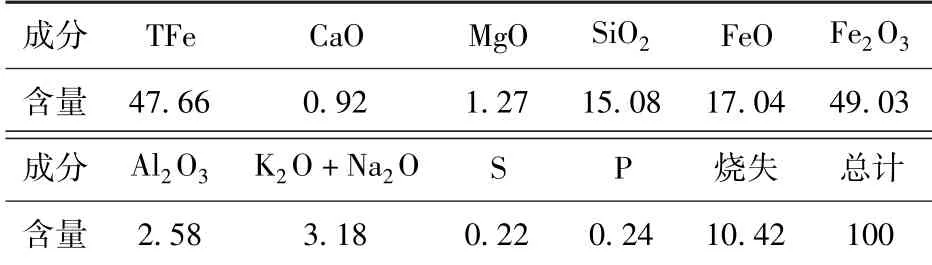
表2 鲕状赤铁矿石多元素分析结果 %
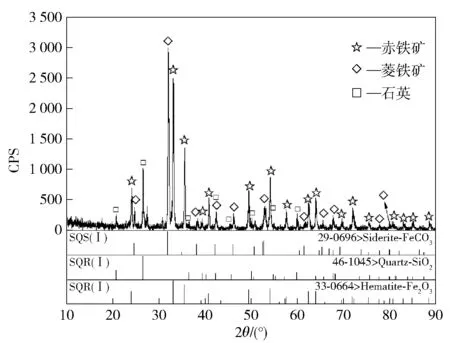
图1 鲕状赤铁矿石XRD 测试结果

图2 鲕粒分布形貌(反光)

图3 赤铁矿与绿泥石层间分布(反光)

图4 与绿帘石毗邻的赤铁矿(正交偏光)
根据XRD 测试数据,采用K值法来计算各物相的质量分数。K值(也称RIR 值)是按样品与Al2O3(刚玉)按1∶1的质量比混合后,测量样品最强峰的积分强度/刚玉最强峰的积分强度,如式(1)所示。若一个样品中同时存在A、B、C 等相,可以选用A 相作为标样,通过PDF 卡片查到每个物相的K值,就可以计算出以其中的A 相为内标物时每个物相的相对K值,如式(2)所示。如果一个系统中存在N个相,其中X相的质量分数表达为式(3)[13]。

鲕状赤铁矿石的三种矿物相的K值列于表3,以石英作为内标样,由式(2)可得鲕状赤铁矿石中每个物相的相对K值,计算结果见式(4)~(6)。
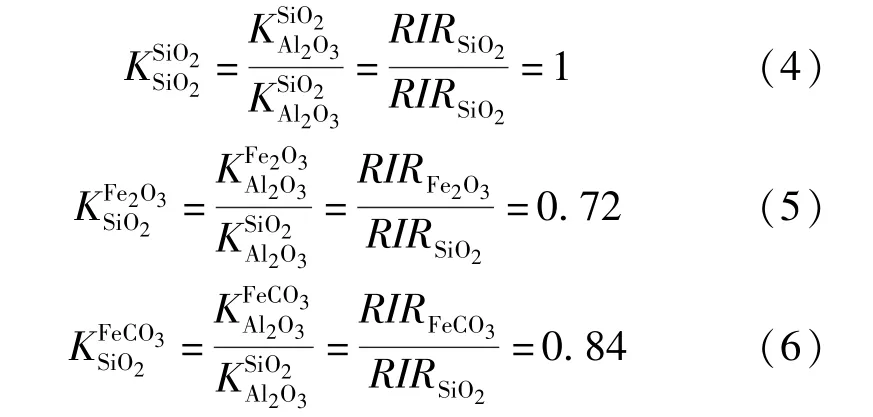
将表3 中各物相的峰积分面积和各物相的相对K值代入式(2),可得三种物相的质量分数分别为:wFeCO3=33.4%,wFe2O3=59.7%,wSiO2=6.9%。根据表2 中所列数据,矿石中Al2O3、CaO、MgO、(K2O +Na2O)、S 及P 等质量分数之和为8.41%,因此须进一步计算含有这些组分矿物的质量分数。K值法计算所得SiO2质量分数为6.9%,化学测试结果为15.08%。光学显微镜下观察结果表明,矿石中SiO2除以石英形式存在外,还以绿泥石Y3[Z4O10](OH)2·Y3(OH)6(Y = Mg2+、Fe2+、Al3+和Fe3+,Z = Si 和Al)和绿帘石Ca2(Fe3+,Al)3[SiO4][Si2O7]O(OH)等形式存在。由于绿泥石、绿帘石的含量少且分布不均匀,在这里不作详细的物相含量计算和说明。由表2 中S 的质量分数可得矿石中黄铁矿FeS2的质量分数为0.47%,由图5 可以看出黄铁矿以极细颗粒嵌布在赤铁矿层中。由于黄铁矿、绿泥石和绿帘石等含铁矿物中Fe 的含量极少,可忽略不计,经计算可得FeCO3和Fe2O3的质量分数为27.35% 和48.88%。

图5 鲕粒核心的他形赤铁矿
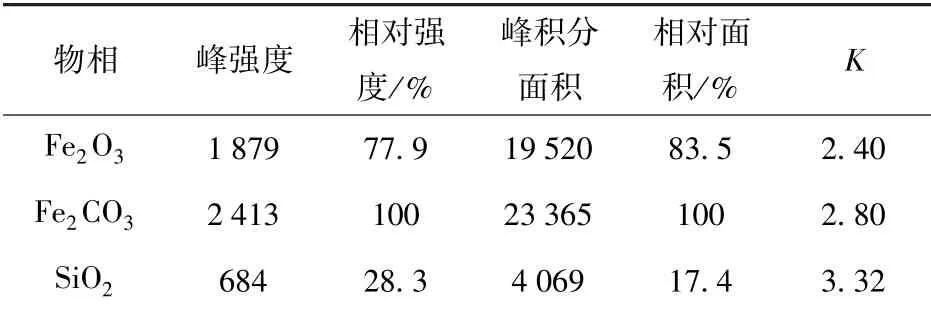
表3 XRD 测试数据
3 试验结果与讨论
3.1 二元碱度对还原效果的影响
分别将二元碱度为0.6、0.7、0.8、0.9 和1.0 的配比料置于马弗炉中,各配比料随炉升温至1 500 ℃,并分别保温120 min。
在1 500 ℃温温度下保温120 min 后所得铁块的质量列于表4 中。本研究中定义100 g 矿石还原得到铁块质量(简记为mFe,下同)与矿石全铁品位的比值为金属铁回收率,记为XFe(%)。表4 中列出了各配合料的XFe。
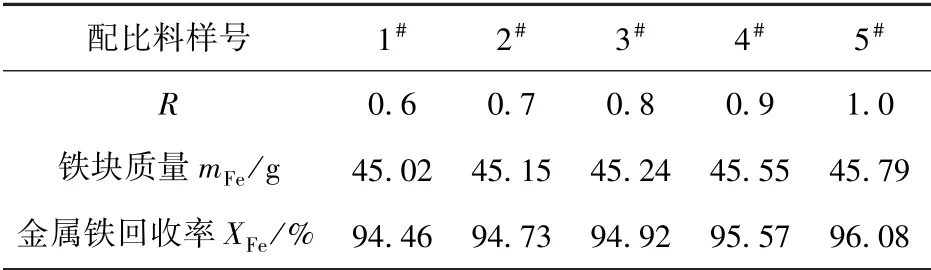
表4 铁块质量和金属铁回收率
从表4 可以看出,R从0.6 增大到0.8 时,mFe和XFe的上升幅度很小;当R由0.8 增至0.9 的过程中,铁块质量和金属铁回收率出现明显的上升趋势;随着R继续增大,这一上升趋于平缓。
配合料在随电炉升温过程中,矿石鲕粒中的SiO2与CaO 发生式(7)所示反应。
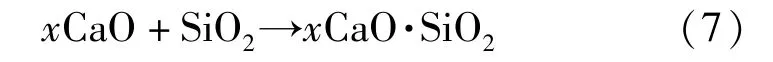
这一反应使结构致密的鲕粒逐渐破解,被SiO2包裹的Fe2O3能够与焦炭或CO 发生还原反应。图6 为鲕粒解离和Fe2O3被还原的反应过程的模型。由模型可以看出,增大CaO 加入量能有效地提高鲕粒中的石英与CaO 的接触几率,加快式(7)的反应进程,进而加快鲕粒的解体速度。伴随鲕粒解体而获得“自由”的Fe2O3将按Fe2O3→Fe3O4→FeO→Fe的顺序逐渐被C 或CO 还原成单质铁。
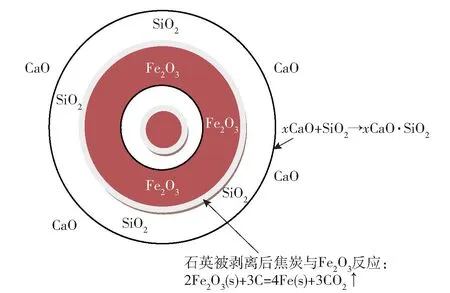
图6 鲕粒解离与Fe2O3还原过程
3.2 熔融还原热力学分析
矿石中的含铁矿物Fe2O3和FeCO3在升温过程中分别发生式(8)、式(9)所示的反应,这两个反应的产物FeO 将在高温下与固体碳C、CO 和溶解碳[C]反应生成金属铁Fe(反应机理见式(10)~(12))。

二元碱度R=1.0 的配合料在1 350 ℃、1 400 ℃、1 450 ℃和1 500 ℃温度下分别保温120 min 的试验结果如图7所示。由图7 可以看出,铁块质量mFe随着温度升高而增大,金属铁回收率XFe相应地由89.85%增至97.96%。1 500 ℃下保温120 min 试验所得铁块质量与1 350 ℃、1 400 ℃和1 450 ℃这三个温度下分别保温120 min 试验所得铁块质量相比,分别上升9.04%、7.06%、1.96%。当温度在1 450 ℃以上,温度升高对还原效果的影响逐渐减小。

图7 铁块质量及金属铁回收率与温度的关系
图8 是不同温度条件下试验所得铁块的XRD测试结果。1 300 ℃下所得铁块的衍射曲线上只有金属铁的衍射峰;温度高于1 400 ℃所得各铁块的衍射曲线上有铁和炭两种物质的衍射峰。XRD 鉴定结果表明,各铁块中铁的晶型都是δ-Fe;2、3 和4衍射曲线上出现的炭是以石墨的形式存在。图8 中2#、3#和4#三条衍射曲线上石墨晶体衍射峰强度出现随着温度升高而增大的趋势。
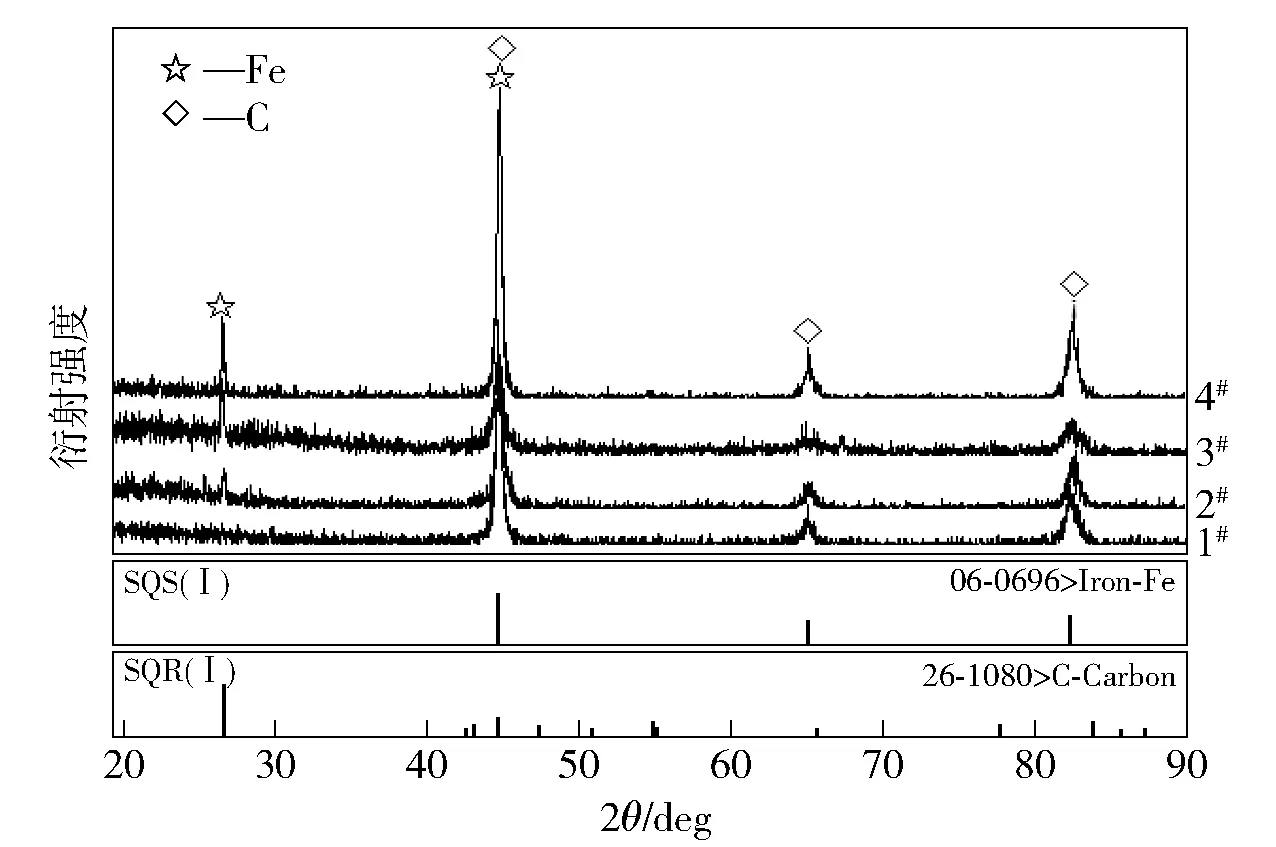
图8 不同温度下熔制所得铁块XRD
表5 中列出了上述四个铁样的化学成分测试结果。由表5 可以看出,铁块的含碳量随着温度升高由1.01%上升至2.32%,这一上升趋势与XRD 测试所得到的结果一致。
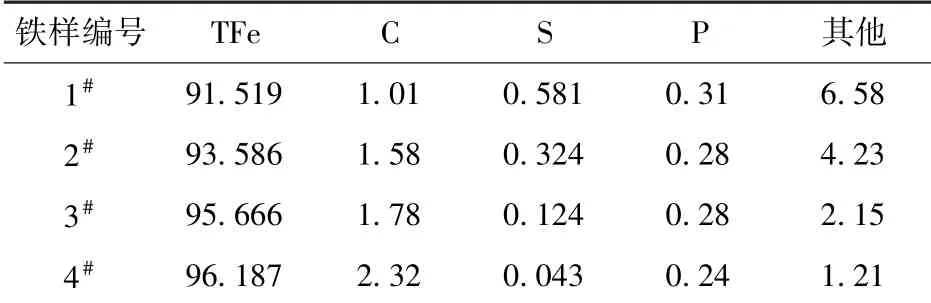
表5 铁块化学成分 %
化学分析结果还显示出S、P 含量随温度升高出现下降的趋势。图9 直观显示了铁块中各化学成分随温度上升的变化趋势,并利用数值方法拟合各组分随温度变化的函数关系式。拟合结果表明,铁块中碳的质量分数与温度成指数关系,表达式为y=0.002e0.0064x;TFe、P、S 的质量分数与温度成线性关系。

图9 铁块化学成分与温度的关系
随着温度的升高,铁液的渗碳能力增大,表5 的数据和图9 中C 的质量分数与温度的关系拟合曲线表明,C 含量与温度成指数上升的关系。渣铁分离效果也随温度的升高而改善。从表5 可以看出,当温度由1 350 ℃升至1 500 ℃,铁块中杂质的质量分数从6.58%降至1.21%。
3.3 熔融还原反应动力学分析
高温条件下,铁氧化物尤其是FeO 的还原反应机理是揭示反应温度、体系中FeO 浓度C[FeO]及碳C的存在形式等因素对总反应进程影响的主要依据。确定FeO 的还原反应机理首先需要测定反应级数n和反应速率常数k,然后在此基础上利用理论计算与实验数值对比的方法推测可能的反应机理。
[FeO]被还原成单质铁主要发生式(10)~(12)所示的三种反应。

总反应:
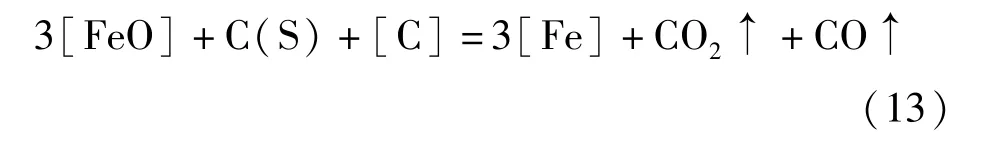
经计算,1 350 ℃条件下,式(10)~(12)三个反应自由能ΔrGΘ分别为15 824.91 J/mol、-92 994.68 J/mol和-47 156.71 J/mol。该计算结果表明,在该温度下,除CO 还原[FeO]的反应外,其他两个还原反应都是自发进行的。根据质量作用定律,反应(13)的反应速率表达为式(14)。

结合反应(10)~(12)各反应自由能计算结果,可以推断温度1 350 ℃条件下总反应中不包括CO参与的还原反应,总反应式和反应速率表达式见式(15)~(16)。
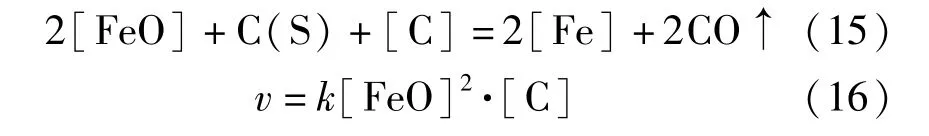
基于配合料组成、温度、保温时间的试验结果,进行了二元碱度为1.0 的配合料在1 350 ℃、1 400 ℃、1 450 ℃、1 500 ℃四个温度条件下的反应动力学试验研究。在各温度条件分别进行保温0 min、30 min、60 min、90 min、120 min 和150 min 的还原试验,然后分别测试渣中FeO 含量C[FeO],试验结果如表6所示。
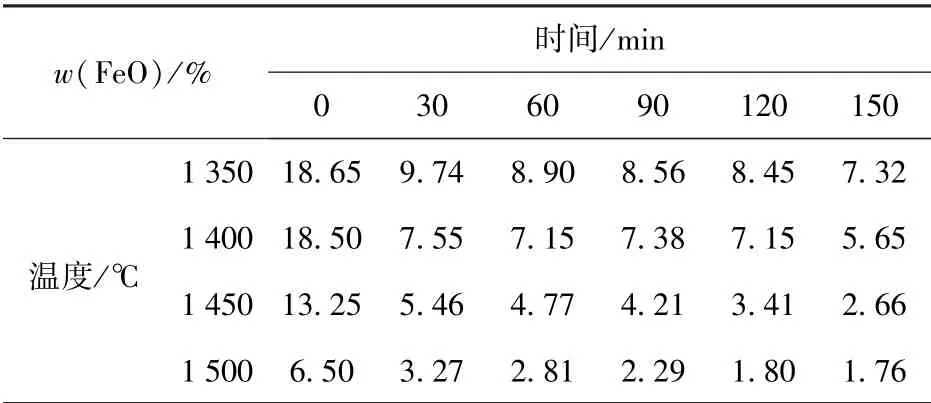
表6 各反应时间熔渣中FeO 含量C[FeO]
由表6 所列熔渣中C[FeO]数据,经拟合可得各温度下C[FeO]与时间t的关系式(17)~(20),试中C[FeO]用y表示,t用x表示。
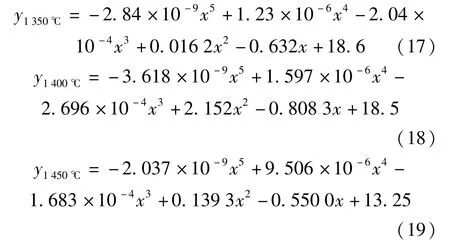
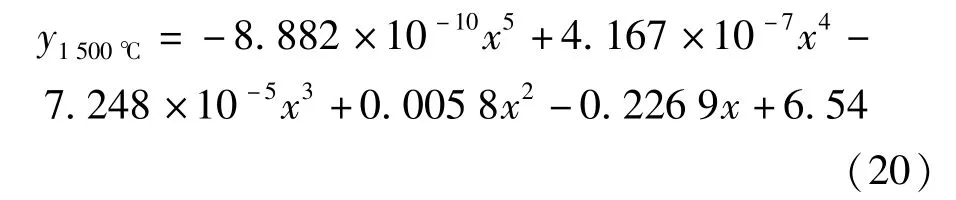
由表6 数据可以看出,0 到30 min 这一时间段内是各温度条件试验中C[FeO]下降最快的阶段。与之相比,在保温时间大于30 min 后的反应过程中,C[FeO]下降程度明显减小。因此,在分析C[FeO]下降较快的0~30 min 这一时间段内的反应动力学影响因素时,采取作图法分析反应速率级数n和反应常数k的关系,并根据计算结果进行反应机理分析和探讨;对于时间大于30 min 后的反应过程的分析,将通过比较各配合料在相同时间的C[FeO]来分析这一时间段内还原反应的主要特点和影响反应进程的影响因素。
对于保温时间小于30 min 的反应速率计算,利用拟合曲线表达式和一阶导数表达式求出保温时间为10 min、15 min、20 min 和25 min 时的C[FeO]和反应速率v,根据这两个值求出lgC[FeO]和lgv后由作图法可计算得出反应级数n和反应速率常数k,这些数据已列于表7 中。
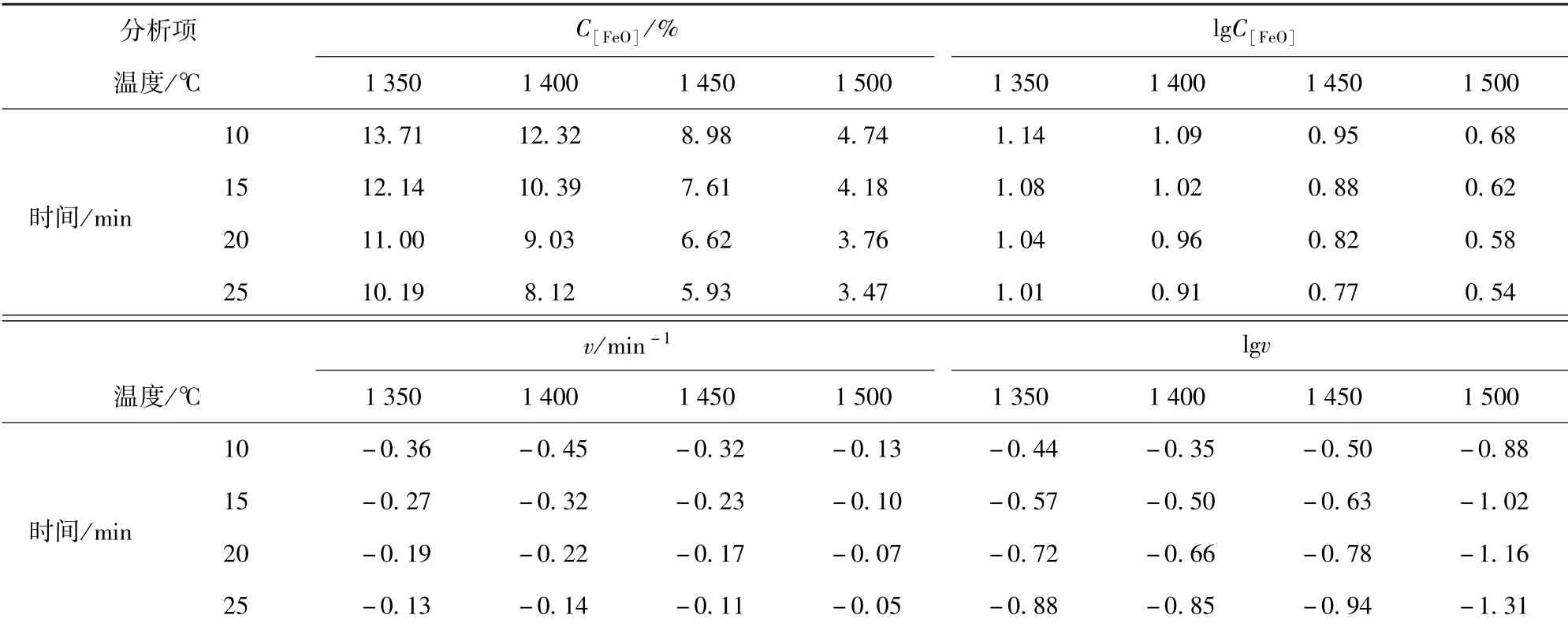
表7 各温度条件下FeO 的浓度C[FeO]和反应速率v
对拟合曲线表达式(17)~(20)两边都取一阶倒数,得∂y/∂x,即为拟合曲线上某一点切线的斜率,该斜率表示该点对应时刻的还原反应速率的负值。上面4 个拟合曲线方程的一阶倒数表达式见式(21)~(24)。
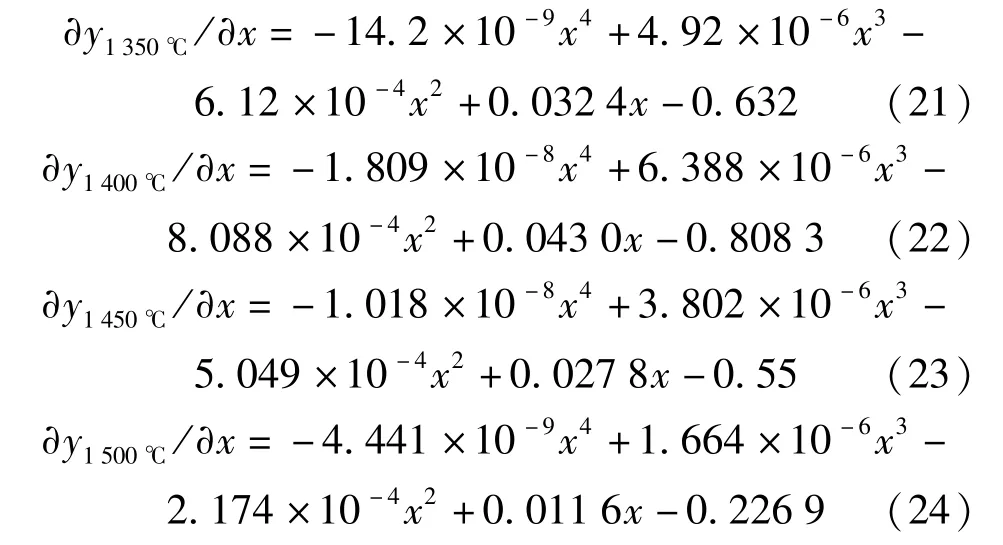
设反应速率为v,速率常数为k,FeO 的浓度为C,反应级数为n,则有:v=kCn,对等式取对数,得lgv=lgk+nlgC。根据表7 中数据可得出各温度条件下lgv~lgC[FeO]拟合直线,该拟合直线的斜率为反应级数n,截距为lgk。各温度下的反应动力学计算结果如表8所示。

表8 各温度条件下反应动力学计算结果
拟合直线的斜率即是还原反应的反应级数n,因此配合料在1 350 ℃进行还原反应的反应级数为n1350℃=3.344,利用直线截距数值可计算得到反应的反应常数为k1350℃=6.01 ×10-5,还原反应速率为v1350℃= 6.01 × 10-5C3.344,总反应为式(25)。1 350 ℃温度下,在保温时间小于30 min 的反应阶段,熔渣中FeO 浓度C[FeO]的微小改变都会引起还原反应速率发生较大的变化,且每个配合料的反应速率式中较小的反应速率常数表明,要加快反应速率,反应初始状态下熔渣中FeO 需要具有较高的浓度。

1 400 ℃温度下,还原反应的反应级数n1400℃为2.737,反应常数为4.92 ×10-4,还原反应速率为v1400℃=4.92 ×10-4C2.737。对于R为1.0 的配合料,其反应级数n1.0= 2.737,总反应为式(26)。在1 400 ℃时,反应速率对熔体中[FeO]、[C]浓度变化敏感性相较于1 350 ℃时明显下降,表明提高反应温度从热力学上改善了反应进行条件。
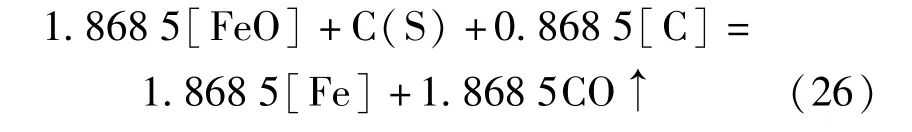
1 450 ℃温度下,还原反应的反应级数n1450℃为2.444,反应常数为1.56 ×10-3,还原反应速率为v1450℃=1.56×10-3C2.444。反应式(10)~(12)的反应自由能分别为19 841.91 J/mol、-105 710.68 J/mol 和-55 733.71 J/mol。随着温度上升,C(S)和[C]参与的还原反应的反应自由能负值性逐渐增大,表明CO参与还原的能力随温度上升力逐渐下降,还原剂C(S)和[C]参与还原反应的能力逐渐增强。比较C(S)和[C]参与的还原反应自由能和,可以看出在1 450 ℃下前者的负值性大于后者,说明C(S)参与的还原反应对总反应(13)的贡献大于[C]参与的还原反应。因此在利用改变式(15)中反应物系数来确定总反应表达式时,仍采取固定式中C(S)的系数,通过改变[C]的系数来获得1 450 ℃下各配合料的总反应表达式。1 450 ℃温度下的总还原反应表达为式(27)~(28)。

1 500 ℃温度下,还原反应的反应级数为3.136,反应常数为1.04 ×10-3,于是可得各配合料的还原反应速率v1500℃=1.04 ×10-3C3.136。1 500 ℃条件下式(10)~(12)的反应自由能分别为21 850.41 J/mol、-112 068.68 J/mol 和-60 022.21 J/mol。比较C(S)和[C]参与的还原反应自由能Δr和,可以看出在1 500 ℃条件下后者的负值性大于前者,说明C(S)参与的还原反应对总反应式(15)的贡献大于[C]参与的还原反应。利用改变式(15)中反应物系数来确定总反应表达式时,通过改变而C(S)的系数来获得1 500 ℃条件下配合料的总反应表达式。1 500 ℃温度下的总还原反应表达为式(29)~(30)。
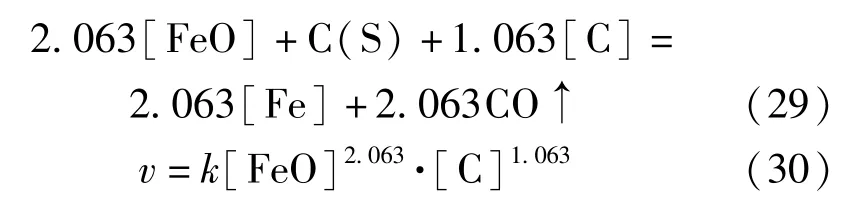
各温度条件下反应速率方程计算结果表明,渣中[FeO]浓度变化对反应速率的影响为主要限制环节;[FeO]浓度及[C]浓度变化对反应速率的影响随温度提高而逐步下降;反应速率常数随温度提高而增大。对比1 350 ℃和1 500 ℃两个温度条件下的数据可以看出,后者的速率常数为前者的17.3倍,表明温度升高可有效提升还原反应速率。
4 结论
1)矿石的矿物相组成为赤铁矿、菱铁矿和石英,并以逐层包裹的细颗粒鲕状结构分布于矿石中。根据矿物结构特征,构建了鲕粒解离和Fe2O3被还原的反应过程的模型,试验结果,表明增大CaO 加入量能有效提高鲕粒中石英与CaO 的接触概率,有效加快鲕粒的解体速度,促进Fe2O3还原并提高金属铁的回收率。
2)提高还原反应温度能够有效提升金属铁的回收率及铁中的碳含量,降低铁中S、P 含量。试验数值拟合结果表明,铁块中碳的质量分数与温度成指数关系,表达式为y=0.002·e0.0064x,TFe、P、S 的质量分数与温度成线性关系。
3)热力学计算结果表明,在高于1 350 ℃的温度条件下,渣中的溶解碳[C]和固体碳C(S)是参与反应的还原剂,CO(g)不参与反应。
4)还原反应动力学计算结果表明,渣中[FeO]浓度变化对反应速率的影响为主要限制环节,[FeO]浓度及[C]浓度变化对反应速率的影响随温度提高而逐步下降,表明温度升高可有效提升还原反应速率。
