STAT3及其多态性在HPV16所致宫颈癌发生过程中的作用研究
2021-03-09莫小亮覃桂荣蒋晓莉周卓琳
莫小亮 覃桂荣 蒋晓莉 周卓琳 袁 媛
广西医科大学第一附属医院计划生育病区,广西南宁 530021
女性生殖系统常见一类恶性肿瘤为宫颈癌,疾病发病率仅次于乳腺癌,位居女性恶性肿瘤第二位。近些年来,宫颈癌疾病呈现上升及年轻化趋势,成为威胁中青年女性健康的恶性疾病。早期阶段宫颈癌症状隐匿,缺乏特异性,多数患者确诊就医发展至中晚期,错过最佳治疗时间,患者预后较差[1]。目前对宫颈癌发病机制尚不明确,临床缺乏敏感、特异的早期诊断方法及有效治疗手段[2]。因此,探索宫颈癌发病相关分子机制,寻找肿瘤诊断新型分子标志物及治疗靶标具有重要临床意义。相关研究表明[3],人乳头状瘤病毒(HPV)感染作为宫颈癌发生重要致病因素,与多个方面因素影响,需全面对致病机制深入探讨。转录活化子(signal transducer and activator of transcription,STAT)参与细胞增殖、分化、凋亡以及血管形成等过程,且与肿瘤产生联系紧密[4]。本研究旨在探讨STAT3 基因表达及其多态性在HPV16 所致宫颈癌发生过程中的作用,现报道如下。
1 资料与方法
1.1 一般资料
抽取2015年1月~2017年12月广西医科大学第一附属医院收治的40 例慢性宫颈炎患者、27 例宫颈上皮内瘤变患者及17 例宫颈癌患者作为研究对象。纳入标准:①患者均经临床确诊;②患者及家属知晓本研究开展经过,并自愿参与;③临床依从性偏高,配合后续研究开展。排除标准:①中途转院及失访者;②存在影响研究开展的其他疾病。慢性宫颈炎患者中,年龄27~64 岁,平均(45.6±4.5)岁;病程1~23 个月,平均(6.9±1.5)个月。宫颈上皮内瘤病变患者中,年龄29~66 岁,平均(46.2±5.1)岁;病程1~24 个月,平均(7.5±1.4)个月。宫颈癌患者中,年龄29~64 岁,平均(45.9±4.2)岁;病程1~24 个月,平均(7.6±1.3)个月。三组患者的一般资料比较,差异无统计学意义(P>0.05),具有可比性。另外收集10 名健康体检者的样本资料,在PCR-反向点杂交法下展开HPV16 E6 蛋白基因测定,为阴性表达对照。本研究经广西医科大学第一附属医院医学伦理委员会批准。
1.2 方法
HPV16 E6 蛋白测定:标本制作成石蜡组织,切片后进行HE 染色,开展分型检测HPV 亚型,采取聚合酶链反应(PCR)-反向点杂交法。并采取免疫组化Supervision TM 二步法,检测标本中HPV16 E6 蛋白表达水平,检测方法为切片染色,要求病理科医师进行双盲阅片,HPV16 E6 蛋白表达阳性细胞染色表现为棕黄色颗粒,表达位置为细胞核,镜下染色后,阳性细胞及染色强度结果开展半定量评分。依据细胞着色深浅分为无色、浅黄色、棕黄色、棕褐色,分别为0、1、2、3 分,0~1 分为阴性,2 分以上为阳性。
STAT3 基因测定:制备病理组织标本,并取各组病例组织5 cm×5 cm,利用10%甲醛固定,石蜡包埋,将其切片为厚度为3 μm 切片,采取HE 染色,采用聚合酶链反应(PCR)测定STAT3 基因型,构建STAT3引物(上游引物:5′-GAACTCCCTGAAAAGCTAAAGC-3′,下游引物:5′-GTTGGGCTCAAATACGGTGG-3′),以β球蛋白基因(350 bp)作为参照基因,取上下游引物各2 μL、DNA 聚合物25 U、氯化钾50 mmol/L、氯化镁1.5 mmol/L 及相应缓冲液。反应条件:94℃预变性5 min,变形30 s,63℃下退火30 s,72℃延伸30 s,经35 个循环后72℃延伸5 min,采用1.5%琼脂糖凝胶电泳分析PCR 扩增产物基因型。采取PCR-制片段长度多态性(RFLP)对各组STAT3 基因C1697G 多态性测定。
1.3 观察指标
采用免疫组化检测HPV16 E6 在健康体检者、慢性宫颈炎、宫颈上皮内瘤变及宫颈癌中的表达。对E6、STAT3 蛋白在慢性宫颈炎、宫颈上皮内瘤变及宫颈癌中的表达情况进行统计,比较STAT3 基因多态性在慢性宫颈炎、宫颈上皮内瘤变及宫颈癌基因中表达情况。
1.4 统计学方法
采用SPSS 18.0 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,两组间比较采用t 检验;计数资料采用率表示,组间比较采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 慢性宫颈炎、宫颈上皮内瘤变及宫颈癌患者E6、STAT3 蛋白表达情况的比较
宫颈癌患者的E6 蛋白阳性表达率(76.47%)高于慢性宫颈炎(2.50%)、宫颈上皮内瘤变(48.14%),STAT3 蛋白阳性表达率(82.35%)高于宫颈上皮内瘤变(44.44%)、慢性宫颈炎(5.00%),差异有统计学意义(P<0.05);宫颈上皮内瘤变患者的E6 及STAT3 蛋白阳性表达率均高于慢性宫颈炎,差异有统计学意义(P<0.05)(表1)。
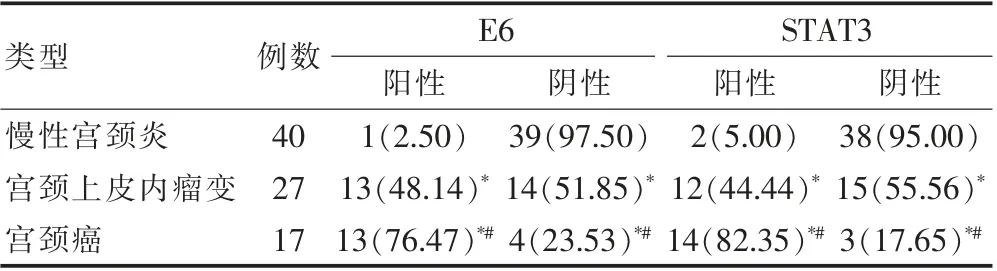
表1 慢性宫颈炎、宫颈上皮内瘤变及宫颈癌患者E6、STAT3 蛋白表达情况的比较[n(%)]
2.2 慢性宫颈炎、宫颈上皮内瘤变及宫颈癌患者STAT3基因多态性表达情况的比较
G/G 型占比中,宫颈癌(5.88%)、宫颈上皮内瘤变(59.26%)低于慢性宫颈炎(92.50%),宫颈癌低于宫颈上皮内瘤变,差异有统计学意义(P<0.05);C/C 型占比中,宫颈癌(82.35%)、宫颈上皮内瘤变(25.93%)高于慢性宫颈炎(2.50%),宫颈癌高于宫颈上皮内瘤变,差异有统计学意义(P<0.05);慢性宫颈炎(5.00%)、宫颈上皮内瘤变(14.81%)、宫颈癌(11.76%)的G/C 型占比比较,差异无统计学意义(P>0.05)(表2)。

表2 慢性宫颈炎、宫颈上皮内瘤变及宫颈癌患者STAT3 基因多态性表达情况的比较[n(%)]
2.3 典型案例分析
健康体检者PCR-反向点杂交法下HPV16 E6 蛋白基因测定阴性表达对照见图1;慢性宫颈炎患者,45 岁,PCR-反向点杂交法下HPV16 E6 蛋白基因在慢性宫颈炎患者中的表达见图2;宫颈上皮内瘤变患者,44 岁,PCR-反向点杂交法下HPV16 E6 蛋白基因在宫颈上皮内瘤变患者中的表达见图3;宫颈癌患者,42 岁,PCR-反向点杂交法下HPV16 E6 蛋白基因在宫颈癌中的表达见图4。
3 讨论
妇科常见一类恶性肿瘤为宫颈癌,数据显示每年新发患病人数达到50 万,占所有妇科癌症的10.00%,总计发病率为所有肿瘤的5.00%,仅次于乳腺癌,在发病地区统计结果上,85.00%以发展中国家为主,占据所有病例的80.00%[5]。据统计,全球宫颈癌发病死亡人数统计数据为27 万例,发展中国家占4/5。对国内宫颈癌发病病例统计显示,我国占据全世界总发病人数1/3,且每年以2%~3%速度增长,疾病发病率呈现年轻化趋势[6]。

图1 HPV16 E6 表达阴性对照(免疫组化,100×)
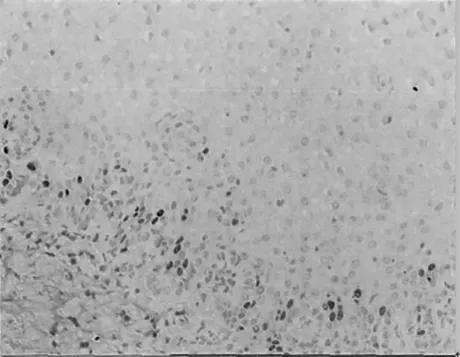
图2 HPV16 E6 在慢性宫颈炎中的表达(免疫组化,100×)
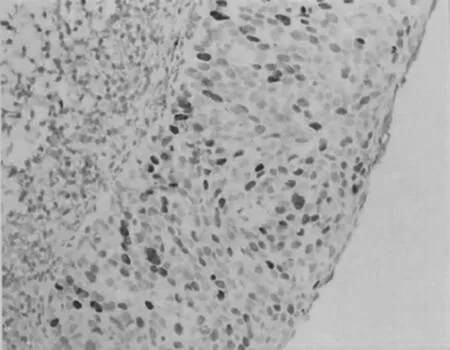
图3 HPV16 E6 在宫颈上皮内瘤变中的表达(免疫组化,100×)

图4 HPV16 E6 在宫颈癌中的表达(免疫组化,100×)
相关研究证实[7],绝大多数宫颈上皮不典型增生、宫颈癌患者中,经检测存在HPV 感染。99.7%宫颈癌标本中可检测出HPV-DNA。HPV 感染与宫颈上皮内瘤变及宫颈癌恶性病变有显著联系。因此,HPV 感染可作为宫颈癌病变重要前提。随着HPV 感染人群数量增多,宫颈癌发病人群数量相对提升,但HPV 感染严重病变程度作为宫颈癌发病重要前提,其他外界因素同样占据重要地位,如饮食、卫生习惯等,表明疾病形成是多种致癌因素长期共同作用的结果[8]。STAT 作为介导细胞信号转导的转录因子,是JAK-STAT 信号转导途径重要环节,转导始于细胞表面受体,当成分与特异性DNA 启动子序列结合,信号转至细胞核,并调控基因表达,参与细胞增殖、分化、凋亡及血管形成过程,在肿瘤发生中起着重要作用[9-10]。STAT3 位于11 号染色体,并被多种细胞因子激活,功能复杂。正常生理状态下,STAT3 信号转导途径在多种生理过程中发挥重要作用,如胚胎发育、器官形成、先天及后天免疫调节。同样,当机体感染多种致癌蛋白后,STAT3 被激活,如V-Src、V-Fps、V-Erk 等,上调凋亡抑制基因Bcl-XL、Mcl-1 及细胞周期调节基因cyclinDl抑制细胞凋亡,激活血管内皮生长因子启动子,可诱导肿瘤血管生成。STAT3 组成性活化能阻断凋亡细胞恶化转化,能促进肿瘤细胞增殖、血管形成,阻断STAT3表达对肿瘤的治疗具有巨大的潜在价值。
本研究检测了HPV16 E6 及STAT3 蛋白、STAT3基因多态性的表达情况,结果显示,宫颈癌患者的STAT3 蛋白阳性表达率(82.35%)高于宫颈上皮内瘤变(44.44%)、慢性宫颈炎(5.00%),差异有统计学意义(P<0.05)。有研究证实[11],STAT3 的组成性活化能促进细胞的恶性转化并阻断调亡,促进肿瘤细胞的增殖,血管形成,在人类子宫内膜癌及宫颈癌中处于活性状态,当抑制STAT3 组成型激活可能是干预这两类妇科疾病有效靶点。鉴于STAT3 的致癌作用,本研究将其与宫颈癌密切相关的HPV16 E6 蛋白相结合,分析二者在不同程度宫颈病变组织中的表达。有研究发现[12],STAT3 在宫颈癌表达水平与癌前病变水平呈现显著差异,随着宫颈病变程度加重,STAT3 表达阳性率相应升高,与本研究得出的论点一致。同时还有研究发现[13],HPV16 E6 蛋白及STAT3 在宫颈癌中表达具有一定相关性。因此,恶性肿瘤转化中,HPV16 与STAT3 之间存在某种相互关系。甚至有相关研究[14]指出,恶性组织切片中,HPV DNA 整合增加编码E6、E7 癌蛋白的mRNA 的稳定性,导致E6、E7癌蛋白表达增强,对细胞与信号转导因子造成影响。STAT3 作为细胞信号转导的转录因子,与HPV E6 与之间必然存在着某种关系,但其与STAT3 在宿主宫颈细胞恶性转化过程中的相互作用机制仍需深入探究。基因多态性是目前研究热点,当一个基因多态性发生改变时可引起其他基因型发生相应改变,进而引发相关疾病,基因多态性可作为疾病诊断依据及预后判断重要指标。STAT3 基因多态性分包括G/G 型、G/C 型、C/C 型,本研究进一步对STAT3 基因多态性进行分析比较,结果显示,宫颈癌、宫颈上皮内瘤变的G/G 型占比(5.88%、59.26%)低于慢性宫颈炎(92.50%),差异有统计学意义(P<0.05);而慢性宫颈炎、宫颈上皮内瘤变和宫颈癌的C/C 型占比分别为2.50%、25.93%、82.35%,比较差异有统计学意义(P<0.05),因此,HPV 感染风险上升,宫颈癌发生风险上升,C/C 基因占比伴随疾病程度增加,则整体患宫颈癌机率增高。Zhou 等[15]研究指出,随着宫颈病变程度加重,患者STAT3 基因C/C 型显著增高,G/G 型占比降低,提示宫颈癌发生与STAT3 联系紧密,C/C 基因型与HPV 感染风险上呈现正比关系。STAT3 基因突变可增加HPV 感染风险以及宫颈癌患病风险,其发病机制往往与HPV 感染后激活STAT3 信号通路,介导E6、E7 致癌蛋白通路相关,致癌蛋白经多种途径,促进细胞增殖、恶化及血管形成宫颈癌[16]。宫颈癌产生为多种因素共同影响结果,此时STAT3 基因突变,增加HPV16 感染风险及宫颈癌风险,提示STAT3 在宫颈癌发生、病情发展中起着重要作用,可作为临床诊断重要指标。
综上所述,STAT3 与HPV16 所致宫颈癌发生联系紧密,提示STAT3 和HPV16 在宫颈病变发生和发展过程中发挥重要作用。
