牡丹试管苗生根过程中内源IAA及相关酶活性的变化
2021-03-09尚文倩何松林董娜琳
尚文倩,王 政,何松林,2,贺 丹,董娜琳,郭 英
(1 河南农业大学 林学院,河南 郑州450002;2 河南科技学院 园艺园林学院,河南 新乡 453003;3 碧源建工有限公司,河南 郑州450000)
牡丹(PaeoniasuffruticosaAndr.)为落叶亚灌木,又名木芍药、富贵花等,属芍药科芍药属植物,是我国的传统名花,具有较高的观赏价值和药用价值[1]。牡丹品种繁多,其花姿雍容端庄、花色鲜艳,有富贵吉祥和繁荣昌盛的寓意,被封为我国的国花。牡丹繁殖多以分株和嫁接为主,但其繁殖时间较长且繁殖率低,使牡丹种苗工厂化生产受到很大制约[2]。组织培养具有繁殖速度快、系数高、周期短、可保持母株优良性状等优点,近年来广泛应用于植物的快速繁殖中。国内对牡丹组织培养的研究始于1982年[3],但牡丹试管苗诱导存在不定根诱导难度增大[4]、生根率低、不定根质量较差[5]和移栽成活率低[6]等问题,严重影响牡丹的快速繁殖。
在植物根系发生的不同阶段,其自身通过调控相关酶活性及内源激素浓度、比例的变化来影响根系发育,如过氧化物酶(POD)、多酚氧化酶(PPO)和吲哚乙酸氧化酶(IAAO)等酶类及内源激素,均与植物不定根的发生密切相关[7-8]。其中植物生长素吲哚乙酸(IAA)作为促进不定根发生的主要激素,其在植物体内分布及作用的部位,对于研究根系发生具有重要意义。免疫荧光技术利用抗体抗原特异性结合,揭示激素在植物组织的分布和作用位点,从而为其在植物体内的作用机理研究提供依据。国内外学者已通过此技术研究了IAA在不同组织的分布对百合发芽分化[9]、葡萄叶片高温胁迫[10]和拟南芥下胚轴不定根生长[11]的影响。近年来,有关牡丹酶活性和内源激素的研究主要集中在种子休眠和萌发[12]、芽休眠[13]、开花[14]、体胚发生[15]等方面,而关于试管苗生根方面的报道较少。本试验拟通过研究牡丹试管苗生根过程中茎基部内源IAA组织分布及相关内源激素和酶活性的变化,以期为牡丹等难生根植物的发根机理研究提供一定的理论依据。
1 材料与方法
1.1 牡丹试管苗诱导及生根培养
选取5~8年生的牡丹品种‘凤丹白’未萌动鳞芽为外植体,2月取材,消毒后接种于MS+WPM(Ca2+)+6-苄基嘌呤(6-BA)0.3 mg/L+3-吲哚丁酸(IBA)0.5 mg/L+聚乙烯吡咯烷酮(PVP)1 g/L+琼脂7 g/L+蔗糖30 g/L (pH=5.8)的固体培养基上。培养条件为:光强40 μmol/(m2·s),温度(23±2) ℃,光照时间12 h/d,诱导40 d即可得到供试试管苗。将诱导后的试管苗接种于MS+WPM(Ca2+)+6-BA 0.3 mg/L+萘乙酸(NAA)0.5 mg/L+PVP 1 g/L+抗坏血酸(Vc)50 mg/L+水解乳蛋白(LH)0.5 g/L+琼脂7 g/L+蔗糖30 g/L (pH=5.8)的培养基上增殖培养50 d,选取生长一致的试管苗作为供试材料。
将增殖后的试管苗转入含有WPM+WPM(Ca2+)+PVP 1 g/L+糖 30 g/L+植物凝胶2 g/L (pH=5.8)的培养基中,并分别添加质量浓度为1,2,3,4 mg/L的IAA,以不添加IAA的培养基为对照,每个处理25株苗,培养条件同1.1节,40 d后统计生根指标。
1.2 生根指标的测算
采用游标卡尺测量每株生根试管苗的最大根长,并统计每个处理的生根株数,然后计算其生根率、平均根数、平均最大根长和生根指数,具体计算公式为:
生根率=生根株数/培养株数×100%;
平均根数=生根总数/生根株数;
平均最大根长=生根苗最大根长总和/生根株数;
生根指数=平均最大根长×平均根数×生根率。
1.3 酶活性的测定
采用1.1节中筛选的最适培养基进行生根培养,并在接种后0,1,2,3,4,5,6,10,12,15,20和25 d从瓶中取出试管苗,在4 ℃条件下用蒸馏水反复冲洗茎基部,并用滤纸吸干,取茎基部0.2 g,用于测定相关酶活性,重复3次,以不加IAA的培养基培养的试管苗为对照。POD活性参照愈创木酚法[16]测定,PPO活性参照邻苯二酚法[17]测定,IAAO活性参照张志良[18]的方法测定。
1.4 内源激素IAA含量的测定
在对最适培养基培养的牡丹试管苗进行生根期间细胞学观察的同时,另取茎基部0.5 g(重复3次),用蒸馏水反复冲洗后用滤纸吸干,液氮迅速冷冻后,置于-80 ℃保存,以不添加IAA的培养基培养的牡丹试管苗为空白对照。参考Gou等[19]的方法进行内源激素提取,采用超高效液相串联质谱法(UHPLC-MS)进行内源IAA含量的测定,观察其含量变化与荧光强度的变化是否一致。
1.5 牡丹试管苗生根期间茎基部的细胞学观察及IAA的免疫学定位
采用最适生根培养基培育的牡丹试管苗进行生根期间茎基部的细胞学观察,并采用免疫荧光定位观察生根期间IAA在牡丹试管苗茎基部的分布位置。对生根培养的试管苗,在接种后0,3,5,10,15,20和25 d取其茎基部,用蒸馏水反复冲洗后用滤纸吸干,先将其放入固定液(0.01 mol/L磷酸缓冲液,pH=7.4,内含2% EDC·HCl)内进行固定,抽真空后在室温下放置1 h,然后取出用磷酸盐冲洗,转入含有4%多聚甲醛和2.5%戊二醛的磷酸缓冲液中,4 ℃再次固定12 h,最后参考杨捷频[20]的方法进行石蜡包埋,免疫荧光切片参考张炜等[21]的方法。
1.6 数据分析
数据统计采用SPSS 19.0和Excel 2016进行处理,所有数据均采用邓肯氏新复极差法(SSR法)检测其差异显著性,显著性水平P<0.05。
2 结果与分析
2.1 不同质量浓度IAA对牡丹试管苗生根的影响
不同质量浓度IAA对牡丹试管苗生根的影响见表1。

表1 不同质量浓度IAA对牡丹试管苗生根的影响Table 1 Effects of IAA at different concentrations on rooting of tree peony in vitro
由表1可知,随着IAA质量浓度的升高,牡丹试管苗的生根率先升高后降低,在IAA质量浓度为3 mg/L时生根率达到最高(52.00%),且与其他处理均差异显著;平均最大根长则出现在IAA 2 mg/L的处理,达到14.09 mm,且与对照差异显著;平均根数在各处理间无显著差异;生根指数在IAA 3 mg/L时最高,表明在培养基中添加3 mg/L IAA最利于牡丹试管苗生根,故后续试验皆采用加入3 mg/L IAA的生根培养基中培育的牡丹试管苗。
图1为生根培养35 d时,加入不同质量浓度IAA培育的牡丹试管苗生根情况。

A.生根培养0 d;B-F.生根培养35 d,IAA质量浓度依次为0,1,2,3,4 mg/LA.Rooting culture on day 0;B-F.Rooting culture on day 35 with concentrations of 0,1,2,3 and 4 mg/L图1 不同质量浓度IAA处理的牡丹试管苗生根情况Fig.1 Rooting of tree peony in vitro with different IAA concentrations
2.2 牡丹试管苗生根期间相关酶活性的变化
2.2.1 POD活性 牡丹试管苗生根过程中POD活性的变化见图2。
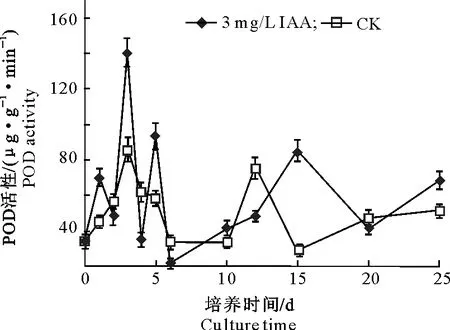
图2 牡丹试管苗生根过程中POD活性的变化Fig.2 Changes of POD activities during rooting of tree peony in vitro
由图2可知,牡丹试管苗在生根期间的POD活性始终处于上下波动趋势,其中3 mg/L IAA处理的试管苗在培养3 d时POD活性达到峰值,为140.16 μg/(g·min);培养6 d时活性达到最低值,为21.67 μg/(g·min);生根期间POD活性平均值为63.04 μg/(g·min)。对照(CK)处理POD活性也在培养3 d达到峰值,为85.45 μg/(g·min),但显著低于3 mg/L IAA处理;培养15 d时POD活性达到最低值,为28.33 μg/(g·min);生根期间POD活性平均值为52.33 μg/(g·min),显著低于3 mg/L IAA处理。说明添加IAA能促进牡丹试管苗根原基诱导期POD活性的升高,从而有助于不定根的形成。
2.2.2 PPO活性 由图3可知,3 mg/L IAA处理的牡丹试管苗PPO活性在培养0~3 d呈上下波动趋势,培养3 d时PPO活性达到峰值,为47.50 μg/(g·min);培养25 d时PPO活性达到最低值,为21.25 μg/(g·min);生根期间PPO活性平均值为32.92 μg/(g·min)。对照处理(CK)则在培养0~2 d PPO活性变化趋势与3 mg/L IAA处理一致,但活性始终较低,培养3 d时PPO活性达到最低值,为20.90 μg/(g·min);培养6 d时 PPO活性达到峰值,为44.17 μg/(g·min);生根期间PPO活性平均值为28.75 μg/(g·min),显著低于3 mg/L IAA处理。说明添加IAA能促进牡丹试管苗根原基诱导期PPO活性的升高,从而有助于不定根的形成。

图3 牡丹试管苗生根过程中PPO活性的变化 图4 牡丹试管苗生根过程中IAAO活性的变化Fig.3 Changes of PPO activities during rooting of tree peony in vitro Fig.4 Changes of IAAO activities during rooting of tree peony in vitro
2.2.3 IAAO活性 由图4可知,3 mg/L IAA处理的牡丹试管苗在培养6 d IAAO活性达到最低值,为59.92 μg/(g·h),其次是培养4 d,IAAO活性为60.69 μg/(g·h);培养25 d IAAO活性达到峰值,为100.03 μg/(g·h);生根期间IAAO活性平均值为73.87 μg/(g·h)。对照处理(CK)牡丹试管苗在生根培养2 d时IAAO活性达到最低值,为57.25 μg/(g·h),其次是培养1 d,IAAO活性为63.85 μg/(g·h);培养20 d时IAAO活性达到峰值,为96.17 μg/(g·h);生根期间IAA活性平均值为74.14 μg/(g·h)。说明添加IAA后,牡丹试管苗在根原基诱导期IAAO活性处于较低水平,有助于不定根的发生。
2.3 牡丹试管苗生根期间内源激素IAA的变化
牡丹试管苗生根期间茎基部内源IAA含量的变化见图5。

图柱上标不同字母表示处理间差异显著(P<0.05)Different letters show significant difference between treatments at P<0.05图5 牡丹试管苗生根期间茎基部内源IAA含量的变化Fig.5 Changes of endogenous IAA content at the base of stem during rooting of tree peony in vitro
由图5可知,生根培养基中加入3 mg/L IAA的处理,在生根诱导0 d时,牡丹试管苗茎基部IAA含量较低,之后其含量持续升高,且在培养5 d达到最高,之后呈下降趋势,在培养25 d IAA含量最低。对照处理(CK)牡丹试管苗茎基部IAA含量的整体变化趋势与3 mg/L IAA处理基本一致,但在培养3,5和10 d时,其内源IAA含量显著低于3 mg/L IAA处理,说明生根培养基中添加IAA后,牡丹试管在根原基形成期内源IAA含量明显升高。
2.4 牡丹试管苗生根期间茎基部细胞学观察及IAA的免疫荧光定位
由图6可知,牡丹茎基部横切面从外到内依次为表皮、皮层和维管束。在牡丹试管苗转入生根培养0 d时,茎基部细胞排列疏松整齐,未见潜在根原基的存在(图6-A);培养3 d时在维管束周围和皮层薄壁细胞周围有密集的细胞团形成,开始出现根原基,根原基的发生方式有2种:愈伤组织(图6-B)和维管束(图6-C);培养5 d时根原基明显,且开始向皮层生长(图6-D);培养10~15 d根原基持续伸长(图6-E,F),20 d逐渐延伸至表皮(图6-G),25 d形成完整的根(图6-H)。由荧光强度可知,在生根培养0 d时牡丹试管苗茎基部中IAA以维管束分布为主(图6-a);在培养3 d时,荧光主要聚集于根原基发生的部位,在表皮也有较弱的荧光,仍以维管束分布为主(图6-b,c);培养5 d时荧光信号整体增强,根原基荧光信号明显,且皮层也开始出现大量荧光信号(图6-d);在培养10~15 d时荧光逐渐变弱,且在根原基向皮层延伸的根尖周围大量分布,同时表皮的荧光信号增强(图6-e,f);培养20 d时荧光信号继续减弱,皮层中基本无荧光信号(图6-g);培养25 d时不定根上存在较强的荧光信号(图6-h)。
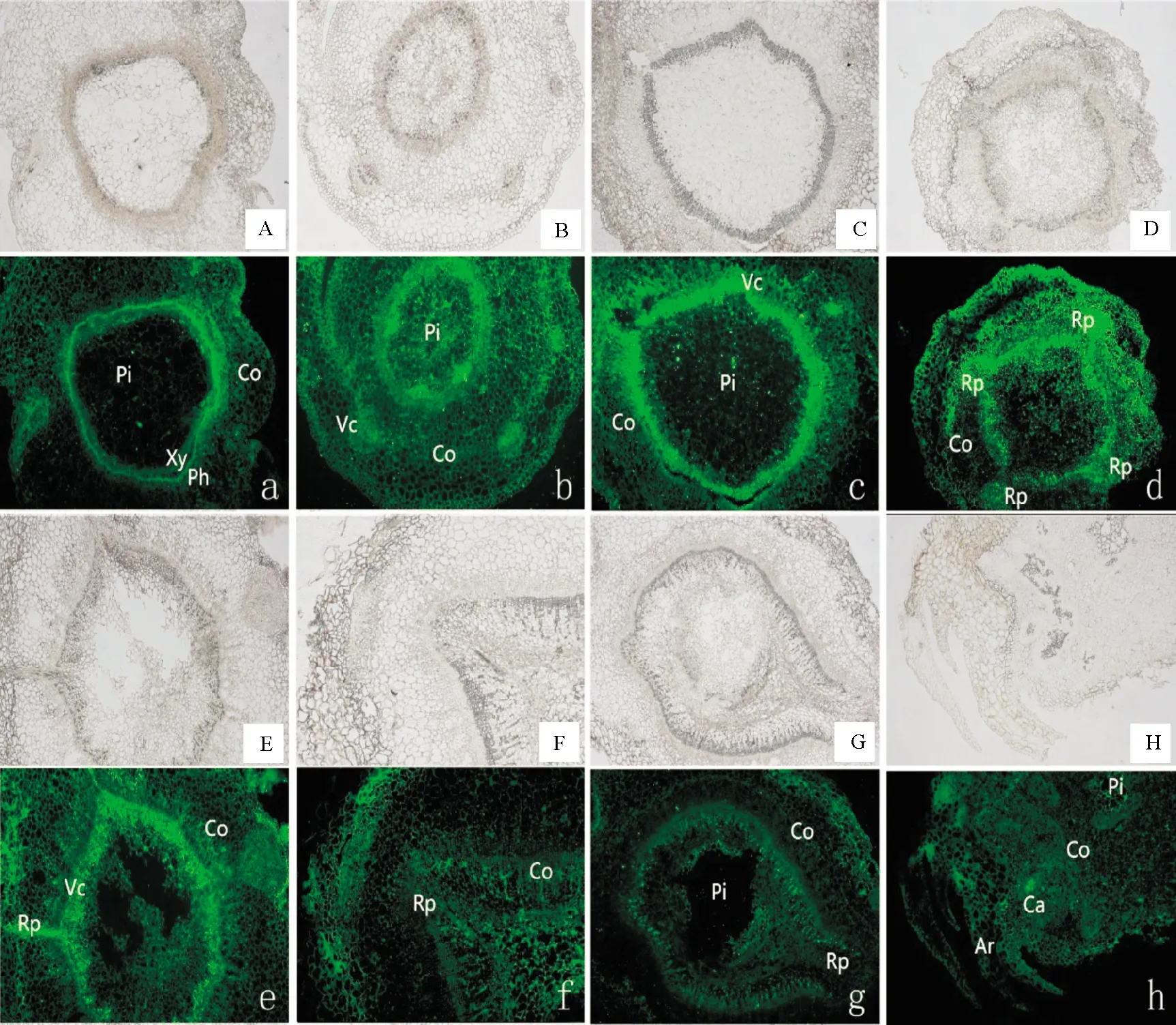
A-H.牡丹试管苗生根培养期间的明场照片;A.0 d;B,C.3 d;D.5 d;E.10 d;F.15 d;G.20 d;H.25 d;a-h.为与A-H对应的荧光照片;Co.皮层;Vc.维管形成层;Ph.韧皮部;Xy.木质部;Pi.髓;Rp.根原基;Ca.愈伤组织;Ar.不定根A-H were are field maps during rooting period;A.0 d;B,C.3 d;D.5 d;E.10 d;F.15 d;G.20 d;H.25 d;a-h are fluorescent images of A-H;Co.Cortex;Vc.Vascular cambium;Ph.Phloem;Xy.Xylem;Pi.Pith;Rp.Root primordium;Ca.Callus;Ar.Adventitious roots图6 牡丹试管苗生根期间茎基部的IAA免疫荧光定位(40×)Fig.6 IAA immunofluorescence localization of stem base during rooting of tree peony in vitro (40×)
3 讨 论
植物不定根形成的主要过程是薄壁细胞脱分化形成潜在的发根点后,经过细胞分裂和形成层增大,最后形成根原基[8]。通过细胞学观察发现,牡丹试管苗生根培养3~5 d为根原基诱导的关键时期,茎基部POD活性在培养3 d时达到峰值,表明POD活性升高可促进根原基的诱导,这与大部分研究认为POD活性升高可促进生根的结果[22-23]一致。牡丹试管苗茎基部PPO活性在生根培养3 d时达到峰值,且添加3 mg/L IAA的处理在生根关键期(3~5 d)PPO活性始终高于对照,表明高活性的PPO可促进根原基的诱导,这可能是添加IAA的处理在PPO作用下促进了IAA与酚类物质的结合,形成了进一步促进生根的辅助因子[24]。生长素促进生根的主要原因与形成层诱导的第1次细胞分裂有关,生长素含量高峰与根原基出现在同一时期[25]。本研究中,牡丹试管苗培养3 d时茎基部的IAA含量大幅上升,5 d时达到峰值,且在培养3~4 d时IAAO活性处于下降趋势,这有利于茎基部IAA的积累,表明IAA含量高可促进细胞分化从而形成根原基。生根培养5 d后根原基开始逐渐伸长,最终突破表皮,此阶段中茎基部的IAA含量显著低于3~5 d,表明茎基部低含量的IAA有利于根的伸长生长,这与于雪飞等[26]、欧阳芳群等[27]的研究结果一致。
在探究IAA在植物体内的作用机理时,首先必须明确其在植物器官的作用位点和分布特征。免疫荧光定位技术能揭示内源IAA的分布位置,目前已有部分学者进行了这方面的研究,如Dinis等[10]通过免疫荧光技术,对葡萄叶片中的IAA和ABA进行了原位分析;de Almeida等[28]对桉树组培苗茎基部进行免疫荧光定位后发现,IAA在根原基的积累促进了不定根的形成,且易生根的桉树中IAA含量是难生根桉树中的2倍。王清民[29]研究发现,核桃子叶在诱导生根前IAA主要分布在维管组织和未成熟的导管细胞中,根原基形成期维管组织中IAA分布逐渐减少,而根原基中IAA荧光信号变强,不定根伸长期根尖生长点的IAA最多。本研究中,在牡丹试管苗生根诱导开始前(0 d),IAA主要分布在维管束周围;在根原基诱导期,茎基部IAA的荧光信号逐步变强,且主要分布于维管束的根原基周围,根原基周围的皮层中也有IAA的分布;之后在维管束中荧光信号逐渐变弱,但IAA在根原基向皮层延伸的根尖周围大量分布,同时表皮的荧光信号增强;当不定根突破表皮后,IAA信号主要聚集于根尖。上述免疫荧光分析表明,IAA作用于牡丹试管苗根系发生时,首先在维管束周围大量分布,刺激根原基的形成;根原基形成后逐步向皮层、根尖形成部位以及皮层分布,促进根的伸长,且在诱导期荧光信号最强。研究表明,核桃组培苗在根系诱导中不定根形成前期,内源IAA含量在短时间内急速升高,但对IAA的作用位点并未说明[30]。本研究表明,牡丹试管苗在根系发生诱导期,茎基部IAA信号强烈,且发现牡丹不定根发生起源于微管形成层和皮层愈伤组织,此时微管束和皮层中有根原基出现时,IAA也大量聚集于此,这与de Almeida等[28]和王清民[29]的研究结果一致,表明IAA在根原基的积累与不定根发生密切相关。
4 结 论
牡丹试管苗在生根培养3 d时根原基开始出现,培养5 d时根原基基本形成,此时添加外源IAA的生根培养基培育的牡丹试管苗,其POD和PPO活性呈升高趋势,IAAO活性呈下降趋势,这有助于根原基的发生;在根原基发生期间,内源 IAA主要分布于根原基形成的位置,且含量呈升高趋势,说明IAA在根原基的积累与牡丹试管苗不定根的发生密切相关。
