环氧化物酶抑制剂NS-398联合奥沙利铂对宫颈癌HeLa细胞生长抑制及诱导凋亡作用的研究
2021-03-08董尚林
王 静 金 燕 董尚林 武 欣
1.河北北方学院附属第一医院妇产科,河北张家口 075000;2.河北北方学院生命科学研究中心,河北张家口 075000;3.河北北方学院附属第一医院,河北张家口 075000;4.河北北方学院病理教研室,河北张家口 075000
宫颈癌是女性生殖系统常见的恶性肿瘤之一,其发病率居女性恶性肿瘤的第二位[1],仅次于乳腺癌。近年来,宫颈癌的发病率逐年升高,并且发病逐渐低龄化,严重影响广大女性的生活质量,威胁女性的健康水平[2-4]。目前在宫颈癌的临床治疗中,化疗仍然是术后辅助治疗的重要手段[5]。传统的化疗药物大多都对机体有神经毒性、骨髓抑制等比较严重的毒副作用,严重影响患者的生活质量。所以,寻找一种化疗效果好同时对机体毒副作用小的理想化疗药物是目前抗肿瘤基础和临床研究的热点。奥沙利铂(L-OHP)为第三代铂类药物,对多种肿瘤有效[6-8],并且与传统化疗药物比较,毒副作用小[9]。NS-398 为一种环氧化酶-2(cyclooxygenase-2,COX-2)选择性抑制剂,可抑制结肠癌、胃癌、胆管癌等多种肿瘤细胞生长[10-11]。本研究将NS-398 与L-OHP 联合作用于宫颈癌HeLa 细胞株,观察二者联用对HeLa 细胞的抑制作用及诱导凋亡作用,以期为临床宫颈癌的治疗提供理论基础。
1 材料与方法
1.1 主要材料与试剂
人宫颈癌HeLa 细胞株由河北北方学院生命科学研究中心细胞室保存。RPMI 1640 培养基(美国Gibco公司,批号:1663936);胎牛血清(Excell Bio 公司,批号:11H158);DNA ladder 试剂盒(碧云天生物技术研究所,批号:C0007);Annexin V-FITC/PI 细胞凋亡检测试剂盒(BD 公司,批号:556547);罗丹明染色试剂盒(凯基生物公司,批号:KGA217);CCK-8 试剂(日本同仁化学研究所,批号:DC663);NS-398(美国Cayman 公司,批号:70590);L-OHP(深圳海王药业有限公司,批号:2015060)。流式细胞仪(型号:FACS Aria,美国BD 公司);多功能显微镜(型号:90i,日本尼康公司)。
1.2 细胞培养
HeLa 细胞株使用含10%胎牛血清、100 U/mL 青霉素、100 μg/mL 的RPMI 1640 培养液常规培养。培养条件为37℃、5%CO2、饱和水蒸气。细胞铺满单层后,采用含EDTA 的胰蛋白酶消化传代。实验细胞为对数生长期细胞。
1.3 CCK-8 实验
HeLa 细胞经胰蛋白酶消化后用RPMI 1640 培养液重悬,接种至96 孔板(每孔2×104个细胞),置37℃、5%CO2、饱和水蒸汽条件下继续培养至铺满单层后,分别单独加入不同浓度NS-398(0、30、60 μmol/L)或L-OHP(0.0、2.5、5.0、10.0 mg/L),联合用药实验分别加入不同浓度的NS-398(30、60 μmol/L)和LOHP(2.5、5.0、10.0 mg/L)。每组4 个重复。置培养箱中继续培养24 h,每孔分别加入10 μL CCK-8 试剂后,37℃继续培养4 h,用酶标仪在450 nm 处测定吸光度值(OD),计算抑制率(IR)。
1.4 倒置显微镜观察细胞形态变化
将HeLa 细胞接种至六孔板,待细胞铺满单层后分别加入药物,设对照组、NS-398 组(60 μmol/L)、L-OHP 组(10 mg/L)以及联合组(NS-398:60 μmol/L+L-OHP:10 mg/L)。置培养箱中继续培养24 h。用倒置显微镜下观察细胞形态。
1.5 罗丹明123 染色
实验分组同“1.4”项下,药物处理24 h 后,消化细胞,培养基重悬,调整细胞浓度至1×105个/mL 后,分别取1 mL 转移至1.5 mL 离心管中,每管分别加入10 μL 罗丹明染色工作液,混匀后放入37℃温箱中孵育20 min,离心,弃上清,PBS 洗两次,用RPMI 1640培养液重悬细胞,置37℃、5%CO2、饱和水蒸汽条件下继续培养60 min 后,各组分别取100 μL,滴加到洁净载玻片上,荧光显微镜观察。
1.6 DNA ladder
取对数生长期HeLa 细胞,按照分组加入药物处理,设对照组、NS-398 组(60 μmol/L。)、L-OHP 组(10 mg/L)以及联合组(NS-398:60 μmol/L 和L-OHP:10 mg/L)。药物作用后24 h,按照试剂盒说明书提取基因组DNA 后,行琼脂糖凝胶电泳,凝胶成像系统观察并拍照。
1.7 流式凋亡率
收集药物作用后的HeLa 细胞,实验分组同“1.4”项下,PBS 洗涤两次,计数后,每组取3×105个细胞,用100 μL Binding Buffer 重悬细胞。分别加入5 μL Annexin V 和5 μL PI,混匀后室温避光孵育20 min后,加400 μL Binding Buffer 后上机检测(激发波长Ex=488 nm;发射波长Em=530 nm)。
1.8 统计学方法
采用SPSS 17.0 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,多组间比较,采用方差分析;两两比较,采用LSD-t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 NS-398 与L-OHP 对HeLa 细胞抑制率的影响
与未加药物组比较,NS-398 单药组和L-OHP单药组抑制率明显增高,差异均有高度统计学意义(均P <0.01);联合组抑制率高于NS-398 单药组和L-OHP 单药组,差异均有高度统计学意义(均P <0.01)。见表1。
表1 NS-398 与L-OHP 对HeLa 细胞抑制率的影响(%,±s,n=4)
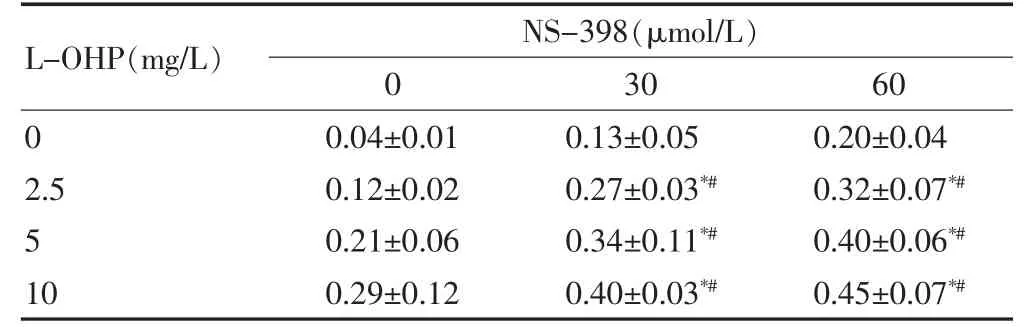
表1 NS-398 与L-OHP 对HeLa 细胞抑制率的影响(%,±s,n=4)
注:与同浓度NS-398 单独用药比较,*P <0.01;与同浓度L-OHP 单独用药比较,#P <0.01。L-OHP:奥沙利铂
2.2 倒置显微镜观察结果
对照组细胞状态良好,形态呈梭形,贴壁生长,细胞边缘清晰,胞膜完整。NS-398 组细胞体积皱缩变小变圆,胞质内出现颗粒状物质,少量细胞从瓶底脱落,漂浮于培养液中。L-OHP 组细胞失去正常形态,皱缩变小,培养液中可见死细胞。联合组培养液中可见大量死细胞和细胞碎片,仅余少量细胞贴在瓶底,且形态呈不同程度的皱缩,部分细胞破裂,细胞内容物溢出。见图1。

图1 倒置显微镜观察HeLa 细胞形态变化
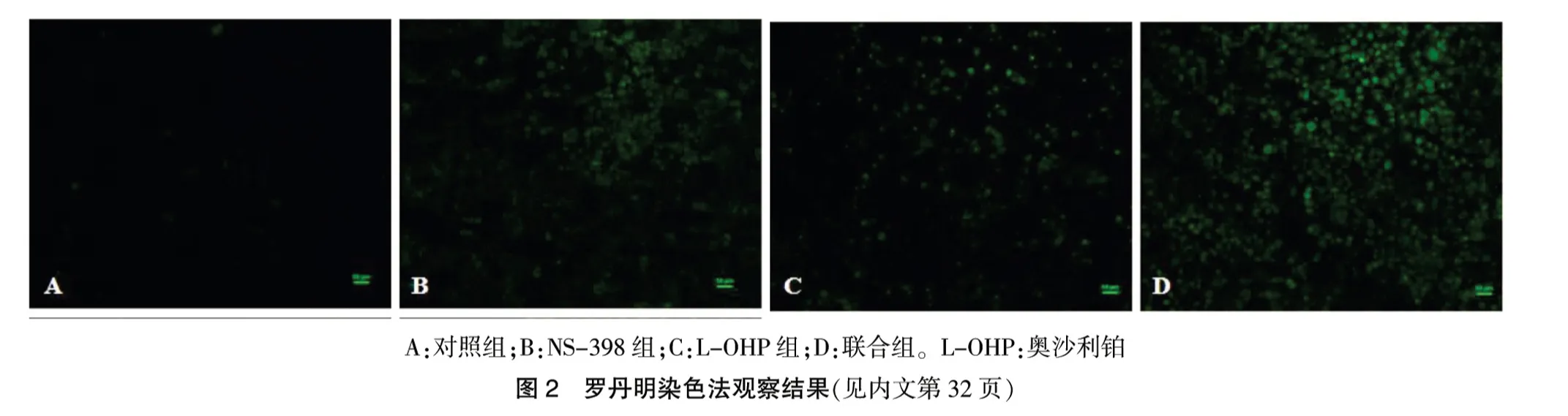
2.3 罗丹明123 染色结果
罗丹明123 染色结果显示,对照组无荧光;NS-398 组、L-OHP 组与联合组荧光强度增强,尤其以联合组最为明显。见图2(封四)。
2.4 DNA Ladder 结果
联合组有明显的梯状条带出现;NS-398 组和LOHP 组有明显的弥散现象出现;对照组即无弥散现象也无梯状条带出现。见图3。

图3 DNA 琼脂糖凝胶电泳图
2.5 流式细胞仪检测HeLa 细胞早期凋亡率改变
NS-398 组和L-OHP 组凋亡率明显高于对照组;联合组凋亡率明显高于NS-398 组、L-OHP组,差异均有高度统计学意义(均P <0.01)。见表2。
表2 流式细胞仪检测HeLa 细胞早期凋亡率改变(%,±s)
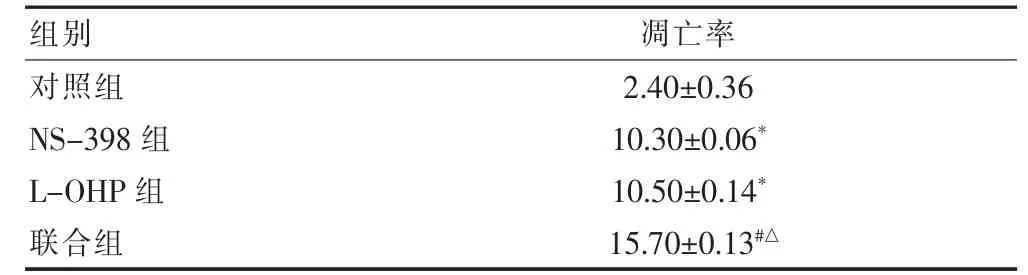
表2 流式细胞仪检测HeLa 细胞早期凋亡率改变(%,±s)
注:与对照组比较,*P <0.01;与NS-398 组比较,#P <0.01;与L-OHP组比较,△P <0.01。L-OHP:奥沙利铂
3 讨论
近年来,宫颈癌的发病率逐年上升并且呈年轻化、低龄化的趋势,已经成为亟待解决的公共卫生问题之一[12]。目前,宫颈癌的治疗仍然以手术结合放化疗为主,化疗作为一种重要的术后辅助治疗手段临床应用广泛,但是传统的化疗药物都有比较严重的毒副作用;在宫颈癌的治疗中,单用一种化疗药物难以达到令人满意的治疗效果,因此寻找高效且毒副作用小的化疗药物以及改进治疗方案是目前临床宫颈癌治疗研究中的热点。铂类药物是宫颈癌术后辅助化疗的基础用药[13-14],L-OHP 属于第三代铂类药物,与传统化疗药物比较,具有独特的优越性[15-17],如无肾毒性、毒副作用轻,对肠癌、胃癌、肺癌等多种肿瘤有效[18],具有广泛的临床应用前景,是近几年研究的热点。
COX 是一种内源性前列腺素合成过程中的限速酶,有COX-1 和COX-2 两种同工酶,其中COX-2 静息时不表达,在受到某些因素(如生长因子、细胞因子、癌基因产物、促癌剂等)刺激时才会迅速合成。COX-2 在多种肿瘤中高表达,同时在癌旁或癌周组织不表达或者低表达[19-20],提示COX-2 与肿瘤的发生发展有关。在宫颈癌有关的研究中也有人证实COX-2与宫颈癌的发生、发展和预后密切相关[21-23]。因此COX-2 可作为宫颈癌治疗的靶点之一,选择性抑制COX-2 可以预防和治疗宫颈癌。NS-398 属于非甾体抗炎药,是一种选择性的COX-2 抑制剂。研究显示[24-25],NS-398 可以抑制COX-2 高表达的肿瘤细胞生长,诱导其凋亡,而对COX-2 低表达的肿瘤细胞则无抑制作用。
如今,诱导肿瘤细胞凋亡是抗癌药物研究中的热点。细胞凋亡后会发生一系列的变化:凋亡早期,细胞膜会发生磷酯酰丝氨酸外翻;凋亡晚期,DNA 规律性断裂;凋亡过程中线粒体膜电位也会发生变化。本研究将不同浓度的NS-398 和L-OHP 及两者联合分别作用于HeLa 细胞,用CCK-8 法、罗丹明123 染色法、流式细胞仪等多种方法观察两种药物对HeLa 细胞的影响。CCK-8 结果显示,两种药物联用的抑制率高于二者单用。罗丹明123 染色结果显示,实验组HeLa细胞染色后荧光强度有不同程度的增强,尤其以联合组为著,提示各实验组均不同程度的存在线粒体膜电位的变化和细胞凋亡的发生。DNA Ladder 结果也提示联合组细胞处于凋亡早期阶段。
综上所述,NS-398 和L-OHP 均可抑制HeLa 细胞生长,诱导其凋亡,两种药物联用对HeLa 细胞的抑制作用优于二者单用,提示两种药物联用可提高抗癌效果,为指导临床化疗提供了实验基础。但是仅研究NS-398 和L-OHP 对HeLa 细胞的抑制作用及诱导凋亡作用,对其诱导凋亡具体机制及二者联用在体内对癌细胞的生物学效应未进行深入探讨,这将是下一步研究的内容。
