具有梯级释药性能的核壳型双重载药微球
2021-03-08尹微虹巨晓洁谢锐汪伟刘壮褚良银
尹微虹,巨晓洁,2,谢锐,2,汪伟,2,刘壮,2,褚良银,2
(1 四川大学化学工程学院,四川成都610065;2 四川大学高分子材料工程国家重点实验室,四川成都610065)
聚合物微球作为药物载体具有能控制药物释放速度、延长药物作用时间、减少药物不良反应、降低用药剂量和实现靶向递送等优点[1],但结构组成单一的聚合物载药微球的释药模式比较单一,通常是受外界物理[2]或化学[3]刺激让微球溶胀、坍塌、收缩或溶解实现负载药物的快速释放,或依靠微球基材本身的溶蚀过程实现缓慢释药,这在一定程度上限制了载药微球在临床上的应用。大多数疾病的临床症状复杂多样,单一药物以及单一释药模式不能达到最好的治疗效果。例如,在组织工程中的关节置换手术中,临床植入失败的主要原因是细菌感染和植入体松动[4],对此不仅需要术后在植入体部位快速释放较大剂量的抗菌药物,使局部血药浓度短时间内达到治疗水平,有效预防细菌感染[5];而且,需要后续能持续释放促成骨药物,保证植入体部位的药物浓度一直处于有效范围,促进植入体与宿主骨的整合[6]。针对类似这样的临床治疗需求,多重药物的梯级释放模式更为有效,可以根据不同的临床症状和治疗周期优化药物的种类和剂量[7-8]。目前,双药联合治疗的主要挑战是如何独立控制每种药物的释放行为,而具有核壳结构的聚合物微球可以将两种药物分别包封于同一载体的内核和壳层两个不同区域,通过内核和壳层材料的性质单独改变其所载药物的释放行为[9]。因此,研发可实现双重药物梯级释放的核壳型聚合物微球作为药物载体,具有重要的研究意义和临床应用前景。
聚乳酸-羟基乙酸共聚物(PLGA)是一种具有良好生物降解性和生物相容性的聚合物高分子,常作为药物缓释材料被广泛应用于制药、医用工程材料等领域[10-11]。聚乙烯吡咯烷酮(PVP)具有优良的水溶性、成膜性、生物降解性、化学稳定性和生物相容性[12],作为药物载体材料可以实现所载药物的快速释放[13]。因此,分别以PLGA 和PVP 作为核壳型微球的内核和壳层材料,可以实现内核与壳层中药物的速释-缓释梯级释放。
目前已经有许多基于乳液模板的技术用于制备核壳型微球,但这些方法普遍存在载药效率低、蛋白质药物易变性、工艺繁琐、耗时长等缺点[14-16]。静电喷雾技术是以静电力为驱动力,通过调节电压、进样速度和电喷溶液浓度等参数,使带电射流体加工成微/纳米结构颗粒的工艺[17],已经被广泛应用于亲/疏水性药物微载体的制备[18-19]。静电喷雾技术设备简单、操作方便,利于大规模生产;制备的载药微球不仅单分散性良好,药物包封率高[20-21],而且可直接喷涂于金属类植入物材料表面[4]应用于组织工程领域。静电喷雾技术通常可分为单轴静电喷雾法[16]和同轴静电喷雾法[22-23],利用这两种方法均能制备出载有药物的核壳型微球,但载药微球在形貌和释药性能方面是否一致还有待探究。
因此,本研究采用单轴静电喷雾和同轴静电喷雾两种方法分别制备出以PLGA 为内核基质、PVP为外壳基质的核壳型双重载药微球。其中,单轴静电喷雾法是将PLGA载药颗粒分散于溶解有另一种药物的PVP 溶液中,利用单轴静电喷雾装置制备得到核壳型双重载药微球;而同轴静电喷雾法则是分别以含药的PLGA溶液和含药的PVP溶液作为内核和壳层的电喷前体,经同轴静电喷雾装置制备得到核壳型双重载药微球。研究中,选择了能够对关节置换术后假体周围感染的早期主要致病菌——金黄色葡萄球菌起到很好杀菌作用的盐酸万古霉素(VA)[24-27]和可以诱导骨髓间充质干细胞向成骨细胞分化并促进成骨细胞增殖和分化的地塞米松(DA)[26-27]作为模型药物,分别负载于微球的壳层和内核。利用静电喷雾法制备微球时,电喷前体浓度是影响微球形貌的主要因素[17],因此本文主要考察了PVP 浓度对核壳型微球形貌结构的影响、微球制备前后各组分物理性质的变化以及微球中两种药物的梯级释药行为,并对单轴静电喷雾和同轴静电喷雾法制备出的核壳型双重载药微球作了对比研究。
1 实验部分
1.1 试剂与仪器
聚乳酸-羟基乙酸共聚物(PLGA,分子量4000~15000),赢创公司;聚乙烯吡咯烷酮(PVP,K30,分子量40000)、地塞米松(DA,纯度≥98%)、聚乙烯醇(PVA,分子量31000~50000),Sigma-Aldrich 公司。盐酸万古霉素(VA,纯度≥99%),美仑生物科技有限公司。实验所用其他试剂均为分析纯,西陇科学股份有限公司。实验用水来自Milli-Q纯水系统,电阻率为18.2MΩ·cm。
静电喷雾设备,SS-2534H 型,北京永康乐业科技发展有限公司;注射泵,LSP01-2A 型,保定兰格恒流泵有限公司;磁力搅拌器,85-1 型,上海梅颖浦仪仪器仪表制造有限公司;动态光散射纳米粒度仪(DLS),ZEN3690 型,Malvem 仪器有限公司;冷冻干燥机,FD-1C-50 型,北京博医康实验仪器有限公司;黏度计,DV2T型,美国Brookfield公司;场发射扫描电子显微镜(FESEM),JSM7500F型,日本JEOL公司;透射电镜(TEM),Tecnai G2 F20 S-TWIN 型,美国FEI 公司;数码相机,E-PL5 型,日本OLYMPUS 公司;X 射线衍射仪(XRD),EMPYREAN型,荷兰帕纳科公司;差式扫描量热分析仪(DSC),DSC214型,德国耐驰仪器制造有限公司;电子分析天平,上海良平仪器仪表有限公司;高效液相色谱仪(HPLC),UltiMate 3000 型,Thermo Scientific 公 司;纯 水 系统,Millipore Elix-10,Millipore公司。
1.2 核壳型双重载药微球的制备
(1)利用溶剂挥发法制备PLGA纳米颗粒。称取50mg PLGA 和50mg DA 溶于5mL 丙酮,将该溶液用注射器缓慢逐滴滴入到搅拌状态下的PVA 水溶液(50mL,0.2g/L)中得到混悬液(冰浴);滴加完毕后,将制得的混悬液在室温(25℃)下搅拌12h,有机溶剂充分挥发得到PLGA 纳米颗粒悬浮液。将悬浮液用去离子水透析3天(定期更换透析介质),以除去多余的PVA 以及未被包封的DA。最后,将纳米颗粒在-50℃下冻干48h 得到样品并放置于干燥柜中备用。此外,用相似的方法制备了未载药的空白PLGA纳米颗粒。
(2)利用单轴静电喷雾法制备核壳型双重载药微球。取制备好的PLGA纳米颗粒(5mg/mL)均匀分散于溶有VA(2.5mg/mL)和一定质量PVP 的乙醇-水(9∶1,体积比)混合溶液中作为电喷前体。如图1(a)所示,将电喷前体装入注射器中并固定于微量进样泵上,针头为电喷专用针头且利用鳄鱼嘴夹将高压电导线固定在喷嘴上,铝箔固定于负压装置上用于接收电喷制备的微球产物。制备过程中,固定喷射电压为9kV,微量进样泵的供液速度保持在0.4mL/h,接收器与针头之间的距离保持在15cm,温度为25℃±3℃,相对湿度保持在40%±5%,在此条件下喷嘴处形成泰勒锥,制备得到的微球产物记为SDMs。实验中还用相似方法制备了未载药的核壳型空白微球(SBMs)。
(3)利用同轴静电喷雾法制备核壳型双重载药微球。将DA(10mg/mL)和PLGA(10mg/mL)溶于丙酮中作为内核溶液,将VA(2.5mg/mL)和一定量PVP溶于乙醇-水(9∶1,体积比)混合溶液作为壳层溶液。如图1(b)所示,分别将内核溶液和壳层溶液装入相应的注射器中。制备时,固定喷射电压为10kV,内核电喷前体的供液速度为0.2mL/h,壳层电喷前体的供液速度为0.4mL/h,接收器与针头之间的距离保持在15cm,温度为25℃±3℃,相对湿度保持在40%±5%,在此条件下喷嘴处形成泰勒锥,制备得到的微球产物记为CDMs。实验中还用相似方法制备了未载药的核壳型空白微球(CBMs)。
1.3 核壳型双重载药微球的表征
利用FESEM 对PLGA 纳米颗粒的形貌进行表征,利用DLS测定了PLGA颗粒的平均粒径和粒径分布情况。
利用黏度计测定了单轴和同轴静电喷雾的电喷前体的黏度。将铝箔上单轴和同轴静电喷雾产物进行喷金处理后,利用SEM 观察形貌,并使用Image J 软件对SEM 图像中的微球直径进行测量,随机选取200个以上微球计算平均直径。制备核壳型载药微球时,直接将其喷涂在铜网上,利用TEM表征双重载药微球的核壳型结构。
利用XRD 和DSC 测定核壳型载药微球中各组分的物理形态。其中,XRD 测试条件为:Cu Kα射线,步长0.026°,范围5°~60°;DSC 测试条件为:从20℃加热升温至350,升温速率为10℃/min,氮气环境,流量为40mL/min。

图1 核壳型双重载药微球的制备装置
1.4 核壳型双重载药微球的释药行为
利 用HPLC 测 定 两 种(SDMs4 和CDMs4)核壳型载药微球中VA 和DA 的载药量和体外释药实验中的药物浓度。HPLC 参数:C18 色谱柱;甲醇-水-0.05mol/L pH=3.2 的磷酸二氢钾溶液(67∶28∶4,体积比)为流动相;检测波长236nm;柱温30℃;流速1.0mL/min;进样量20μL。实验中测得VA和DA的保留时间分别为2.5min和6.7min。
测定两种核壳型载药微球的载药量。将一定质量的微球利用丙酮-水混合溶液进行充分溶解,待溶解完全后再加入适量去离子水稀释,利用HPLC测定该稀释溶液中VA 和DA 相应的峰面积,根据相应标准曲线计算出药物浓度,再经换算得到载药微球两种药物分别负载的药量,最后利用式(1)计算载药量。

式中,LC 为核壳型微球的载药量,%;We为微球所负载的药量,mg;Wm为核壳型微球的总质量,mg。
释药行为:将一定量的核壳型双重载药微球浸泡于装有20mL PBS缓冲液(pH=7.4)的离心管中,于37℃条件下恒温振荡(100r/min)进行释药,在预定的时间点(5min、15min、30min、1h、6h、12h、24h、36h、48h、3天、4天、7天、12天、17天、22 天和28 天)将离心管于20000r/min 转速下离心后,吸取离心管中上清液1mL,同时补充1mL新鲜的PBS缓冲液,用0.1μm的微孔滤膜过滤所取上清液,用HPLC测定滤液中VA和DA的浓度,并按式(2)计算出两种药物在各时间点的累积释放百分率,从而研究其释药特性。
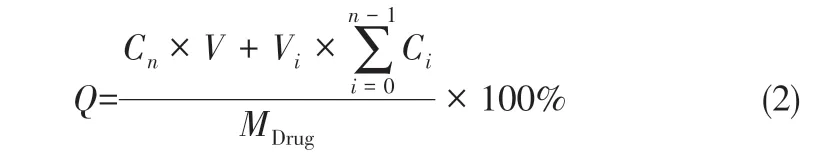
式中,Q为药物累积释放率,%;V为释放放介质PBS缓冲液体积,mL;MDrug为电喷所得微球中药物的质量,mg;n为取样并置换释放介质的次数,n≥1;Cn为第n个取样时间点所取样品的浓度,mg/mL;Vi为第i个取样时间点的取样体积(V0=0),mL;Ci为第i个取样时间点的取样浓度(C0=0),mg/mL。
2 结果与讨论
2.1 PLGA载药纳米颗粒的形貌和粒径分布

图2 PLGA纳米颗粒的SEM图和粒径分布
单轴静电喷雾制备核壳型载药微球时,需要先制备出载有DA 的PLGA 纳米颗粒。图2 是溶剂挥发法制备所得空白PLGA 纳米颗粒和负载DA 的PLGA纳米颗粒的SEM图,从图中可以看出空白纳米颗粒和载药纳米颗粒的呈现出良好的球形,粒径均一。图2(c)和图2(d)是用DLS 测得的两种纳米颗粒的粒径分布图,结果显示,空白PLGA纳米颗粒的平均粒径为169nm,多分散系数为0.053;载药PLGA 纳米颗粒的平均粒径为180nm,多分散系数为0.039,载药PLGA纳米颗粒和空白PLGA纳米颗粒的粒径相差不大。DLS 结果同样说明所制备PLGA 纳米颗粒粒径较为均一,这保证了负载药量和药物释放行为的可重复性。
2.2 PVP 溶液浓度对核壳型载药微球形貌结构的影响
实验中配制了不同PVP 浓度的电喷前体,分 别 为10g/L、20g/L、40g/L、80g/L、160g/L 和240g/L,其对应的黏度和所得电喷产物编号见表1和表2。由于单轴静电喷雾的电喷前体中含有PLGA 纳米颗粒,所以在相同PVP 浓度下,单轴电喷前体的黏度均略大于同轴电喷前体的黏度。
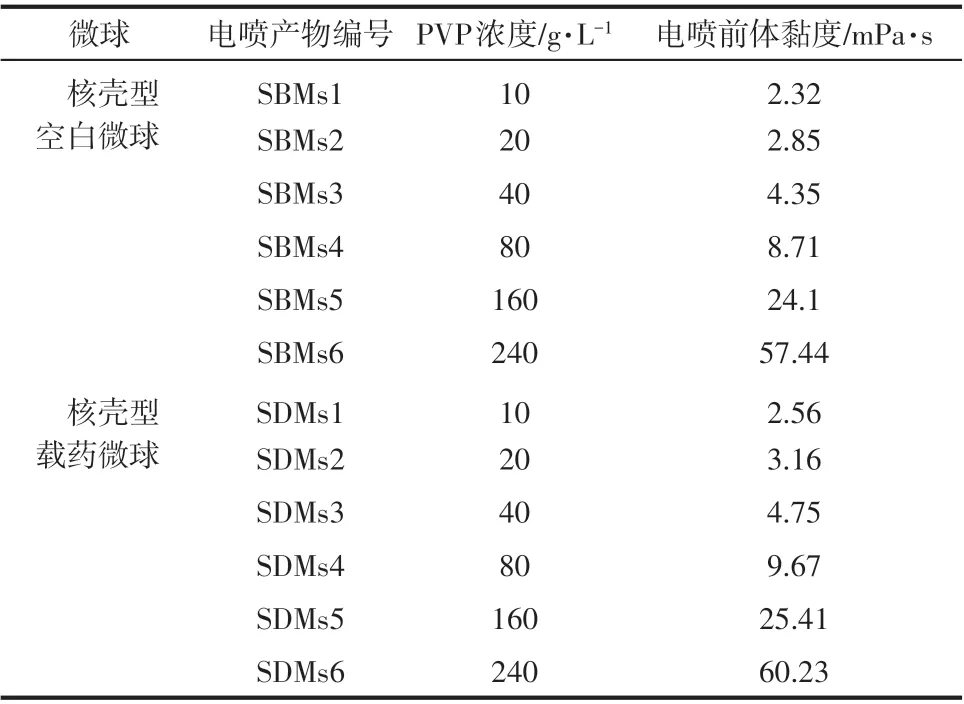
表1 单轴电喷前体参数

表2 同轴电喷前体参数
静电喷雾过程中,影响其稳定性的因素主要包括电喷前体中聚合物浓度、喷射电压、喷射距离、喷射速率、环境温度和湿度等。本文中,喷射电压和喷射距离均固定;静电喷雾设备为密闭环境,保证了环境湿度和温度的稳定;同时,使用控恒流注射泵控制进样速率,可在高压静电场中稳定可靠运行,保证了喷射速率的稳定。在此基础上,当PVP浓度低于80g/L 时,尽管可以在喷头处观察到泰勒锥,但锥体并不稳定,会出现脉冲式喷射或偶有液滴飞落,这是因为溶液黏度过低,电场力与溶液表面张力不均衡,导致喷射不稳定;当PVP 浓度在80~240g/L 时,如图3 所示,单轴电喷和同轴电喷的喷嘴处均可形成稳定的泰勒锥,小液滴呈伞状喷出,并保持连续且稳定的喷射,表明电场力和溶液表面张力平衡,制备过程稳定好。

图3 PVP浓度为80g/L时的静电喷雾

图4 单轴静电喷雾所得空白[(a)~(f)]和载药[(g)~(l)]产物的SEM图(标尺10μm)
图4 和图5 分别为不同PVP 浓度的电喷前体经单轴和同轴静电喷雾制备所得微球的SEM 图。可以发现,PVP 浓度在10~240g/L 的溶液均可电喷成型,但成型效果具有较大的差别。单轴静电喷雾过程中,当溶液浓度为10~40g/L 时,空白电喷产物和载药电喷产物中均可观察到部分颗粒呈蝌蚪状,即有明显的拖尾,这是由于电喷雾形成的泰勒锥不稳定;当溶液PVP 浓度为240g/L 时,因为黏度较大,电喷产物出现了串珠现象;而PVP 浓度为80g/L 和160g/L 所 得 的 电 喷 产 物SBMs4、SBMs5、SDMs4 和SDMs5 均呈球状,无明显的拖尾和串珠现象。类似的,同轴静电喷雾过程中,溶液浓度为10~40g/L 时也出现了拖尾现象。值得注意的是,PVP浓度为10g/L和20g/L时的载药电喷产物呈凹饼状,与相同PVP 浓度下所得空白电喷产物形貌差异较大,说明药物的存在也会影响电喷产物的形貌。当溶液PVP 浓度为160g/L 时,即可观察到同轴静电喷雾产物中出现串珠现象,而当浓度增大到240g/L时,串珠现象非常明显,部分呈丝状。因此可以看出,当溶液中PVP 浓度接近80g/L 时,单轴和同轴静电喷雾均可得到大小较为均一的球状电喷产物,即SBMs4、SDMs4、CBMs4、CDMs4,其平均 粒 径 分 别 为 0.39μm、 0.58μm、 0.55μm、0.65μm。其中,载药微球的粒径均大于空白微球,而同轴电喷微球的粒径均大于对应的单轴电喷微球,这是因为与单轴静电喷雾过程相比,同轴静电喷雾时,还有一定量的丙酮作为内核电喷前体,在温度、湿度、PVP浓度和电喷距离等条件一定的情况下,丙酮的存在使喷出液滴中液体挥发速率减慢,致使溶液中溶质凝固和高分子链之间物理缠绕的速率相应减缓,故所得微球粒径增大。
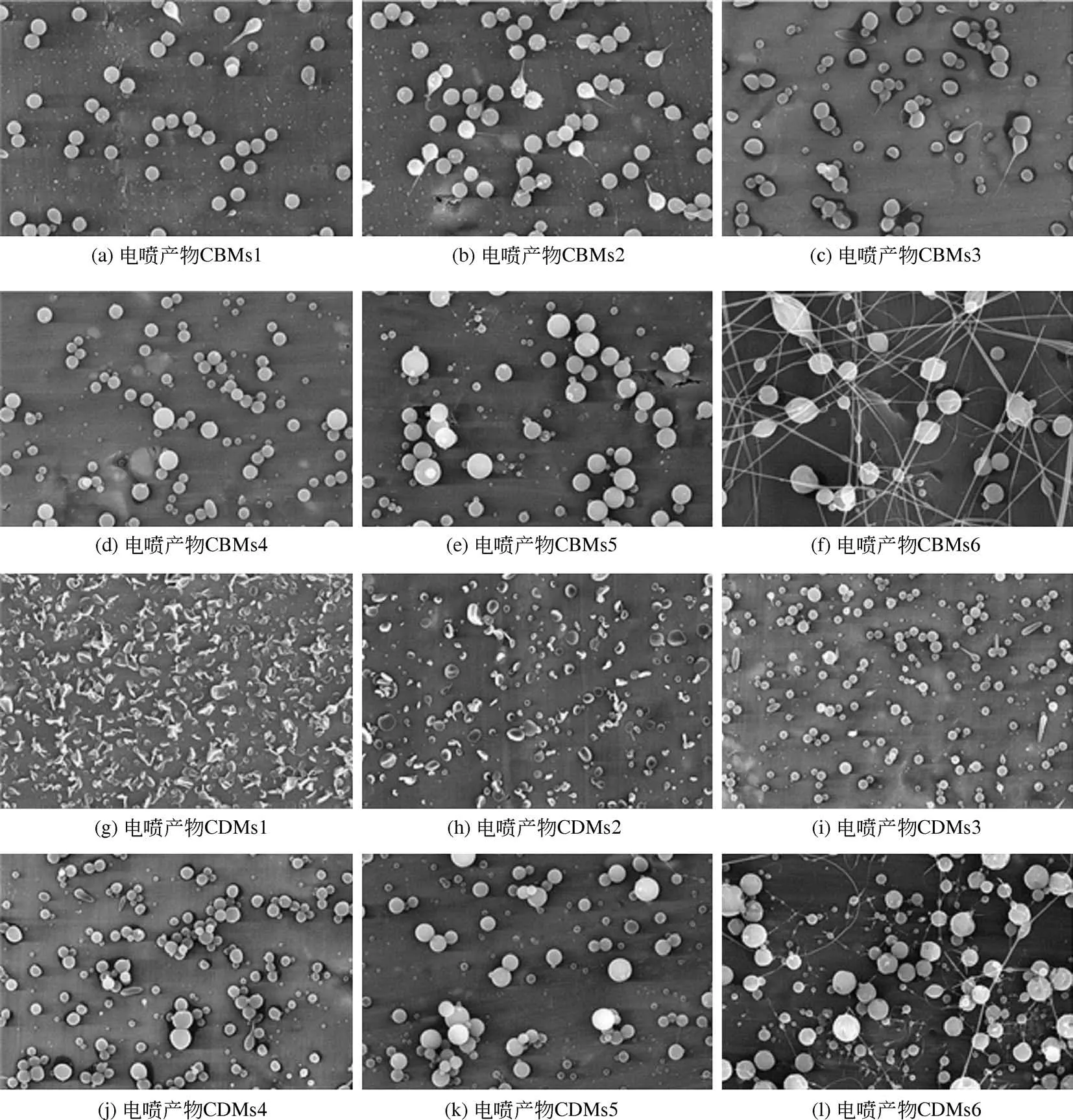
图5 同轴静电喷雾所得空白[(a)~(f)]和载药[(g)~(l)]产物的SEM图(标尺10μm)
为表征单轴和同轴静电喷雾所得微球的核壳结构,选取SDMs4 和CDMs4 这两种微球利用TEM 进行观察,如图6 所示,由于PLGA 的存在,微球内核呈深灰色,外壳呈浅灰色,内核-壳层的分界限清晰,可以看出明显的核壳结构。其中,利用单轴静电喷雾法制得核壳型微球的形成机理[16]是:由于PLGA 纳米颗粒与PVP 溶液之间具有良好的相容性,同时乙醇/水混合溶剂在PVP 相和PLGA 相中的共存进一步增强了两相之间的相容性。因此,PLGA 纳米颗粒能够良好地均匀分散于PVP 溶液中,形成稳定的混悬液。电喷雾过程中,泰勒锥和喷雾小液滴中的溶剂快速挥发使PLGA纳米颗粒和PVP溶液之间的界面张力增大,并在相分离作用下PLGA 纳米颗粒被包埋于黏稠PVP 液滴的中心,待溶剂完全挥发后则形成PLGA/PVP 核壳结构。因此,利用单轴静电喷雾法可以制备得到结构一致、粒径均匀的PLGA/PVP核壳型微球,且核壳型微球中包埋单一的PLGA纳米颗粒。同轴静电喷雾制备核壳型微球过程中,在同轴针头的引导下,核层溶液始终保持在壳层溶液的中心,喷射时,随着溶剂的挥发以及核层、壳层相分离作用的增大,PLGA和PVP 分别在核层和壳层区域固化,最后也形成了具有单一PLGA内核的核壳型微球。
2.3 核壳型载药微球中各组分的物理性质
实验中利用XRD 和DSC 确定了微球中各组分的物理性质,结果见图7。如图7(a)所示,原材料DA 的XRD 谱图中出现了明显的锐峰,说明DA 是一种具有特征衍射峰的晶体材料,而VA、PLGA和PVP 原材料的谱图中均为弥散峰,表明这几种聚合物的分子取向和排列是无序的,即无定形状态。类似的,在核壳型载药微球SDMs4 和CDMs4的光谱中也没有出现明显的峰,这意味着微球中的DA 不再以晶体形式存在,而是转化为非晶态。难溶于水的药物DA由晶态转变为无定形态后,可以增加其溶解度和溶出度,提高药物的生物利用度[28]。如图7(b)所示,DA 在260℃处出现熔融峰;PLGA 为无定形态,在50℃表现出玻璃转化温度,无明显熔融峰;VA 和PVP 由于脱水表现出较宽的吸热峰,峰值分别为96℃和112℃。单轴和同轴静电喷雾制备出的产物SDMs4 和CDMs4 同样出现了吸热峰,峰值分别为106℃和101℃,介于VA 和PVP的吸热温度之间,表明电喷微球成功负载了药物VA。SDMs4 中未见DA 的吸热峰,表明DA 成功被包载于核壳型微球中,并以无定形态存在。但是,CDMs4 的DSC 热图中,在250℃处出现了一个较小的吸热峰,表明同轴静电喷雾制备核壳型载药微球时,少部分DA并未成功包载于微球中,而是吸附于微球表面。

图6 PVP浓度为80g/L时两种核壳型载药微球的TEM图
2.4 核壳型载药微球的体外释药特征
通过测定和计算,SDMs4 中VA 和DA 的载药量分别为2.13%和0.68%,CDMs4中VA和DA的载药量分别为2.08%和5.13%。两种载药微球中DA的载药量差别较大,这是由于SDMs4 中的载药内核是利用溶剂挥发法制备的,该过程中药物DA在相间的扩散导致载药量较低[29];而CDMs4的载药内核直接由同轴静电喷雾所得,药物的损失主要是少量药物分子和载药微球喷到接收器之外引起的[21],所以载药量较高。

图7 原材料和两种核壳型载药微球的物理性质
两种核壳型载药微球SDMs4 和CDMs4 的释药结果如图8所示。由图8(a)可见,两种微球中的VA均在0.5h内基本完全释放到PBS介质中。这归因于PVP 的亲水性强以及VA 的水溶性好,使得VA 与PVP分子同时溶解于释放介质中。图8(b)是两种微球中DA 的释药情况,可以看出,与SDMs4 相比,同轴静电喷雾制备的核壳型微球CDMs4中DA突释明显,在1h 内已释放42%的药量,结合前面DSC的结果分析,这主要是由于一部分DA吸附在核壳型微球的表面,会快速释放到介质中,同时负载于壳层中的DA也会随着PVP的溶解而快速释放。而SDMs4 中的DA 在1h 内仅释放了24%左右。随着PLGA 的降解,SDMs4 和CDMs4 内核中负载的DA被缓慢释放,在28天时,两种载药微球中DA的累积释药量分别为73%和90%。可以看出,同轴静电喷雾制备的核壳型载药微球中,内核药物释放更完全。对比VA 和DA 的释药情况,可以看出单轴静电喷雾和同轴静电喷雾制备的核壳型双重载药微球均能实现VA和DA两种药物的速释-缓释梯级释放。两种方法相比较,同轴静电喷雾法由于药物损失少、步骤简便、制备过程中不需要使用表面活性剂且制备得到的载药微球中药物DA释放更完全而更具有优势。
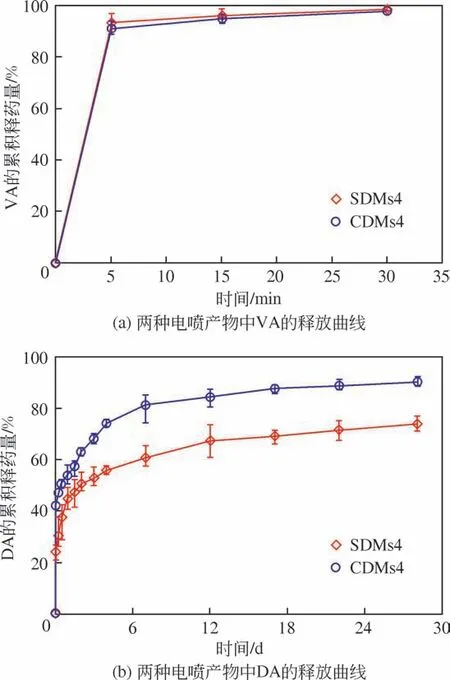
图8 两种核壳型载药微球在PBS缓冲溶液中的释药曲线
3 结论
利用单轴静电喷雾和同轴静电喷雾均成功制备出同时载有两种药物的核壳型微球给药系统,其中PLGA 为内核基质,PVP 为外壳基质。当电喷前体PVP浓度为80g/L时,均可得到大小均一、具有核-壳结构的微球。两种方法制备出的核壳型双重载药微球中抗菌药物VA负载于壳层,促成骨分化的药物DA 主要负载于内核,且晶体材料中的DA 基本都变为无定形态,有利于提高DA 的生物利用度;体外释药结果表明,两种微球均能实现VA 速释-DA缓释的梯级释放行为。两种静电喷雾方法相比,同轴静电喷雾法具有步骤简便、所得微球中内核载药量更高、药物释放更完全的优势。本文的静电喷雾法可将制备的具有梯级释药性能的核壳型双重载药微球直接喷涂于不锈钢、钛及钛合金等临床常用的植入体材料表面,进而实现更合理的临床疗效。与常见的植入物材料改性方法相比,本研究所设计的策略操作简单、方法便捷,喷涂后由于药物释放,可以赋予植入物材料抗菌性能并促进成骨分化,在组织工程方面具有很好的临床应用前景。
